Informator CKE matury dwujęzycznej (tłumaczenie BiologHelp), Poziom rozszerzony (Formuła 2023) - Zadanie 6. (1 pkt)
Wykres przedstawia rozpuszczalność chloranu(V) potasu w wodzie w zakresie temperatur 0°C – 80°C.
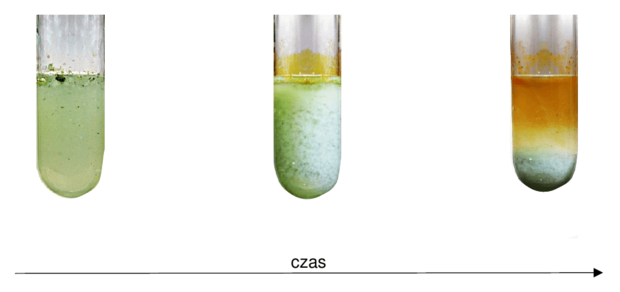
Przeprowadzono eksperyment, którego przebieg przedstawiono na poniższym schemacie.
Następnie zawartość zlewki ogrzano do temperatury 45°C.
Określ, czy po podgrzaniu sól w zlewce uległa całkowitemu rozpuszczeniu i czy uzyskano jednorodny roztwór. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie: