Matura Czerwiec 2021, Poziom rozszerzony (Formuła 2015) - Zadanie 7. (1 pkt)
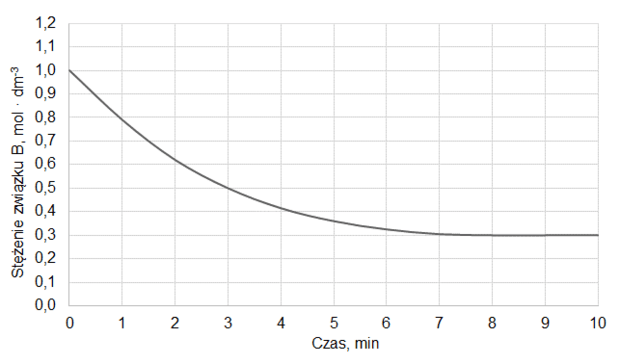
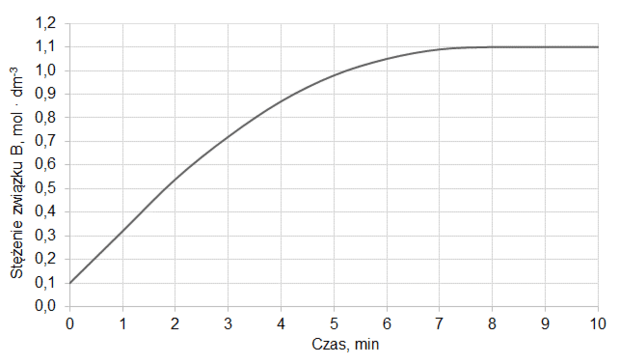
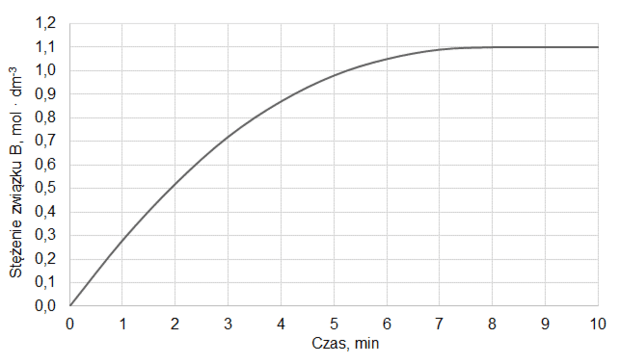
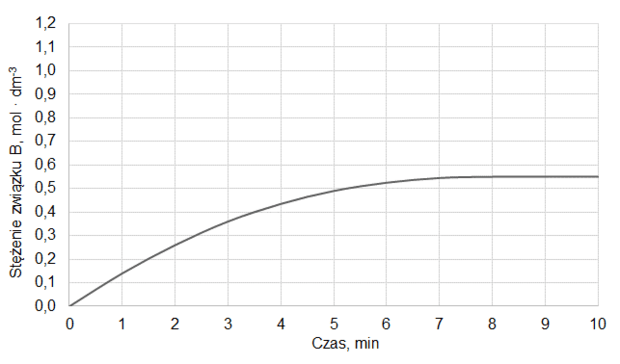
Do reaktora, w którym znajdowała się stała substancja X, wprowadzono pod ciśnieniem atmosferycznym gazową substancję Y i zapoczątkowano reakcję chemiczną, w wyniku której powstawał gaz Z. Po 10 minutach, w temperaturze T1, ustaliła się równowaga opisana równaniem:
X (s) + Y (g) ⇄ Z (g)
Na wykresie przedstawiono wyniki pomiaru liczby moli gazowych reagentów w trakcie trwania procesu oraz po ustaleniu się stanu równowagi w temperaturze T1. W piętnastej minucie eksperymentu zmieniono w układzie temperaturę na T2 wyższą od T1, czego konsekwencją było ustalenie się nowego stanu równowagi po dwudziestu minutach eksperymentu, co także zilustrowano na poniższym wykresie.
Rozstrzygnij, czy reakcja tworzenia związku Z jest procesem endoenergetycznym. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie: