Chemia - Arkusz pokazowy CKE Marzec 2022, Poziom rozszerzony (Formuła 2023) - Zadanie 6.
Metoda VSEPR pozwala określać kształt cząsteczek zbudowanych z atomów pierwiastków grup głównych. W cząsteczce należy wyróżnić atom centralny (np. atom tlenu w cząsteczce H2O) i ustalić liczbę wolnych par elektronowych na jego zewnętrznej powłoce. Następnie zsumować liczbę podstawników związanych z atomem centralnym (𝑥) i liczbę jego wolnych par elektronowych (𝑦). W ten sposób otrzymuje się tzw. liczbę przestrzenną (𝐿p = 𝑥 + 𝑦), która determinuje kształt cząsteczki. Ponieważ zarówno wolne, jak i wiążące pary elektronowe wzajemnie się odpychają, wszystkie elementy składające się na liczbę przestrzenną (podstawniki i wolne pary elektronowe) zajmują jak najbardziej odległe od siebie położenia wokół atomu centralnego.
6.1. (0–2)
Uzupełnij poniższą tabelę – dla wymienionych cząsteczek napisz wartości 𝒙 i 𝒚 oraz określ kształt cząsteczki (liniowa, kątowa, trójkątna, tetraedryczna).
| CO2 | SO2 | OF2 | |
|---|---|---|---|
| 𝑥 | |||
| 𝑦 | |||
| kształt cząsteczki |
6.2. (0–1)
Poniżej przedstawiono dwa modele przestrzenne (I i II) różnych cząsteczek o wzorze ogólnym AB4.
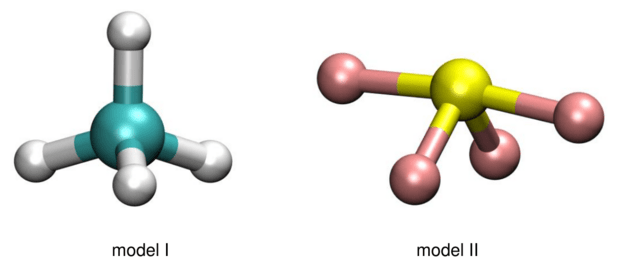
Rozstrzygnij, który z przedstawionych modeli (I albo II) jest ilustracją kształtu cząsteczki SF4. Uzasadnij swój wybór. Zastosuj metodę VSEPR.
Cząsteczkę SF4 przedstawia model
Uzasadnienie:
6.3. (0–1)
W teorii VSEPR przyjmuje się, że kąty między wiązaniami w drobinach zależą od siły, z jaką odpychają się pary elektronowe znajdujące się na zewnętrznej powłoce. Siła odpychania par elektronowych powłoki walencyjnej maleje w kolejności: wolna para elektronowa – wolna para elektronowa > wolna para elektronowa – wiążąca para elektronowa > wiążąca para elektronowa – wiążąca para elektronowa. Oznacza to, że w drobinach, w których nie ma wolnych par elektronowych, kąty między wiązaniami są najbardziej zbliżone do wartości teoretycznych opisujących idealną strukturę geometryczną drobiny, a w cząsteczkach zawierających wolne pary elektronowe obserwuje się zmniejszenie kątów między wiązaniami.
Wpisz do tabeli wartości kątów między wiązaniami N–H w wymienionych drobinach (NH–2, NH3, NH+4). Wartości tych kątów wybierz spośród następujących: 180°, 120°, 109°,107°, 105°.
| Drobina | NH–2 | NH3 | NH+4 |
| Wartość kąta między wiązaniami |
Rozwiązanie
6.1. (0–2)
Zasady oceniania
2 pkt – poprawne uzupełnienie trzech kolumn tabeli.
1 pkt – poprawne uzupełnienie dwóch kolumn tabeli.
0 pkt – odpowiedź niespełniająca powyższych kryteriów albo brak odpowiedzi.
Rozwiązanie
| CO2 | SO2 | OF2 | |
|---|---|---|---|
| 𝑥 | 2 | 2 | 2 |
| 𝑦 | 0 | 1 | 2 |
| kształt cząsteczki | liniowa | kątowa ALBO V-kształtna | kątowa ALBO V-kształtna |
6.2. (0–1)
Zasady oceniania
1 pkt – poprawne wskazanie modelu cząsteczki SF4 i poprawne uzasadnienie.
0 pkt – odpowiedź niespełniająca powyższego kryterium albo brak odpowiedzi.
Przykładowe rozwiązania
Cząsteczkę SF4 przedstawia model II
Uzasadnienie: W cząsteczce SF4 na zewnętrznej powłoce elektronowej atomu centralnego znajduje się 5 par elektronów (10 elektronów: 6 pochodzących od atomu siarki oraz 4 pochodzące od atomów fluoru).
ALBO
Cząsteczka SF4 nie może być tetraedryczna, gdyż jej liczba przestrzenna jest równa 5.
ALBO
W cząsteczce SF4 są cztery ligandy i jedna wolna para elektronowa.
6.3. (0–1)
Zasady oceniania
1 pkt – poprawne uzupełnienie tabeli.
0 pkt – odpowiedź niespełniająca powyższego kryterium albo brak odpowiedzi.
Rozwiązanie
| Drobina | NH–2 | NH3 | NH+4 |
| Wartość kąta między wiązaniami | 105° | 107° | 109° |
