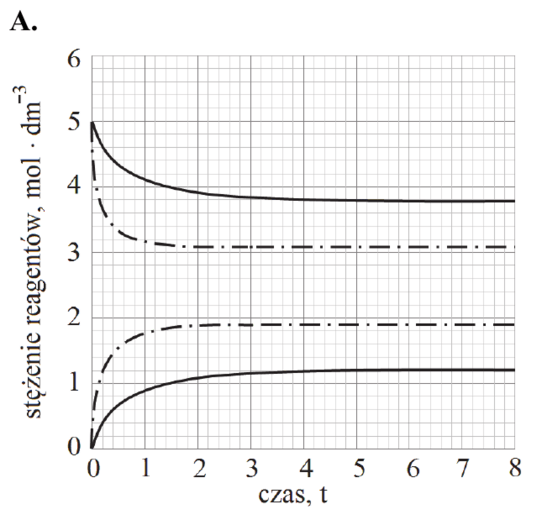
Chemia - Matura Czerwiec 2018, Poziom rozszerzony (Formuła 2007) - Zadanie 17.
Do reaktora wprowadzono pod ciśnieniem atmosferycznym gazową substancję X i zapoczątkowano reakcje chemiczną, w wyniku której powstał gaz Y. Po pewnym czasie, w temperaturze T1, ustaliła się równowaga opisana równaniem:
X (g) ⇄ Y (g) ΔH > 0
Na wykresie przedstawiono wyniki pomiaru stężeń reagentów X i Y w trakcie trwania procesu oraz po ustaleniu się stanu równowagi dynamicznej w temperaturze T1.
Następnie powtórzono ten eksperyment przy tym samym stężeniu początkowym substancji X i tym samym ciśnieniu, ale w temperaturze T2 wyższej od temperatury T1.
17.1. (1 pkt)
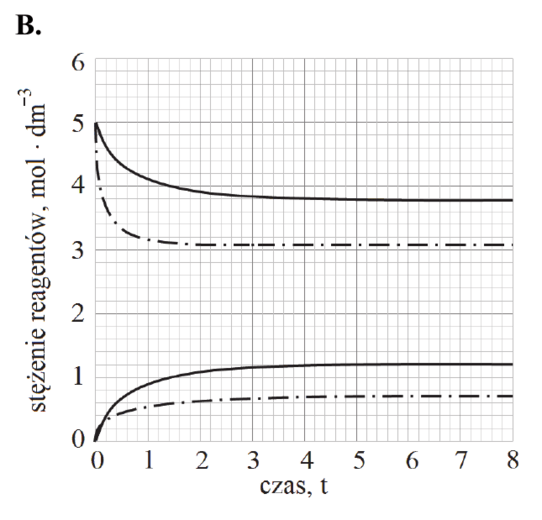
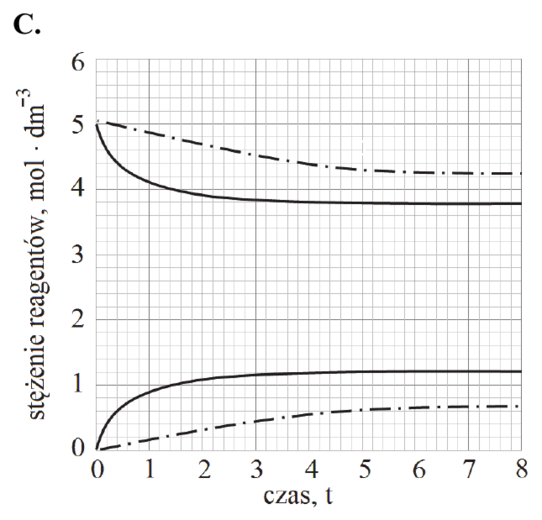
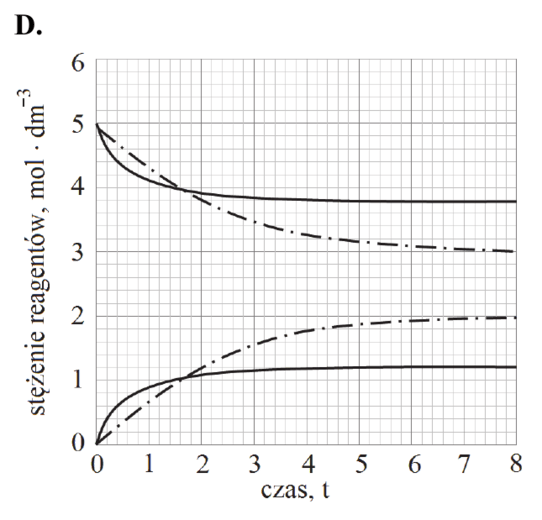
Zaznacz wykres, który przedstawia zmianę stężenia reagentów w czasie trwania procesu pod ciśnieniem atmosferycznym w temperaturze T2 (linia przerywana), wyższej niż temperatura T1 (linia ciągła).
17.2. (1 pkt)
Oceń, czy zmieni się (wzrośnie albo zmaleje), czy też nie ulegnie zmianie wydajność reakcji otrzymywania substancji Y, jeśli w układzie będącym w stanie równowagi nastąpi wzrost ciśnienia w warunkach izotermicznych. Odpowiedź uzasadnij.
Rozwiązanie
17.1. (1 pkt)
Schemat punktowania
1 p. – za poprawny wybór wykresu.
0 p. – za błędne wskazanie wykresu albo brak odpowiedzi.
Poprawna odpowiedź:
A
17.2. (1 pkt)
Schemat punktowania
1 p. – za poprawną ocenę i uzasadnienie.
0 p. – za odpowiedź niepełną lub błędną albo brak odpowiedzi.
Poprawna odpowiedź
Wzrost ciśnienie nie wpłynie na wydajność opisanej reakcji chemicznej, gdyż po stronie
substratów i produktów znajduje się taka sama liczba moli reagentów (lub substraty i produkty
mają taką samą objętość).