Chemia - Matura Maj 2021, Poziom rozszerzony (Formuła 2015) - Zadanie 6.
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
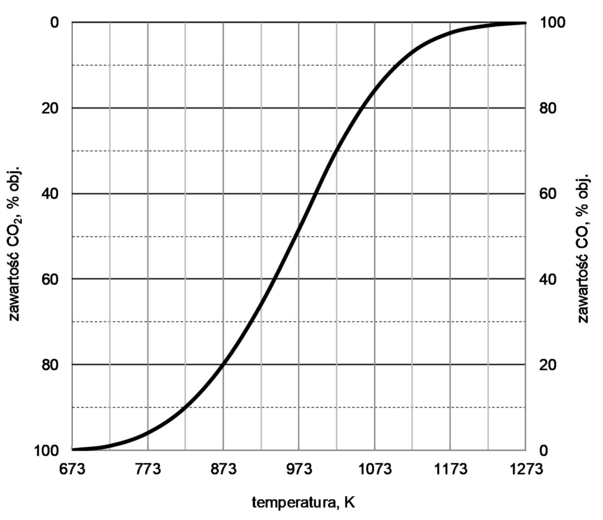
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
W mieszaninie gazów doskonałych sumaryczne stężenie molowe wyraża się wzorem:
c = pR ∙ T
gdzie:
p – ciśnienie w hPa
T – temperatura w K
R – stała gazowa równa 83,1 hPa∙dm3 ∙K–1∙mol–1.
Ponadto
Oblicz wartość stężeniowej stałej równowagi opisanej przemiany w temperaturze 873 K i pod ciśnieniem 1013 hPa. Wyrażenie na stężeniową stałą równowagi tej reakcji przyjmuje postać:
K = [CO]2[CO2]
Załóż, że CO i CO2 są gazami doskonałymi.
Rozwiązanie
Zasady oceniania
2 pkt – zastosowanie poprawnej metody, poprawne wykonanie obliczeń oraz podanie wyniku
jako wielkości niemianowanej.
1 pkt – zastosowanie poprawnej metody, ale:
– popełnienie błędów rachunkowych prowadzących do błędnego wyniku liczbowego.
LUB
– podanie wyniku z błędną jednostką.
0 pkt – zastosowanie błędnej metody obliczenia albo brak rozwiązania.
Uwaga 1.: Należy zwrócić uwagę na zależność wyniku liczbowego od przyjętych zaokrągleń.
Za poprawny należy uznać każdy wynik będący konsekwencją zastosowanej poprawnej
metody i poprawnych obliczeń.
Uwaga 2.: Podanie wartości stałej równowagi z jednostką wynikającą z podstawienia
do wyrażenia na stałą równowagi K stężenia molowego reagentów – nie skutkuje utratą
punktu.
Uwaga 3.: Rozwiązanie zadania, w którym zdający wykonuje obliczenia dla warunków innych
niż określono w zadaniu, np. dla warunków normalnych, jest niepoprawne.
Przykładowe rozwiązania
Rozwiązanie I:
K = [CO]2[CO2]
w temperaturze 873 K: zaw. % CO2 – 80%, a zaw. % CO – 20%
c = pR ∙ T = 101383,1 ∙ 873 = 0,014 mol∙dm–3
[CO] = 0,2 ∙ 0,014 = 0,0028 mol∙dm–3
[CO2] = 0,8 ∙ 0,014 = 0,0112 mol∙dm–3
K = 0,002820,0112 = 6,96 ∙ 10–4 ALBO 7 ∙ 10–4
Rozwiązanie II:
pV = nRT ⇒ V = nRTp
n = 1 mol ⇒ V = 1 ∙ 83,1 ∙ 8731013 = 71,615 dm3
K = [CO]2[CO2] ⇒ K = [ncoV]2nco2V = (0,2)2 0,8 ∙ 71,615 = 6,98 ∙ 10–4
K = 6,96 ∙ 10–4 ALBO 7 ∙ 10–4
Rozwiązanie III:
[CO]2[CO2] = 2080 = 14
[CO] + 4[CO] = 0,014
[CO] = 0,0028 moldm3
[CO2] = 0,0112 moldm3
K = (0,0028)20,0112
K = 7 ∙ 10–4
