Allelopatyczny potencjał wyciągów z chabra bławatka i jęczmienia zwyczajnego - praca badawcza z Olimpiady Biologicznej

Zapraszam do zapoznania się z kolejną, ciekawą pracą badawczą zgłoszoną na Olimpiadę Biologiczną. Niestety praca nie była oceniana przez komisję olimpiady, jednak zainteresowane osoby znajdą pod artykułem recenzję przygotowaną przeze mnie.
Zamieszczone na stronie prace służą jedynie zapoznaniu się z ogólnym charakterem prac badawczych zgłaszanych na Olimpiadę Biologiczną. Niedopuszczalne jest kopiowanie całej koncepcji wykonania pracy bądź fragmentów jej tekstu we własnej pracy. Tego typu działania będą uznawane za plagiat i mogą wiązać się z odrzuceniem pracy przez komisję olimpiady.
Wzajemny wpływ na energię i zdolność kiełkowania chabra bławatka (Centaurea cyanus L.) i jęczmienia zwyczajnego 'Radek' (Hordeum vulgare L.) w zależności od potencjału allelopatycznego ich wodnych wyciągów.
AUTOR: Emilia Staszór
Streszczenie
Celem badań była ocena wzajemnego wpływu wodnych wyciągów o zróżnicowanym stężeniu wykonanych ze świeżych liści chabra bławatka (Centaurea cyanus L.) i jęczmienia zwyczajnego odmiany „Radek” (Hordeum vulgare L.) na kiełkowanie nasion i początkowy wzrost tych gatunków. Wrażliwość badanych roślin na aplikowane wyciągi określono w porównaniu do obiektu kontrolnego na podstawie wykonanych analiz energii i zdolności kiełkowania. Dodatkowo dla jęczmienia wykonano pomiary długości najdłuższego korzenia zarodkowego, liczby oraz świeżej i suchej masy korzeni, długości pierwszego liścia, świeżej i suchej masy liści. Dla chabra wykonano pomiary długości pędu, biomasy świeżej i suchej. Wyciągi wykonane z 5 g i większej ilości świeżych liści chabra na 100 ml wody istotnie hamowały wszystkie badane parametry jęczmienia, a wszystkie wykorzystane w badaniach wyciągi z chwastu hamowały w znaczący sposób energię i zdolność kiełkowania zboża. Wyciągi wykonane z 1 g i 2 g świeżych liści jęczmienia na 100 ml wody istotnie stymulowały wzrost pędów chabra. Wyciąg wykonany z największej ilości liści zboża, w mniej istotny sposób hamował wzrost chwastu. Wyciągi z jęczmienia nie miały istotnego wpływu na energię i zdolność kiełkowania chabra.
Wstęp
Niekorzystny wpływ zachwaszczenia na uprawy nie jest związany wyłącznie z międzygatunkową konkurencją o podstawowe zasoby. Rozpowszechnionym w fitocenozie zjawiskiem jest wzajemne oddziaływanie w postaci wydzielania do środowiska związków chemicznych o charakterze allelopatin. Rośliny oddziałują na siebie poprzez związki chemiczne, zwane kolinami, które w sposób inhibicyjny lub stymulujący wpływają na ich kiełkowanie oraz wzrost i rozwój (Biały i in., 1990; Ohno i Doolan, 2001; Majchrzak, 2007). Wiele gatunków inwazyjnych zawdzięcza sukces właśnie zdolnościom allelopatycznego oddziaływania (Gwiazdowska, 2005). Ze względu na wysoki udział zbóż w strukturze zasiewów w Polsce, stanowiący 71% (GUS 2018), ważne jest zagadnienie ich zachwaszczenia. Jest to jeden z najczęściej wymienianych czynników powodujących spadek plonowania (Idziak, Michalski, 2003; Woźniak, 2003). Jest to wynikiem wydzielania przez chwasty do środowiska glebowego związków chemicznych, powodujących zahamowanie wzrostu roślin uprawnych i opóźnienie ich rozwoju (Gniazdowska, 2007).
Ziarno jęczmienia jest wykorzystywane w przemyśle browarniczym i paszowym. Stanowi ważny składnik w żywieniu ludzi i ma wysoką wartość odżywczą dla zwierząt (Boros i in.; 1996; Gąsiorowski, 1997). Jęczmień stanowi ważny składnik jarych mieszanek zbożowych. W roku 2017, w strukturze zasiewów zbóż podstawowych z mieszankami zbożowymi, według GUS, jęczmień jary stanowił 10,0%.
Chaber bławatek jest gatunkiem o dużej produktywności nasion wynoszącej od 700 do 1600 sztuk z jednej rośliny. Charakterystycznym jest, że nasiona tego taksonu znajdujące się w glebie zachowują zdolność kiełkowania nawet przez okres 5 – 10 lat (Klaaßen, Freitag, 2004). Ponadto, niełupki będące w glebie w bliskim sąsiedztwie ziarniaków zbóż, kiełkują niemal równocześnie, przez co już w początkowym okresie rozwoju konkurują z nimi o przestrzeń życiową (Marczewska-Kolasa i in., 2012).
Wpływ, jaki wywierają na siebie te rośliny, jest istotny ze względu na znaczenie jęczmienia, jako rośliny uprawnej i rosnącego zagrożenia ze strony chwastów zimujących, w tym chabra bławatka (Tryjanowski, 2016). Temat oddziaływania chamujących, w tym chabra bławatka (Tryjanowski, 2016). Temat oddziaływania chabra bławatka na jęczmień zwyczajny poruszał w swoich pracach Jaskulski (1999). Brak jednak informacji na temat potencjału allelopatycznego tych roślin w odwrotnej sytuacji. W uprawie jęczmienia jarego najsilniejszą grupę zachwaszczającą zboże stanowią chwasty dwuliścienne. Z tej klasy chwastów w największym nasileniu występuje m.in. chaber bławatek (Krochmal-Marczak i in., 2014). Poznanie tego zjawiska może więc być znaczące w opracowywaniu strategii dotyczącej integrowanej produkcji jęczmienia jarego. Jest to podstawą m.in. w ekologicznych gospodarstwach, w których strategia zwalczania chwastów zakłada, iż łan rośliny uprawnej powinien osiągnąć dominację nad chwastami (Rudnicki i in.,1996).
Celem podjętych badań była ocena wzajemnego wpływu wodnych wyciągów badanych roślin, o zróżnicowanym stężeniu, na kiełkowanie i początkowy wzrost gatunku chwastu pospolicie występującego w Polsce - chabra bławatka (Centaurea cyanus L.) i jarej rośliny uprawnej - jęczmienia zwyczajnego (Hordeum vulgare ‘Radek’ L.).
Materiały i metody
Ziarniaki jęczmienia zwyczajnego (Hordeum vulgare L.) jarego odmiany Radek pozyskano z Gospodarstwa Nasiennego Adam Nowak, zajmującego się produkcją kwalifikowanego materiału siewnego, nasiona chabra bławatka (Centaurea cyanus L.) zebrano z pięciu różnych stanowisk z terenu wsi Bujny, położonej w gminie Wola Krzysztoporska. Do sporządzenia wodnych wyciągów wykorzystano świeże liście jęczmienia pozyskane z roślin w fazie krzewienia (wg skali BBCH) uprawianych na potrzeby doświadczenia w warunkach domowych. Świeże liście chabra, wykorzystane do sporządzenia osobnych wyciągów, zebrano z roślin chwastu w ósmej głównej fazie rozwojowej wg skali BBCH (Adamczewski, 2011) z tego samego terenu co nasiona.
Określoną masę liści (odpowiednio: 1 g, 2 g, 5 g i 8 g) zalano 100 ml wody destylowanej zarówno w przypadku badania wpływu wyciągów z liści chabra jak jęczmienia. Po 24 godzinach moczenia uzyskany roztwór cedzono przez bibułę filtracyjną do uzyskania klarownego wyciągu i przygotowano do aplikacji. Do każdej aplikacji przygotowywano świeży wyciąg.
Nasiona kiełkowały na podłożu złożonym z dwóch warstw bibuły filtracyjnej Whatmana 1, na szalkach Petriego o średnicy 10 cm. Nasiona badanych gatunków wysiewano po 40 sztuk na szalkę. Ziarniaki jęczmienia były zaprawione preparatem Maxim Star 025 FS. Bibułę nasączono 20 ml odpowiedniego wyciągu, a następnie codziennie podlewano nasiona stosując po 10 ml odpowiedniego roztworu na szalkę. Próbę kontrolną stanowiła szalka podlewana jedynie wodą destylowaną. Oba doświadczenia przeprowadzono w dwóch niezależnych seriach po pięć powtórzeń w lipcu i sierpniu 2018 r. Kiełkowanie badanych roślin odbywało się w zamkniętym pomieszczeniu przy naturalnym oświetleniu, w temperaturze 20-25°C i wilgotności powietrza 60%. Szalki z hodowlą ustawiono na blacie naprzeciwko wschodniego okna.
Po czterech dobach oceniono energię kiełkowania [EK], zarówno dla jęczmienia jak i chabra. Po trzech kolejnych dniach określono zdolność kiełkowania [ZK] jęczmienia (Osińska, 2004), a w 22 dniu od wysiania określono zdolność kiełkowania chabra (Hunia, 2017). Morfologię jęczmienia określano ósmego dnia doświadczenia na podstawie długości najdłuższego korzenia zarodkowego, liczby oraz świeżej i suchej masy korzeni, długości pierwszego liścia, świeżej i suchej masy liści. Dla chabra 23 dnia od wysiania dokonano pomiaru długości, biomasy świeżej i suchej pędu. Materiał suszono trzykrotnie przez okres 20 min w temperaturze 80°C w elektrycznym piekarniku. Pomiary długości dokonywano z dokładnością do 1 mm przy użyciu papieru milimetrowego, a masy z dokładnością do 1 mg przy użyciu wagi elektronicznej firmy Ha-series. Dodatkowo prowadzono codzienną dokumentację fotograficzną przebiegu doświadczenia.
Obliczono wartości średnie i odchylenia standardowe otrzymanych wyników. Sprawdzono rozkład zebranych danych dla poszczególnych prób testem Shapiro-Wilka. Po zweryfikowaniu homogeniczności wariancji testem Browna-Forsythe’a uzyskane wyniki poddano analizie wariancji ANOVA, na poziomie istotności różnic α=0,05. Różnice między średnimi określono testem Tukeya. Do opracowania wyników użyto programów Microso-ft Excel Office 2007 i GraphPad Prism 8.0.0.
Wyniki
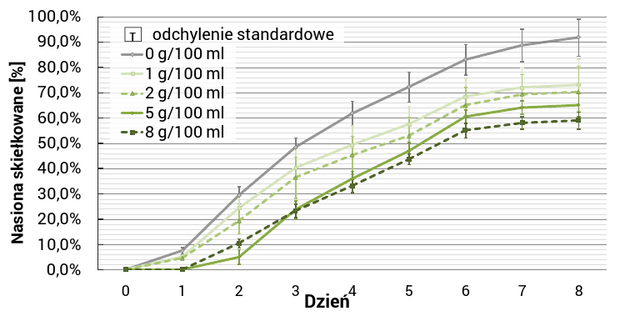
Doświadczenie wykazało, iż energia i zdolność kiełkowania ziarniaków jęczmienia malała wraz ze wzrostem stężeń wodnych wyciągów wykonanych z liści chabra (Ryc. 1.). Istotnie negatywny wpływ (P ≤ 0.0001), w odniesieniu do próby kontrolnej, zaobserwowano dla każdego stężenia.
Długość pierwszego liścia i najdłuższego korzenia zarodkowego jęczmienia była mniejsza w istotny sposób, w porównaniu do próby kontrolnej, tylko dla dwóch największych stężeń (Ryc. 2.). Podobne zależności uzyskano dla masy liści i korzeni jęczmienia (Ryc. 3). Dla najwyższego stężenia (8 g/100 ml) średnia długość pierwszego liścia i najdłuższego korzenia była mniejsza odpowiednio o 42% i 59%. Świeża masa liści i korzeni, dla najwyższego stężenia, była mniejsza o 47% i 72%, a sucha masa o 64% i 77%. Stosunek suchej do świeżej masy liści i tego samego parametru korzeni, zmalał dla wszystkich stężeń w porównaniu do próby kontrolnej. Różnice te były istotne tylko dla dwóch najwyższych stężeń, jednak obie charakteryzowały się małą wartością współczynnika - P ≤ 0.05.
![Ryc. 2. Wpływ wodnych wyciągów ze świeżych liści chabra bławatka na (A) długość pierwszego liścia (B) długość najdłuższego korzenia jęczmienia zwyczajnego w odniesieniu do próby kontrolnej (8. dzień od wysiewu). Sposób oznaczenia poziomu istotności różnicy: nieistotna statystycznie [ns] - P > 0.05; * - P ≤ 0.05; ** - P ≤ 0.01; *** - P ≤ 0.001; **** - P ≤ 0.0001.](/sites/default/files/styles/large/public/artykuly/obrazy/praca-20-ryc-2.png?itok=ih1OoX31)
![Ryc. 3. Wpływ wodnych wyciągów ze świeżych liści chabra bławatka na biomasę (A) liści, (B) korzeni jęczmienia zwyczajnego w odniesieniu do próby kontrolnej (8. dzień od wysiewu). Sposób oznaczenia poziomu istotności różnicy: nieistotna statystycznie [ns] - P > 0.05; * - P ≤ 0.05; ** - P ≤ 0.01; *** - P ≤ 0.001; **** - P ≤ 0.0001.](/sites/default/files/styles/large/public/artykuly/obrazy/praca-20-ryc-3.png?itok=UyP3Kyf0)
Średnia i mediana liczby korzeni wynosiła dla: próby kontrolnej - 6.8 i 7; stężenia 1 g/100 ml - 6.2 i 6; 2 g/100 ml - 6.4 i 6; 5 g/100 ml - 6.6 i 7; 8 g/100 ml - 7.0 i 7. Różnice nie były istotne statystycznie.
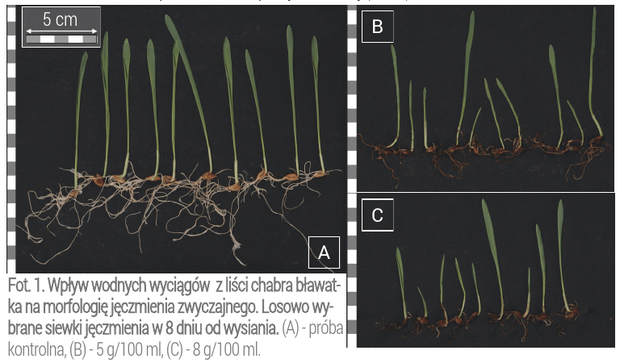
W celu zobrazowania wpływu zastosowanych wyciągów, z chabra na ziarniaki jęczmienia uprawianych w przedstawionej pracy, zamieszczono zdjęcia tych grup, w których zaobserwowano istotne różnice w porównaniu do próby kontrolnej (Fot. 1).
Energia kiełkowania chabra bławatka w zależności od stężeń wyciągów wykonanych z liści jęczmienia zwyczajnego; 1 g/100 ml, 2 g/100 ml, 5 g/100 ml i 8 g/100 ml wyniosła kolejno 96.1%, 93.2%, 85.6%, 68.9%, a zdolność kiełkowania 97.8%, 94.2%, 96.3%, 93.4%. W porównaniu do próby kontrolnej, dla której te wartości wyniosły 90.7% - [EK], 96.9% - [ZK], nie były to wartości różniące się w sposób istotny statystycznie.
Odnotowano, iż niższe stężenia wyciągów z liści jęczmienia (1 g/100 ml, 2 g/100 ml) stymulowały w sposób istotny statystycznie wzrost siewek chabra (Ryc. 4.). Średnia długość dla najniższego stężenia, w porównaniu do próby kontrolnej, wzrosła odpowiednio o 47% a świeża masa o 65%. Wyciąg o stężeniu 8 g /100 ml hamował wzrost chabra o 22% i wpływał na zmniejszenie świeżej masy o 60%. Nie stwierdzono statystycznej istotności zmian w stosunku masy suchej do świeżej pędu, w porównaniu do próby kontrolnej.
![Ryc. 4. Wpływ wodnych wyciągów ze świeżych liści jęczmienia zwyczajnego na (A) długość i (B) biomasę pędu siewek chabra bławatka w odniesieniu do próby kontrolnej (22. dzień od wysiewu). Sposób oznaczenia poziomu istotności różnicy; nieistotna statystycznie [ns] - P > 0.05; * - P ≤ 0.05; ** - P ≤ 0.01; *** - P ≤ 0.001; **** - P ≤ 0.0001.](/sites/default/files/styles/large/public/artykuly/obrazy/praca-20-ryc-4.png?itok=2lpcDxC7)
Obserwacje makroskopowe wykazały różnice w długości korzeni chabrów poddanych działaniu allelozwiązków w porównaniu do siewek z próby kontrolnej (Fot. 2).

Dyskusja
Już dla najniższego stężenia wyciągu z liści chwastu zdolność kiełkowania jęczmienia nie zawierała się w wyznaczonych normach (Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi, 2007) i wynosiła mniej niż 85% (Ryc. 1). Odmienne wyniki uzyskał Jaskulski (1999), który nie wykazał istotnego wpływu wodnych ekstraktów z chabra na zdolność kiełkowania jęczmienia. Różnica może wynikać z użycia przez Jaskulskiego odmiennej metody. Do sporządzenia wyciągu, w przeciwieństwie do zaprezentowanej pracy, wykorzystał całe pędy rośliny. Prowadzone do tej pory badania dowodzą, że za najbogatsze źródło związków allelopatycznych w roślinie uznaje się jej liście (Wójcik-Wojtkowiak i in., 1998; Gniazdowska i in., 2004).
Konsekwencją wpływu negatywnego chabra na jęczmień, m.in. znacznego obniżenia masy korzeni, długości pierwszego liścia (Ryc. 2, 3), może być spadek plonów. Wodne wyciągi wykonane ze świeżych liści chabra oddziałują hamująco również na wzrost pszenicy ozimej i żyta. W przypadku tych roślin, podobnie jak w badaniach własnych, bardziej wrażliwe na działanie roztworów okazały się korzenie niż pędy (Marczewska - Kolasa i in., 2017).
W przeprowadzonym doświadczeniu użyto liści z dojrzałych, kwitnących osobników chabra bławatka. Nie testowano liści z młodych siewek, być może reakcja na nie byłaby większa, gdyż jak wynika z podań literaturowych (Wójcik-Wojtkowiak i in., 1998), potencjał allelopatyczny zależy od wieku rośliny, wyższy jest u młodych roślin i maleje wraz z osiąganiem przez nie pełnej dojrzałości.
W literaturze, poświęconej zjawisku allelopatii, najszerzej opisywany jest inhibicyjny efekt oddziaływania, lecz nie w każdym przypadku takie tendencje są obserwowane (Ciesielska, Borkowska, 2010). Badania wykazały stymulujący - przy niższych stężeniach i hamujący - przy wyższych stężeniach, wpływ wyciągów z liści jęczmienia na wzrost i przyrost masy pędów chabrów (Ryc. 4.). W połączeniu z nasilającym się, wraz ze wzrostem stężeń, negatywnym wpływem wyciągów z liści chabrów na jęczmień, te zależności mogą być przyczyną charakterystycznego peryferycznego rozmieszczenia chabra w łanach jęczmienia (Machałek, 2015). Jednakże taki wniosek wymaga dalszych badań, zarówno laboratoryjnych i terenowych, które potwierdziłyby jego słuszność.
Nie wykonywano oddzielnych pomiarów dla masy i długości korzeni chabrów, ale na podstawie dokumentacji fotograficznej można zwrócić uwagę na redukcję korzeni roślin w przypadku oddziaływania na nie najwyższymi stężeniami (Fot. 2). W badaniach, dotyczących wpływu allelozwiązków w jęczmieniu na gorczycę białą, sprawdzono wpływ hordeiny i graminy. W wyniku działania tych związków nastąpiła widoczna redukcja korzeni i utrata wigoru korzonków gorczycy (Liu i Lovett, 1993). Wykorzystane związki znajdują się w liściach jęczmienia (Belz, 2007), nie można jednoznacznie stwierdzić, czy to te same związki, co w przytoczonych badaniach, miały wpływ na zmianę morfologii korzeni chabra.
W badaniach przeprowadzonych przez Ashrafi (2009), w przeciwieństwie do badań własnych, niezależnie od zastosowanego stężenia, ekstrakty jęczmienne zmniejszały długość i masę hipokotylu oraz długość i masę korzeni perzu właściwego, oddziaływały również w sposób negatywny na kiełkowanie tej rośliny. Jęczmień wpływał również hamująco na kiełkowanie takich chwastów jak gwiazdnica pospolita i tasznik pospolity (Khalid, 2002). Przytoczone i własne badania wykazują, że jęczmień jest w stanie, w pewnym stopniu, dzięki uwolnieniu allelopatin do jego najbliższe Możliwym jest, że włączegleby zapobiegać wnikaniu chwastów w terytorium. nie jęczmienia do sekwencji rotacji roślin, pozwoli tłumić rozwój chwastów, poprzez uwolnienia do gleby allelozwiązków, które zmniejszą zachwaszczenie w późniejszych uprawach (Légère, 2002). Jednak w sytuacji gdy stężenie allelopatin jęczmienia jest niskie i stymulują one wzrost chabrów może to doprowadzić do sytuacji, w której siewki zbóż będą rozwijać się w momencie gdy konkurencja ze strony tego chwastu będzie zbyt silna.
Prosta, ogólnodostępna metoda wykonania wyciągu z jęczmienia może znaleźć zastosowanie w ogrodnictwie, ponieważ chabry są coraz bardziej popularną rośliną ozdobną. Słabe wyciągi z jęczmienia mają zdecydowanie pozytywny wpływ w pierwszych etapach wzrostu chabrów, jednak należałoby przeprowadzić dalsze badania mające na celu sprawdzenie wpływ takich wyciągów w późniejszych fazach rozwoju tej rośliny.
Wykorzystane w doświadczeniu metody pozwoliły uzyskać w naturalny sposób allelopatiny obu roślin i obserwować ich wpływ na odpowiednie akceptory. Jednak wyniki badań przepro wadzonych w warunkach naturalnych mogą się różnić. W dalszych doświadczeniach należy uwzględnić m.in. produkty wytwarzane przez mikroflorę ryzosfery (Oleszek, 1992).
Bibliografia
- Adamczewski K., Matysiak K. (2011). Klucz do określania faz rozwojowych roślin jedno- i dwuliściennych w skali BBCH. Poznań: Instytut Ochrony Roślin PIB.
- Ashrafi Z.Y. (2009). Inhibitive effects of barley (Hordeum vulgare) on germination and growth of seedling qu ack grass (Agropyrum repens). Icelandic Agricultural Sciences 22: 37-43
- Belz, R.G. (2007). W., Allelopathy Lewis J., in Fenwick crop/weed interactions – an update. Pest Management Science 63: 308-326.
- Biały Z., Oleszek W., Lewis J., Fenwick G. R. (1990). Allelopathic potential of glucosinolates (mustard oil glycosides) and their degradation products against wheat. Plant and Soil 129: 277–281.
- Boros D., Rek-Ciepły B., Cyran M. (1996). A note on the composition and nutritional value of hulless barley. J. Anim. Feed Sci. 5 (4): 417-424.
- Ciesielska A., Borkowska M. (2010). The effect of aqueous extracts of Ground seeds of Agrostemma githago on the germination of Winter wheat and barley. Journal of Research and Applications in Agricultural Engineering 55 (3): 40–43.
- Gąsiorowski H. (1997). Jęczmień. Chemia i Technologia. Poznań: PWRiL
- Gniazdowska A. (2007). Biotechnologia szansą dla zastosowania allelopatii jako alternatywnej metody zwalczania chwastów. Biotech. 2 (77): 42–53.
- Gniazdowska A., Oracz K., Bogatek R. (2004). Allelopatia – nowe interakcje oddziaływań pomiędzy roślinami. Kosmos – Problemy Nauk Biologicznych 53 (2): 207–217.
- GUS (2018). Użytkowanie gruntów i powierzchnia zasiewów w 2017 r. Warszawa.
- Gwiazdowska A. (2005). Oddziaływania allelopatyczne – ,,nowa broń” roślin inwazyjnych. Probl. Nauk Biol. Kosmos 54 (2-3): 221–226
- Hunia J. (2017). Wpływ eskudatów korzeniowych z sorga dwubarwnego (Sorghum bicolor (L.) Moench) na kiełkowanie i początkowy wzrost chabra bławatka (Centaurea cyanus L.). 46. Olimpiada Biologiczna
- Idziak R., Michalski T. (2003). Zachwaszczenie i plonowanie mieszanek jęczmienia jarego i owsa przy różnym udziale obu komponentów w zasiewie. Zesz. Probl. Post. Nauk Rol. 490: 99-104.
- Jaskulski D. (1999). Allelopatyczne oddziaływanie wodnych ekstraktów z nadziemnej masy chwastów na kiełkowanie jęczmienia jarego i pszenicy jarej. Zesz. Nauk Roln. 93: 7–15
- Khalid S., Ahmad T., Shad R. A. (2002). Use of allelopathy in Agriculture. Asian J. Plant Sci. 1 (3): 292–297.
- Klaaßen H., Freitag J. (2004). Profesjonalny Atlas Chwastów. BASF - The Chemical Company.
- Krochmal-Marczak B., Sawicka B., Betlej I. (2014). Zachwaszczenie łanów roślin zbożowych i możliwości jego ograniczenia w woj. podkarpackim. W: Zarzycka K., Kordacki S., Skrzyczyński J. (red.), Współczesne Dylematy Polskiego Rolnictwa. Biała Podlaska: PSW JPII; 353-367.
- Légère, A. and Stevenson, F.C. (2002). Residual effects of crop rotation and weed management on a wheat test crop and weeds. Weed Science 50: 101-111.
- Liu D.L., Lovett J.V. (1993). Biologically active secondary metabolites of barley II – Phytotoxicity of barley allelochemicals. J. Chem. Ecol. 19: 2231–2244.
- Machałek N. “Ilościowa i jakościowa zawartość chwastów zasiedlających pola uprawne obsiane zbożami na przykładzie rodzinnego gospodarstwa rolnego" referat wygłoszony w ramach VI konferencji PTA „Badania i innowacje w produkcji roślinnej” 17-19.09.2015 r.
- Majchrzak L. (2007). Kiełkowanie zbóż w warunkach sąsiedztwa ziarniaków Avena fatua L. i Festuca rubra L. – aspekt allelopatyczny. Ann. UMCS, Sec. E, 62 (2): 185–192.
- Marczewska-Kolasa K., Sekutowski T., Bortniak M. (2012). Wykrywanie potencjału allelopatycznego nasion Centaurea cyanus za pomocą biotestów. Progress in Plant Protection 52: 733-736
- Marczewska-Kolasa K., Bortniak M., Sekutowski T. R., Domaradzki K. (2017) Wpływ wodnych wyciągów z chabra bławatka na kiełkowanie oraz wzrost siewek zbóż. Journal of Research and Applications in Agricultural Engineering 62 (3): 208-211
- Ohno T., Doolan K.L. 2001. Effect of red clover decomposition on phytotoxicity to wild mustard seedling growth. Appl. Soil Ecol. 16:187–192.
- Oleszek W. (1992). Techniki badania allelopatii. Wiadomości Botaniczne 36 (3/4): 17-25
- Osińska A. (red.) (2004). Międzynarodowe przepisy oceny nasion. Radzików: Instytut Hodowli i Aklimatyzacji Roślin. Zakład Nasiennictwa i Nasionoznawstwa.
- Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 1 lutego 2007 r.w sprawie szczegółowych wymagań dotyczących wytwarzania i jakości materiału siewnego (Dz. U. z dnia 21 lutego 2007 r.)
- Rudnicki F.,Wasilewski P., Dębowski G. (1996).Tolerowane uprawy w monokulturze przez jare mieszanki zbożowe. Frag. Agron. 4: 75-84
- Tryjanowski P. „Wpływ zmian klimatu na ochronę roślin.” referat wygłoszony w ramach 56. Sesji Naukowej Instytutu Ochrony Roślin PIB, Poznań, 11-12 lutego 2016.
- Woźniak A. (2003). Wpływ przedplonu na aktualne i potencjalne zachwaszczenie pszenicy jarej. Zesz. Probl. Post. Nauk Rol. 490: 303-312.
- Wójcik-Wojtkowiak D., Politycka B., Weyman-Kaczmarkowa W. (1998). Allelopatia. Poznań: AR.
- Zaloguj się albo zarejestruj aby dodać komentarz
