Wpływ modyfikacji genetycznej na starzenie się owoców pomidora - praca badawcza z Olimpiady Biologicznej

Z przyjemnością przedstawiam kolejną, ciekawą pracę badawczą stworzoną przez uczestnika Olimpiady Biologicznej. Praca nie została oceniona przez komisję olimpiady, jednak stworzyłem własną recenzję, aby czytelnicy mieli pogląd jakich błędów unikać w pracach. Znajduje się ona w załącznikach do artykułu. Zapraszam do lektury :)
Zamieszczone na stronie prace służą jedynie zapoznaniu się z ogólnym charakterem prac badawczych zgłaszanych na Olimpiadę Biologiczną. Niedopuszczalne jest kopiowanie całej koncepcji wykonania pracy bądź fragmentów jej tekstu we własnej pracy. Tego typu działania będą uznawane za plagiat i mogą wiązać się z odrzuceniem pracy przez komisję olimpiady.
Wpływ enzymów pektolitycznych oraz wyciszenia genu poligalakturonazy na proces starzenia się owoców pomidora zwyczajnego.
AUTOR: Michał Kuryłek
Streszczenie
Badania prowadzone były od 01.11.2017 r. do 02.12.2017 r. na owocach pomidora zwyczajnego (Solanum lycopersicum L.) by ustalić wpływ egzogennych enzymów pektolitycznych (5 odmian endo- oraz 1 odmiany egzo-poligalakturonazy) oraz wpływ zahamowania ekspresji genu poligalakturonazy (PG) na tempo wizualnego starzenia się powyższego obiektu. W aspekcie organoleptycznym, starzeniu się owocu pomidora zwyczajnego towarzyszy powstawanie zmarszczeń na powierzchni jego skórki. Na podstawie procentu pola powierzchni skórki z powyższą zmianą badałem progres starzenia się w okresie 7 dni owoców: z zahamowaną biosyntezą poligalakturonazy, z naturalną jej obecnością (niezmodyfikowane genetycznie) oraz z dodanym do ich miękiszu roztworem enzymów pektolitycznych. Odnotowałem spowolnienie procesu wizualnego starzenia się owoców z wyciszonym genem PG oraz zwiększenie jego tempa po dodaniu roztworu egzogennych enzymów pektolitycznych do miękiszu owocu.
Wstęp
Poligalakturonaza to enzym pektolityczny (pektynolityczny) występujący w wielu odmianach i najintensywniej biosyntezowany jest w fazie dojrzewania owoców, kiedy katalizuje hydrolizę wiązań alfa-1,4-glikozydowych w kwasie poligalakturonowym (Dłużewski, 2008), będącym najważniejszym składowym węglowodanem pektyn, wchodzących w skład blaszki środkowej. Wraz z hormonami roślinnymi (głównie etylenem) enzymy pektolityczne stymulują dojrzewanie owoców pomidora. Wyciszenie genu PG w pomidorze zwyczajnym zostało osiągnięte po raz pierwszy przez firmę Calgen® (1994r). Uzyskuje się to przez wprowadzenie do jego materiału genetycznego antysensownego cDNA, którego transkrypt, wraz z mRNA genu PG, tworzył dsRNA, co ograniczało translację nawet o 90% (Sheehy, 1988). Powyższa modyfikacja miała na celu spowolnienie procesu dojrzewania, by, m.in. ułatwić utrzymanie odpowiedniej świeżości owoców podczas transportu do sklepów. W literaturze naukowej natrafiłem na badanie potwierdzające stymulujący wpływ poligalakturonazy na tempo dojrzewania owoców pomidora zwyczajnego (Giovannoni, 1989). Dotyczyło ono głównie wczesnych stadiów dojrzewania, tj. etapu gromadzeniu się likopenu (czerwonego barwnika pomidora). Dlatego zaciekawiło mnie znaczenie enzymów pektolitycznych w późniejszym już, etapie tego procesu, a mianowicie w wizualnym starzeniu się owoców. Za cel pracy obrałem zbadanie, jak zahamowanie ekspresji genu PG oraz wstrzyknięcie egzogennych enzymów pektolitycznych wpływa na proces starzenia się owoców pomidora zwyczajnego. Podczas wstępnych obserwacji zauważyłem pojawianie się z czasem zmarszczeń na skórce owocu pomidora. Wysnułem następującą hipotezę: w tym samym okresie czasu owoc pomidora zwyczajnego z wyciszonym genem poligalakturonazy (trans) ulegnie mniej intensywnemu zestarzeniu wizualnemu (będzie posiadał mniejszy procent [%] zmarszczonej powierzchni skórki w danym dniu) niż owoc tego samego gatunku, lecz niezmodyfikowany pod względem aktywności ekspresji genu PG (BIO). Natomiast dodanie roztworu enzymów pektolitycznych do miękiszu owoców (za pomocą iniekcji) spowoduje zwiększenie tempa procesu ich starzenia (zwiększanie procentu [%] powierzchni zmarszczonej skórki w danym dniu).Wynik doświadczenia potwierdzający hipotezę stanowiłby również argument za rozpowszechnianiem powyższej modyfikacji genetycznej w owocu pomidora na rynku spożywczym. Pozostałe modyfikacje informacji genetycznej obecne u roślin trans pomidora zwyczajnego zapewniały, m.in. odporność na herbicydy i szkodniki, co miało wpływ na plenność roślin i, pośrednio, na wielkość owoców. Dlatego też wybrałem owoce trans i BIO o zbliżonej masie, twardości i wielkości, dzięki czemu powyższe modyfikacje nie miały wpływu na wynik doświadczenia.
Materiał i metody
Badanie przeprowadzane było w warunkach domowych w okresie od 01.11.2017 r. do 02.12.2017 r. w stałej temperaturze 20°C, wilgotności powietrza 44% (zmierzonej higrometrem TERDENS) oraz na świetle dziennym, które równomiernie oświetlało owoce. Zmiany powyższych parametrów zostały ograniczone przez umieszczenie obiektów badań w zamkniętym pokoju na gazach opatrunkowych. Owoc pomidora zwyczajnego (Solanum lycopersicum L.) jest jagodą o mięsistej, niepękającej owocni, składającą się głównie z łożyska; do badania wybrałem go z dwóch powodów:
- Owoce te, zarówno z wyciszonym genem PG jak i niezmodyfikowane genetycznie, są dostępne na rynku spożywczym (informację o obecnej modyfikacji uzyskałem w internetowym biurze obsługi klienta);
- Są wdzięcznym obiektem badań, ze względu na ich relatywnie szybki i zauważalny rozkład dzięki miękkiej skórzastej skórce marszczącej się wraz z upływem czasu.
Owoce pomidora zwyczajnego z certyfikatem BIO (zatem z niezahamowaną ekspresją genu PG) zakupiłem w sklepie Organic w Józefosławiu, natomiast owoce z wyciszonym genem PG w supermarkecie w Piasecznie (importowane z Turcji). Wszystkie owoce były okrągłej czerwonej odmiany średnio-owocowej. Roztwór (60%; d=1,4g/cm3) enzymów pektolitycznych w glicerolu, którego używałem, zakupiłem pod nazwą Pektoenzym®. W jego skład wchodzi 5 odmian endo- oraz 1 odmiana egzo-poligalakturonazy. Został wyodrębniony z kropidlaka czarnego (Aspergillus niger Tiegh). Roztwory z 10 zakupionych probówek enzymu zostały przelane do jednej kolby stożkowej, by zapobiec możliwemu zaburzeniu wyniku, spowodowanym wadliwą serią jednego z produktów.
Badanie przeprowadziłem w czterech następujących po sobie powtórzeniach, a jego schemat przedstawiony został na ryc. 1. Przy każdym powtórzeniu zakupiłem porcję 8 kg pomidorów (4 kg BIO oraz 4 kg trans; cała porcja kupiona jednego dnia), a więc łącznie zakupiłem około 32 kg (192 sztuki). Podczas selekcji w sklepie wybierałem owoce o podobnym stanie dojrzenia oraz wielkości. Następnie spośród 8kg wybrałem 7 kg tych obiektów, które nie wykazywały śladów obicia, mogących zaburzyć wyniki doświadczenia. Zatem do jednego powtórzenia wykorzystałem owoce o łącznej masie 7 kg (około 500 g/grupa, 3 owoce/grupa; grupą nazywam pakiet owoców w powtórzeniu o identycznym parametrze zmiennych niezależnych).
W celu zbadania wpływu wyciszenia genu PG, przygotowałem próbę badawczą (I) złożoną z owoców pomidora z wyciszonym genem PG o łącznej masie około 500 g (3 sztuki), których postęp procesu starzenia porównywałem z próbą kontrolną złożoną z owoców pomidora BIO (3 sztuki), z czego żadna z wymienionych prób nie została poddana ingerencji mechanicznej.
Aby zbadać wpływ egzogennych enzymów pektolitycznych na starzenie się owoców pomidora zwyczajnego przygotowałem 6 grup próby badawczej: trzy złożone z owoców z wyciszonym genem PG (IIa-badawcza) oraz 3 z owocami BIO (IIb-badawcza). Do miękiszu owoców każdej z grup przez punkt w pobliżu ogonka wstrzykiwałem pod kątem 90° strzykawką z igłą o średnicy 0,8 mm na głębokości 2 cm, mieszaninę Pektoenzymu oraz wody destylowanej. Roztwór posiadał jednakową objętość po 2 ml na owoc w każdej z grup, a zmieniany był stosunek objętościowy Pektoenzymu do wody, z czego każdemu stosunkowi odpowiadała 1 grupa owoców trans oraz 1 grupa owoców BIO. Na podstawie wiedzy o gęstości, objętości i masie Pektoenzymu oraz zawartości w nim enzymów, policzyłem stężenie procentowe otrzymanych mieszanin. Zatem, badany był wpływ trzech roztworów o stężeniu procentowym enzymów pektolitycznych równym kolejno 44% (VPektoenz:VH2O = 2:1), 35% (VPektoenz:VH2O = 1:1) oraz 16% (VPektoenz:VH2O = 1:4). Roztwory przygotowywane były przez zmieszanie Pektoenzymu oraz wody w odpowiednim stosunku objętościowym (informacja w nawiasach powyżej) w cylindrze miarowym o pojemności 10 ml.
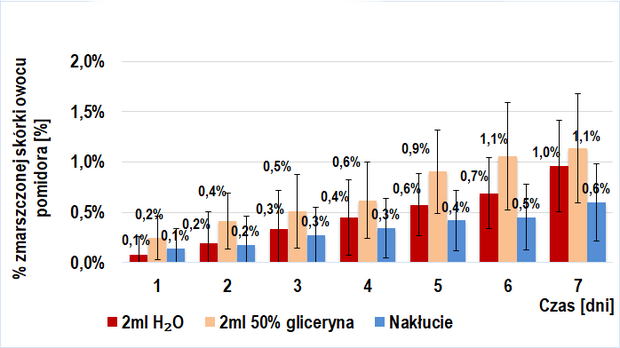
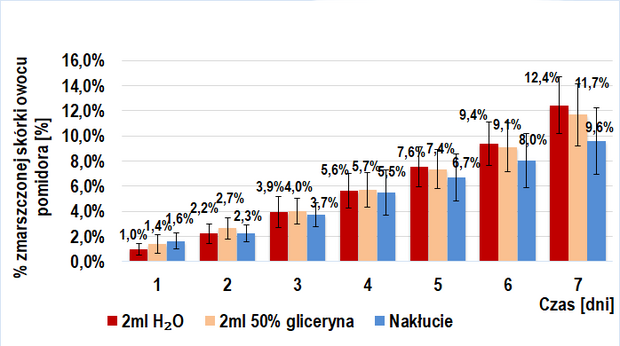
Próbę kontrolną także stanowiło 6 grup: 3 złożone z owoców trans (IIa-kontrolna) i 3 z owoców BIO (IIb-kontrolna). W skład każdej z trzech grup wchodziła jedna ze wstrzykniętymi 2 ml(/owoc) 50%-ego roztworu glicerolu w wodzie destylowanej, druga ze wstrzykniętymi 2ml(/owoc) wody destylowanej oraz trzecia, w której dokonywano jedynie nakłucia igłą strzykawki (przerwanie ciągłości skórki owocu).
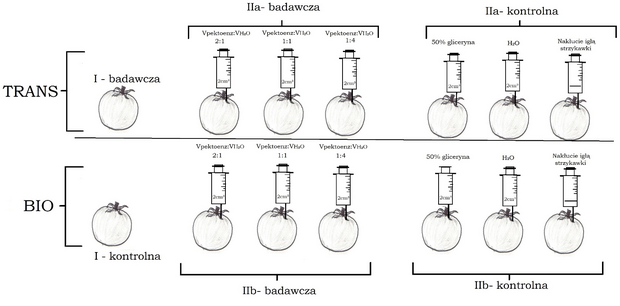
Ponadto, wyżej wymienione próby kontrolne zostały porównane z grupami pierwszej części doświadczenia (IIa-kontrolna z I-badawczą; IIb-kontrolna z I-kontrolną) w celu ustalenia wpływu przerwania ciągłości skórki owoców.
Pomiarów dokonywałem każdego dnia trwania doświadczenia o godzinie 20:00. Procent zmian w postaci zmarszczeń na skórce owoców oceniałem zgodnie ze wzorem
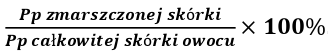
Pole powierzchni zmarszczonej skórki mierzyłem naklejając na skórkę ze zmarszczeniami fragmenty odmierzonej taśmy, znając ich pole powierzchni z dokładnością do 0,1 cm; przed dobraniem tej metody doświadczalnie sprawdziłem wpływ warstewki kleju firmy AMOS na tempo procesu wizualnego starzenia się badanych owoców i nie stwierdziłem znaczącej zmiany. Pole powierzchni całkowitej skórki obliczałem po zakończeniu doświadczenia z użyciem programu On 2D CamMeasure, co znacznie uprecyzyjniło otrzymany wynik. Aplikacja ta, po odpowiednim skalibrowaniu, wylicza pole wskazanej płaszczyzny (Zdj.2.; instrukcja obsługi w aplikacji: menu/manual).
Aby poprawnie zastosować powyższą metodę, każdy owoc preparowałem (Zdj.1.), uzyskując poziomo leżącą skórkę z wyrównanymi zmarszczeniami (redukcja zmarszczeń jest możliwa dzięki wycięciu warstwy miękiszu leżącej bezpośrednio pod skórką). Pozwoliło to programowi policzyć powierzchnię skórki, równej tej przed rozpoczęciem doświadczenia. Po skalibrowaniu programu liczyłem Pp całkowitej skórki każdego owocu osobno (dokładność do drugiego miejsca po przecinku).


Doświadczenie w obrębie powtórzenia miało zostać zakończone w dniu pojawienia się nalotu pleśni na jednym z owoców. W ciągu czterech wykonanych powtórzeń, pleśń pojawiła się najwcześniej 7 dnia doświadczenia na owocu z próby IIb-badawczej; w pracy przedstawiłem wyniki tylko do tego momentu.
Wyniki doświadczenia zapisywałem w cyfrowym zeszycie laboratoryjnym. Otrzymane wartości uśredniłem (średnie wyniki u owoców odpowiadających sobie grup – 12 sztuk; dla każdego dnia osobno), policzyłem odchylenie standardowe (także uśrednione) i przygotowałem wykresy przy użyciu programu Microsoft Office Excel 2013.
Wyniki
Różnice między próbami odnotowano już pierwszego dnia. Zaobserwowano zależność zwiększania się w czasie powierzchni zmarszczonej u wszystkich owoców, lecz w różnym tempie w zależności od przynależnej grupy. Otrzymane uśrednione wyniki zostały przedstawione poniżej, a słupki błędów na wykresach ilustrują uśrednione odchylenia standardowe.
Obecność wyciszenia poligalakturonazy
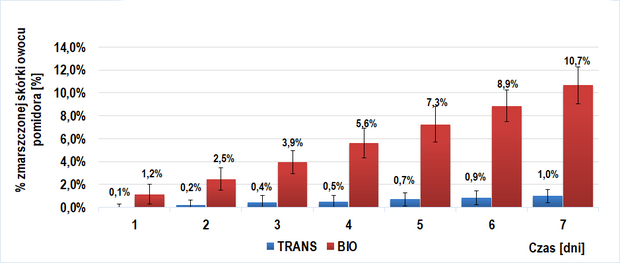
Wyniki u próby I badawczej (owoce trans- wyciszony gen PG) oraz I kontrolnej (owoce BIO- niewyciszony gen PG) ukazane zostały na wykresie 1. Ich porównanie wskazuje na znaczne spowolnienie procesu starzenia się skórki owoców trans w porównaniu z BIO. Różnica w procencie zmarszczonej skórki między powyższymi grupami (|%d[dzień]bio - %dtrans|) rosła w kolejnych dniach doświadczenia (przy czym większe zmarszczenia wykazywały owoce BIO) i maksimum równe 9,7 [%] osiągnęła dla 7 dnia doświadczenia.
Obecność egzogennych enzymów pektolitycznych
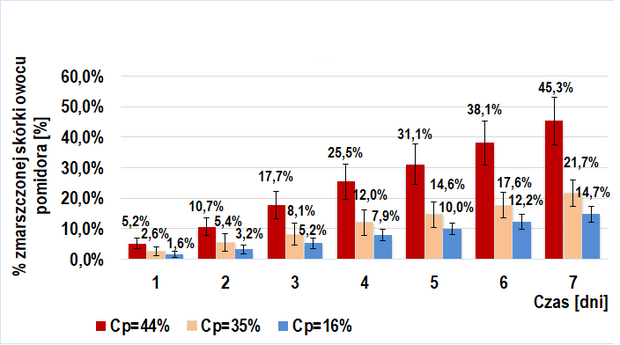
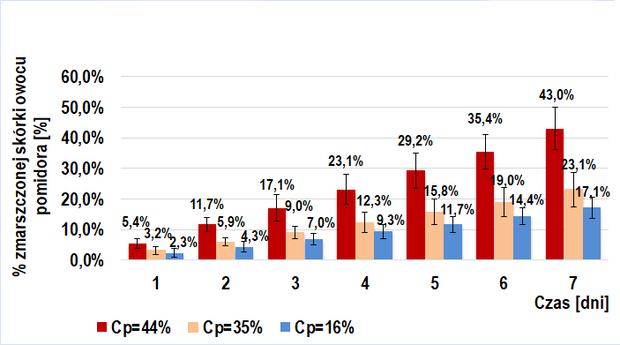
Dodanie roztworu egzogennych enzymów pektolitycznych (6 odmian poligalakturonaz kropidlaka czarnego) do miękiszu owocu pomidorów TRANS (Wykres 2.) i BIO (Wykres 4.) ma istotne znaczenie w ich wizualnym starzeniu się. Widoczna jest tendencja rosnąca w tempie tego procesu przy wzroście stężenia procentowego wstrzykniętego roztworu enzymów pektolitycznych. W danym dniu, w każdej z grup próby badawczej odnotowywałem większy średni procent powierzchni zmarszczonej skórki niż dla prób kontrolnych. Interesujący jest fakt, iż przy tym samym stężeniu procentowym wprowadzonego roztworu, tempo procesu starzenia było zbliżone u owoców BIO (IIb-badawcza) i trans (IIa-badawcza).

Dyskusja
Porównanie tempa wizualnego starzenia się owoców trans i BIO (próba I badawcza i kontrolna) sugeruje obecność czynnika stymulującego ten proces w owocach BIO pomidora zwyczajnego, a jego nieobecność w owocach trans. Dodanie do miękiszu owocu 2ml jakiejkolwiek cieczy nie pozostaje bez wpływu na jego wizualne starzenie się, jednakże wstrzyknięcie roztworu enzymów pektolitycznych skutkowało najwyższą intensywnością tego procesu.
Stanowi to potwierdzenie stymulującego wpływu enzymów pektolitycznych na starzenie się owoców pomidora. W literaturze naukowej natrafiłem na stwierdzenie (Al-Hindi, 2011), iż poligalakturonazy kropidlaka czarnego stymulują psucie się jabłek – uważam, że jest to logicznie spójne z moimi wynikami. Zwiększenie rozkładu pektyn blaszki środkowej między komórkami owocu powoduje w następstwie rozpad tkanki (maceracja). Zjawisko to, odbywające się także w miękiszu zlokalizowanym bezpośrednio pod skórką, ma bezpośredni wpływ na marszczenie się powierzchni owocu pomidora zwyczajnego. Wcześniejsze badania (Smith i Watson, 1989) wykazały brak wpływu wyciszenia genu PG na biosyntezę etylenu, hormonu roślinnego odpowiedzialnego za dojrzewanie owoców. Ma to istotne znaczenie, gdyż wyklucza potencjalne zaburzenie wyników, spowodowane zwiększeniem stężenia etylenu.
Wyniki doświaczenia zgodne są z oczekiwanymi i potwierdzają hipotezę. Są one również logicznie spójne z wcześniejszym badaniem nad działaniem poligalakturonazy w procesie dojrzewania owocu pomidora zwyczajnego (Giovannoni, 1989), które potwierdza jej stymulujący wpływ na ten proces na etapie gromadzenia likopenu.
Zatem zahamowanie ekspresji genu poligalakuronazy skutkuje wydłużeniem nie tylko procesu wczesnego dojrzewania owoców, kiedy twardy perykarp mięknie, a w egzokarpie gromadzi się likopen. Moje wyniki dowodzą, iż dzięki tej modyfikacji genetycznej także na późniejszym etapie dojrzewania, owoc dłużej zachowuje wizualną świeżość. Ma to znaczenie dla potencjalnego klienta, który, znając trwałość owoców, będzie skłonny kupować je w większej ilości.
Wraz ze wzrostem stężenia enzymu wzrasta szybkość katalizowanej reakcji. Nie jest zatem zaskakujące, iż zwiększenie stężenia procentowego dodanego roztworu enzymów pektolitycznych skutkuje intensyfikacją rozkładu pektyn blaszki środkowej. Skutkiem tego jest wzrost tempa maceracji i, tym samym, procesu wizualnego starzenia.
Enzymy pektolityczne wytwarzane są zarówno przez pomidora zwyczajnego, jak i niektóre gatunki grzybów. Kropidlak czarny biosyntezuje aż 6 odmian poligalakturonazy (Kester, 1990). Jest to uzasadnione jego saprotroficznym sposobem odżywiania, gdyż rozkład tkanek roślinnych ułatwia mu dostęp do pożywienia.
Proces starzenia przebiegał w podobnym tempie u owoców TRANS i BIO po dodaniu do ich miękiszu roztworu enzymów pektolitycznych o równym stężeniu procentowym. Prawdopodobnym uzasadnieniem zbliżonych wyników (IIa-badawcza oraz IIb-badawcza) jest wstrzyknięcie znacznie większej ilości cząsteczek enzymów pektolitycznych niż naturalnie występuje w owocu. Sprawia to, że w wynikach ledwo zauważalny jest efekt działania enzymów pomidora.
Wartości % powierzchni zmarszczonej skórki rosną regularnie we wszystkich grupach i intensywność tego procesu nie maleje w kolejnych dniach badania. Jest to spowodowane faktem, iż w ciągu 7 dni owoce nie zostawały w pełni pokryte zmarszczeniami. Podczas doświadczenia zaobserwowałem znaczne zmięknięcie owoców z dodanym roztworem enzymów pektolitycznych w porównaniu z próbami kontrolnymi, lecz ze względu na brak teksturometru nie dokonywałem pomiarów w tym aspekcie. Przeglądając inne prace, natrafiłem na stwierdzenie, iż PG nie wpływa na mięknięcie owocu (Giovannoni, 1989), jak i na pracę potwierdzającą jej stymulujący wpływ (Sheehy, 1988). Uważam, że pożądane byłoby ujednolicenie wiedzy na temat tego enzymu pektolitycznego, istotnego zarówno w nauce, jak i przemyśle.
Jedną z gałęzi gospodarki, intensywnie rozwijaną w Unii Europejskiej, jest sektor ochrony środowiska. Alternatywę do nieodnawialnych źródeł energii stanowi spalanie biogazu, naturalnie powstającego, m.in. w wyniku fermentacji metanowej fitomasy. Obecne na rynku roztwory enzymów pektolitycznych wykorzystywane są głównie w przemyśle spożywczym (winiarstwo, produkcja soków owocowych). Wiedza o intensyfikacji procesu rozkładu pektyn pod wpływem działania tych biopreparatów nasuwa możliwy korzystny efekt ich wykorzystania w fermentacji metanowej fitomasy, gdzie pektyny stanowią jeden z polisacharydowych substratów. Choć temat ten wymaga dalszych badań, istnieje szansa maksymalizacji i optymalizacji powyższego procesu.
Ze względu na korzystne konsumencko skutki wyciszenia genu poligalakturonazy u pomidora zwyczajnego sugeruję kontynuację badań nad wpływem powyższej modyfikacji genetycznej na wizualne starzenie się owoców roślin innych gatunków.
Piśmiennictwo
- Rashad R. Al-Hindi (2011). Isolation and identification of some fruit spoilage fungi: Screening of plant cell wall degrading enzymes
- Mieczysław Dłużewski (2008). Technologia żywności 2. WSiP; 230
- J. J. Giovannoni (1989). Expression of a chimeric polygalacturonase gene in transgenic rin (ripening inhibitor) tomato fruit results in polyuronide degradation but not fruit softening.
- HC Kester, J. Visser, 1990, Purification and characterization of polygalacturonases produced by the hyphal fungus Aspergillus niger
- R.Pressey, J.K.Avants, Two forms of polygalacturonase in tomatoes, 1973.
- Raymond E. Sheehy, Reduction of polygalacturonase activity in tomato fruit by antisense RNA, 1989
- Christopher J. S. Smith, Colin F. Watson (1989). Inheritance and effect on ripening of antisense polygalacturonase genes in transgenic tomatoes
- Gregory A. Tucker (1981). Synthesis of polygalacturonase during tomato fruit ripening
- Zaloguj się albo zarejestruj aby dodać komentarz
