Wpływ miodu rzepakowego na rozwój bakterii - praca badawcza

Niniejszym przedstawiam pracę badawczą przygotowaną pod kątem Olimpiady Biologicznej, jednak nie wysłanej ze względu na zmianę regulaminu. Aktualnie nie jest dopuszczalne korzystanie z pomocy placówek naukowych poza szkolną pracownią. Praca mimo wszystko wydaje mi się ciekawa, pokazująca naukowe podejście do dość popularnego w obiegowej opinii twierdzenia o bakteriobójczych właściwości miodu. Z tego też względu, pomimo iż praca nie jest aktualnie zgodna z regulaminem olimpiady, postanowiłem ją opublikować na łamach strony.
Zamieszczone na stronie prace służą jedynie zapoznaniu się z ogólnym charakterem prac badawczych zgłaszanych na Olimpiadę Biologiczną. Niedopuszczalne jest kopiowanie całej koncepcji wykonania pracy bądź fragmentów jej tekstu we własnej pracy. Tego typu działania będą uznawane za plagiat i mogą wiązać się z odrzuceniem pracy przez komisję olimpiady.
Wpływ miodu rzepakowego na rozwój bakterii Escherichia coli.
AUTOR: Bartosz Lautenbach
Streszczenie
W pracy przedstawiono wpływ miodu rzepakowego na wzrost szczepu Escherichia coli MG16551 na podłożach stałych i płynnych, jak również wpływ miodu na długość komórek bakteryjnych i zmianę pH pożywki pod wpływem różnego stężenia miodu. Stwierdzono, że miód w wysokich stężeniach ma odczyn kwasowy oraz właściwości bakteriobójcze.
Wstęp
Miód od wieków był ceniony za swoje prozdrowotne działanie. Znalazł zastosowanie już w starożytności. Ojciec medycyny Hipokrates i jego uczniowie opracowali ponad 300 przepisów na stosowanie miodu jako lekarstwa. Wiedziano już wtedy, że miód obniża gorączkę i rozrzedza krew. Miód, jako najstarszy słodzik, zawiera szeroką gamę mikroelementów: potas, chlor, fosfor, magnez, wapno, żelazo, molibden, mangan i kobalt oraz witamin: A, B1, B2, B6, B12, C, kwas foliowy, pantotenowy i biotynę 1, 2. Najaktywniejsze biologicznie są miody gryczane, co nie oznacza, że inne, takie jak: miód akacjowy czy rzepakowy, nie wykazują działania antybakteryjnego.
Jedną z cennych właściwości miodu jest działanie na bakterie chorobotwórcze. Przykładem są bakterie Gram-dodatnie, takie jak gronkowce (Staphylococcus aureus) i paciorkowce (Streptococcus pyogenes, Streptococcus pneumoniae, Streptococcus mutans). Poza tym miód wpływa hamująco na wzrost laseczek wąglika (Bacillus anthracis) i prątków gruźlicy (Mycobacterium tuberculosis) 3.
W dzisiejszych czasach w dobie zmniejszającej się skuteczności klasycznych antybiotyków naukowcy coraz częściej pracują nad naturalnymi metodami leczenia. Miód, towarzyszący człowiekowi od wieków, wydaje się więc bardzo obiecującym sposobem radzenia sobie z infekcjami.
Jedną z substancji chemicznych odpowiedzialnych za antybiotyczne działanie miodu jest nadtlenek wodoru. Obecność nadtlenku wodoru w miodzie jest wynikiem aktywności oksydazy glukozowej, enzymu powodującego utlenianie glukozy do kwasu glukonowego. Kolejnym czynnikiem wpływającym na wysoką aktywność antybiotyczną miodu jest enzym lizozym, powodujący rozkład ścian komórkowych bakterii Gram-dodatnich 3.
Do innych substancji antybiotycznych wytwarzanych przez pszczoły i wprowadzanych przez nie do miodu należą inhibina i apidycyna, które podobnie jak lizozym działają np. na ziarniaki Gram-dodatnie, takie jak gronkowce i paciorkowce oraz pałeczki Gram-ujemne. Najliczniejszą grupę związków w miodzie stanowią węglowodany. W największej ilości występują monosacharydy, takie jak glukoza (~34%) oraz fruktoza (~39%). Istnieją doniesienia, że wysokie stężenie cukrów w miodzie przyczynia się także do jego właściwości bakteriobójczych na drodze efektów osmotycznych 4.
W miodzie występuje duża ilość kwasu ze względu na procesy enzymatyczne, które towarzyszą powstawaniu miodu. Niskie pH miodu również wpływa bakteriobójczo, a co więcej wraz z dojrzewaniem miodu ilość kwasów wzrasta.
Cel pracy:
Celem pracy było zbadanie bakteriobójczych albo bakteriostatycznych właściwości miodu rzepakowego na wzrost szczepu pałeczki okrężnicy w pożywce płynnej i stałej. Kolejnym celem było zbadanie wpływu różnego stężenia miodu na morfologię komórek bakteryjnych z wykorzystaniem mikroskopii fluorescencyjnej oraz sprawdzenie, czy różne stężenie miodu w pożywce wpływa na jej pH.
Materiały i Metody
Szczep bakteryjny:
Aktywność bakteriobójczą miodu rzepakowego badano na bakterii E. coli MG1655. Gatunek ten wchodzi w skład fizjologicznej flory bakteryjnej jelita grubego człowieka oraz zwierząt stałocieplnych. W jelicie bakteria spełnia wiele pożytecznych ról, m.in. uczestniczy w rozkładzie pokarmu, przyczynia się do produkcji witamin z grupy B i K. Znane są szczepy E. coli charakteryzujące się występowaniem różnych czynników zjadliwości ulokowanych na plazmidach, różnych typów fimbrii mogących umożliwiać patogenną adhezję do komórek gospodarza oraz zdolnością do syntezy toksyn. Badany szczep pochodzący z Katedry Mikrobiologii Uniwersytetu Gdańskiego jest niezjadliwy i niepatogenny.
| Królestwo | Bakterie |
| Typ | Proteobakterie |
| Gromada | Gammaproteobakterie |
| Rząd | Enterobacteriales |
| Rodzina | Enterobacteriaceae |
| Rodzaj | Escherichia |
| Gatunek | Escherichia coli |
Tab.1 Systematyka badanego organizmu [4]
Miód:
W doświadczeniach wykorzystano miód rzepakowy firmy „Vis Vitalis”3. Do doświadczenia miód został rozcieńczony do stężenia 60%. Stężenie w stosunku wagowo-wagowym zostało uzyskane poprzez naważenie odpowiedniej ilości miodu rzepakowego (30 g miodu uzupełnionego wodą destylowaną do uzyskania 50 g roztworu). Po dodaniu wody destylowanej roztwór poddano mieszaniu z wykorzystaniem mieszadła magnetycznego w celu uzyskania roztworu jednorodnego. Aby uzyskać jałowy roztwór4 poddano go filtracji mechanicznej przy użyciu filtra o porach wielkości 0,20 μl.
PRZEBIEG BADAŃ
Doświadczenia wykonano w laboratorium Wydziału Biologii UG, do którego uzyskano dostęp dzięki uprzejmości pracowników naukowych tego Wydziału. Prace prowadzone były w dniach 12-18 lipca 2016 r. Rozpoczęły się od posiewu redukcyjnego komórek bakterii na szalkach z pożywką LA5 (Sigma) składającą się z: 10 g Tryptonu, 5 g Ekstraktu drożdżowego, 0,5 g sodu, 10 g agaru; (porcje na 1000 ml pożywki), które następnie poddano inkubacji w temperaturze 37°C2.
Pomiar gęstości optycznej hodowli:
Próbkę hodowli przeniesiono do kolby o objętości 50 ml z pożywką LB6 (Sigma) składającą się z: 10 g tryptonu, 5 g ekstraktu drożdżowego, 0,5 g sodu (porcje na 1000 ml pożywki) i odmłodzono 1: 50 w świeżym bulionie odżywczym LB. Hodowlę prowadzono w temperaturze 37°C w łaźni wodnej z wytrząsaniem 169 RPM7 do osiągnięcia OD600 = 0,3 (OD600 – ang. Optical Density, λ = 600 nm), aby bakterie były w fazie wzrostu wykładniczego. Po uzyskaniu OD600 = 0,3 hodowle rozlano do kolb (o objętości 50 ml) po 15 ml i dodano przefiltrowanego roztworu miodu w ilości takiej, aby w każdej kolbie znajdowało się odpowiednie stężenie miodu: 0% (kontrola), 1%, 5%, 10%, 20%, 30%. Hodowle z roztworem miodu w odpowiednich stężeniach umieszczono w inkubatorze z wytrząsaniem w temperaturze 37°C na 2 godziny i co 20 minut8 pobierano próbę w celu zmierzenia wartości OD600. Uzyskane wyniki umieszczono na wykresie liniowym przedstawiającym zależności OD600 od czasu.
Pomiar pH za pomocą papierków lakmusowych:
Zmierzono pH pożywek suplementowanych z miodem rzepakowym we wszystkich stężeniach, o których wspomniano. Skalę pH zmierzono papierkami lakmusowymi (Sigma).
Pomiary wzrostu bakterii na pożywce stałej:
Kolbę z pożywką stałą LA rozpuszczono i następnie schłodzono do temperatury ok. 37°C. Zaszczepiono hodowle bakterii w pożywce i prowadzono ją w łaźni z wytrząsaniem (V = 169 RPM) do uzyskania OD600 = 0,3. Wykonano seryjne rozcieńczenia w celu dokładnego określenia ilości bakterii w wyjściowej zawiesinie i przygotowaniu materiału do wysiania na płytkach. Z kolby zawierającą hodowlę o gęstości OD600 = 0,3 pobrano 10 μl materiału i przeniesiono do kolejnej probówki typu eppendorf zawierającą 90 μl świeżego bulionu odżywczego. Czynność powtórzono trzy razy tak aby roztwór był rozcieńczony 1000 krotnie. Za każdym razem materiał pobierano z poprzedniej probówki typu eppendorf, dzięki czemu gęstość hodowli była coraz niższa. Na wcześniej przygotowanych płytkach Petriego z pożywką LA suplementowanych miodem w odpowiednim stężeniu (kontrola 0%, 10% i 30%) wysiano rozcieńczoną hodowlę za pomocą głaszczki szklanej w trzech powtórzeniach. Płytki inkubowano w temp. 37°C w inkubatorze przez dobę. Po tym czasie policzono ilość bakterii na mililitr pożywki na płytkach (CFU - Colony Forming Unit).
Wszystkie wyniki zostały zebrane i opracowanie w programie Microsoft Excel 2010.
Wyniki
Wpływ miodu na bakterie badany był różnymi sposobami, np.: analizując wzrost hodowli w pożywce płynnej, liczbę kolonii bakteryjnych na pożywce stałej oraz morfologiczną cechę komórek, jaką jest ich długość. Wyniki badań absorbancji, CFU oraz długości komórek bakteryjnych są średnią z wykonanych trzech powtórzeń doświadczenia.
Pomiar wzrostu bakterii mierzony był w czasie dwóch godzin hodowli w pożywce płynnej z dodatkiem określonych stężeń miodu. Wzrost bakterii w niskich stężeniach miodu (0%, 1%, 5%) był porównywalny z tym obserwowanym bez dodatku miodu. Podwyższenie stężenia miodu do 20% i 30% powodowało znaczne zahamowanie wzrostu bakterii, a już 10% stężenie miodu w pożywce powodowało zauważalne spowolnienie wzrostu. Hodowle prowadzone w niskich stężeniach miodu wykazywały tendencję wzrostową, z tym, że wzrost stężenia miodu powodował jednocześnie spadek wzrostu bakterii. Hodowle prowadzone w 30% roztworze sacharozy i glukozy wykazywały zahamowanie wzrostu.
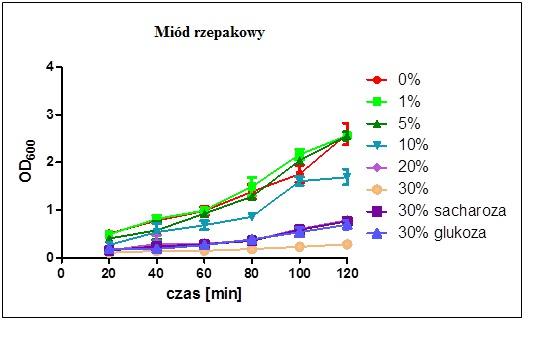
Wnioskować można z tego, iż wzrost stężenia miodu oraz wysokie stężenie cukrów w roztworze powoduje spadek wzrostu bakterii.
Ważne wnioski wyciągnąć można z wyników doświadczenia badania wzrostu bakterii na pożywce stałej w obecności różnych stężeń miodu. Podczas porównywania wykresu można zauważyć nieistotny statystycznie spadek liczby kolonii bakteryjnych pomiędzy stężeniami 0% a 10%. Najbardziej interesujący i zarazem najbardziej widoczny jest spadek liczby kolonii pomiędzy stężeniami 0% a 30%. Wyższy poziom stężenia miodu w pożywce wykazuje działanie hamujące wzrost bakterii.
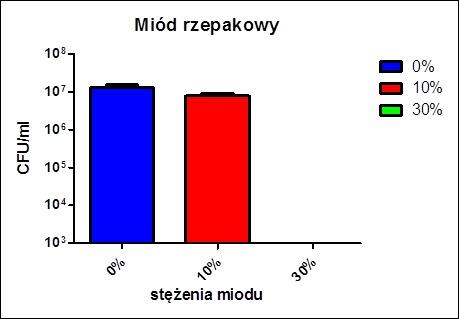
Jak widać na powyższym wykresie liczba kolonii bakterii w stężeniu 0% jak i w stężeniu 10% była wysoka. Różnica w liczbie kolonii bakterii nie była duża i była nieistotna statystycznie. Różnica między stężeniem 0% a 30% była wyraźna i istotna statystycznie. Ilość kolonii bakterii przy stężeniu 30% była równa zeru.
Na podstawie powyższego wykresu wnioskować można, iż wraz ze wzrostem stężenia miodu w roztworze liczba kolonii bakterii w roztworze maleje.
Zbadano wpływ stężenia miodu na długość bakterii. Jak widać na poniższym wykresie stężenie miodu wpływa na długość komórek bakterii. Długość komórek bakterii w stężeniach pokazanych na wykresie różni się miedzy sobą i jest równa około 2-3 μM. Jest to typowa długość komórki bakterii E. coli.
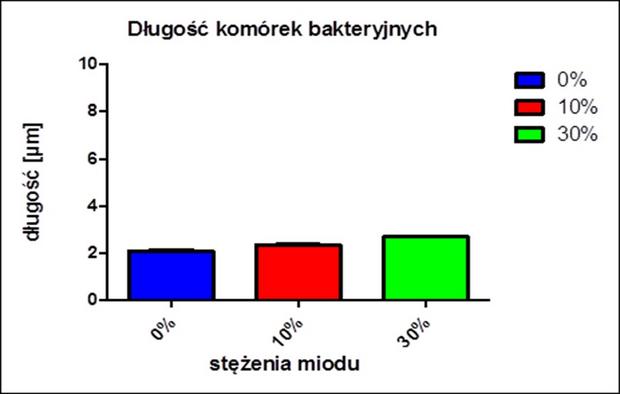
Jak widać na powyższym wykresie długość komórek bakteryjnych wykazuje słaby wzrost wraz z rosnącym stężeniem miodu. Komórki bakteryjne poddane stresowi wywołanemu przez miód w stężeniu 10% i 30% są o kilka mikrometrów dłuższe od bakterii nie poddanych stresowi. Jednak zmiany w długości komórek nie są duże i nie są istotne statystycznie.
Niniejszy wykres może uświadomić i nasunąć wniosek, iż komórki bakteryjne zmieniają swoją morfologię w odpowiedzi na działanie stresora jakim w owym doświadczeniu jest miód. [Jeżeli zmiany nie są istotne statystycznie, jak wyżej zasugerowano, wniosek ten byłby nieuprawniony. Należałoby określić istotność statystyczną za pomocą odpowiedniego testu statystycznego dla otrzymanych wyników - przyp. red.].
Za antybakteryjne działanie miodu mogą być odpowiedzialne zmiany odczynu pożywki. Zbadano więc pH miodu w pożywce w różnych stężeniach papierkami lakmusowymi. Wyniki badania są następujące: pH roztworu 30% wynosi 6,0; pH roztworu 20% wynosi 6,0; pH roztworu 10% wynosi 6,0; roztworu 5% równe 7,0 i roztworu 1% także równe 7,0; pH pożywki LB wynosi 7,0.

Na podstawie powyższego doświadczenia można wnioskować, że miód w wysokich stężeniach ma odczyn kwaśny zaś w niskich stężeniach nie zmienia obojętnego odczynu pożywki.
Dyskusja
Z przeprowadzonych badań wynika, że miód rzepakowy działa bakteriobójczo. Za bakteriobójcze właściwości miodu odpowiedzialny jest nadtlenek wodoru, który jest wypadkową działań dwóch enzymów: oksydazy, utleniającej glukozę do kwasu glukonowego, oraz katalazy, rozkładającej ten związek [6]. Dzięki niezwykle silnym właściwościom utleniającym nadtlenku wodoru zabijane są rozmaite bakterie [1], [6]. Analizując wzrost bakterii w hodowli płynnej i na podłożu stałym wyraźnie widać spadek wzrostu bakterii w stosunku do rosnącego stężenia miodu. Badania pokazują, że miód hamuje wzrost bakterii, co może świadczyć o jego działaniu bakteriostatycznym. Chęć dowiedzenia, bakteriostatycznych właściwości miodu wymagałoby wnikliwszych badań.
Jak napisano we wstępie dominującym składnikiem miodu są węglowodany, które są odpowiedzialne za właściwości osmotyczne miodu. Hipertoniczne środowisko, jakie może stworzyć roztwór miodu względem komórki bakterii może powodować przepływ wody na zewnątrz komórki a w rezultacie jej śmierć [5]. Badania wpływu sacharozy i glukozy na hodowle komórek bakteryjnych potwierdzają przyjętą hipotezę. Badania te wykazują, że wysokie stężenie cukrów w pożywce zaburza rozwój hodowli. Bakterie po wejściu w fazę wzrostu logarytmicznego na pożywce z wysokim stężeniem cukru wykazują zaburzenia we wzroście, a potwierdzają to wyniki badania absorbancji. W celu weryfikacji działania wysokiego stężenia węglowodanów w miodzie konieczne są dodatkowe badania.
Badania pH roztworu miodu potwierdzają zgodność tezy odnoszącej się do jego bakteriobójczych właściwości. Za sprawą obecnych w miodzie kwasów organicznych: mlekowego, jabłkowego, bursztynowego, mrówkowego, cytrynowego, octowego, masłowego, p-aminobenzoesowego, piroglutaminowego oraz glukonowego miód zawdzięcza swój kwasowy odczyn [6]. W zależności od stężenia miodu w roztworze odczyn może być mniej kwasowy w roztworach o niskim stężeniu albo bardziej kwasowy w mieszaninach o wyższym stężeniu miodu. Wysokie stężenie miodu i skorelowane z tym niskie pH, jak wykazują powyższe badania, może działać bakteriobójczo. Kwaśny odczyn wysoko stężonego roztworu miodu uniemożliwia rozwój większości bakterii. Jednak niektóre bakterie są w stanie przeżyć w niskim pH. Zatem niskie pH i skorelowany z tym kwasowy odczyn wysoko stężonego roztworu miodu jest kwestią wymagającą wnikliwszych badań nad metabolizmem bakterii.
Chęć głębszego zbadania wpływu różnych rodzajów miodu oraz czynników powodujących zakłócanie jego działania na rozwój bakterii uzasadnia dalsze, bardziej szczegółowe badania o podobnej tematyce.
Piśmiennictwo
- Piotr Nawrotnik, Stefania Nowakowska. Miód: wartość odżywcza i właściwości lecznicze miodu, „Poradnik zdrowie”, www.poradnikzdrowie.pl (dostęp 16.08.2016 r.)
- Magdalena Stary, Stanisław Kowalski. Miód jego właściwości żywieniowe i zdrowotne, „Zdrowa żywność”,www.zdrowa-zywnosc.pl (dostęp 17.08.2016 r.)
- Ewelina Hoffman. Miód - skuteczny na oporne bakterie, „Biotechnologia.pl”, biotechnologia.pl (dostęp 17.08.2016 r.)
- Falkow Stanley. The evolution of pathogenicity in Escherichia, Shigella, and Salmonella W: Escherichia coli and Salmonella cellular and molecular biology, red. F.C. Neidhardt,t. 2, str. 2723-2729, ASM Press Washington DC, 1996
- Marek Guzik, Ewa Jastrzębska, Ryszard Kozik, Renata Matuszewska, Ewa Pyłka-Gutowska, Władysław Zamachowski. Budowa i właściwości błon biologicznych, „Biologia na czasie 1” - zakres rozszerzony str. 58, wyd. Nowa Era.
- Magdalena Godlewska, Renata Świsłocka. Fizykochemiczne i przeciwdrobnoustrojowe właściwości miodów z rejonu Podlasia „Kosmos, problemy nauk biologicznych”. Tom 64, numer 2, strony 347-352. Państwowa Wyższa Szkoła Informatyki i Przedsiębiorczości Instytut Technologii Żywności i Gastronomii, Łomża 2015
-
Kontakt w sprawach zamówień artykułów spożywczych: 72 817 57 67 ↩︎ ↩︎ ↩︎
-
Niezbędny we wszelkich doświadczeniach laboratoryjnych. ↩︎ ↩︎
-
Laboratoryjne określenie pożywki stałej. ↩︎
-
Laboratoryjne określenie pożywki płynnej. ↩︎
-
Liczba obrotów na minutę (RPM - rotation per minute). ↩︎
-
Czas, w którym zachodzi kolejny podział komórki E. coli w warunkach optymalnych. ↩︎
- Zaloguj się albo zarejestruj aby dodać komentarz
