Chemia - Informator CKE, Poziom rozszerzony (Formuła 2023) - Zadanie 36.
W analizie potencjometrycznej wykorzystuje się zależność potencjału odpowiednich elektrod od stężenia jonów oznaczanych. Pomiary potencjometryczne polegają na mierzeniu SEM ogniwa zestawionego z dwóch półogniw: tzw. elektrody wskaźnikowej, zanurzonej w badanym roztworze, oraz tzw. elektrody odniesienia, zanurzonej w roztworze o niezmiennym składzie, której potencjał w warunkach pomiaru pozostaje stały.
Rozróżnia się dwa główne typy elektrod. Elektrody pierwszego rodzaju to elektrody odwracalne względem kationu: są zbudowane z metalu i są w równowadze z roztworem zawierającym jony tego metalu (M oznacza symbol metalu):
M(s) + ⇄ Mn+(aq) + 𝑛e–
Elektrody drugiego rodzaju są odwracalne względem anionu, tworzącego z metalem elektrody trudno rozpuszczalny związek. Elektrodą drugiego rodzaju jest elektroda halogenosrebrowa. Działanie tej elektrody opisuje równanie (X oznacza symbol halogenu):
AgX(s) + e– ⇄ Ag(s) + X–(aq)
Jedną z metod potencjometrycznych jest miareczkowanie potencjometryczne. Przeprowadzono miareczkowanie potencjometryczne w celu oznaczenia stężenia anionów chlorkowych i jodkowych w badanym roztworze.
Próbkę roztworu o objętości V0 = 10,00 cm3 rozcieńczono wodą do objętości 50,00 cm3. Ten rozcieńczony roztwór stanowił analit. Z elektrody srebrowej jako elektrody wskaźnikowej oraz elektrody halogenosrebrowej jako elektrody odniesienia zbudowano ogniwo, po czym zmierzono jego SEM. Następnie do analitu stopniowo wkraplano roztwór azotanu(V) srebra o stężeniu cAgNO3 = 0,05 mol ⋅ dm3. Po dodaniu każdej porcji titranta mierzono SEM ogniwa. W czasie miareczkowania wytrącały się kolejno osady halogenków srebra, czemu towarzyszyły dwie duże zmiany mierzonej siły elektromotorycznej odpowiadające dwóm punktom równoważnikowym miareczkowania.
Punkt równoważnikowy I odpowiadał momentowi, w którym liczba dodanych moli jonów Ag+ była równa liczbie moli jonów halogenkowych wytrącających się jako pierwsze. Analogicznie przebiegało oznaczenie drugiego rodzaju jonów halogenkowych i momentowi, w którym zaszła równość liczb moli, odpowiadał punkt równoważnikowy II.
Aby wyznaczyć objętość titranta w I i II punkcie równoważnikowym miareczkowania, dla każdej dodanej porcji titranta ΔVtitranta obliczono zmianę siły elektromotorycznej ogniwa ΔSEM, a następnie sporządzono wykres ΔSEMΔVtitranta jako funkcji Vtitranta.
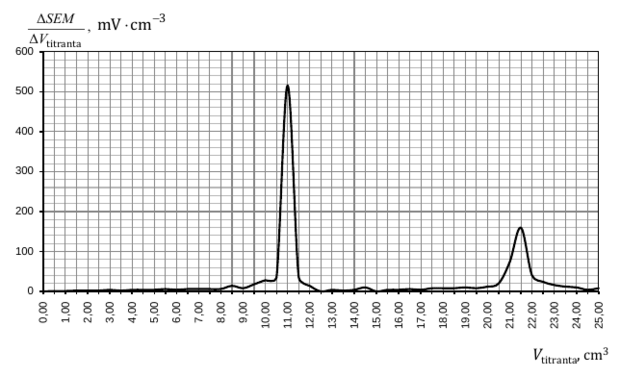
W temperaturze 298 K iloczyn rozpuszczalności chlorku srebra Kso[AgCl] = 1,6 ∙ 10−10, a jodku srebra – KSO [AgI] = 1,5 ∙ 10−16.
Oblicz stężenie molowe jonów chlorkowych w roztworze, którego próbkę o objętości V0 = 10,00 cm3 pobrano do miareczkowania.
Rozwiązanie
Treść zadania i zasady oceniania zaktualizowane przez CKE 28 sierpnia 2023.
Zasady oceniania
4 pkt – jeżeli rozwiązanie nie zawiera błędów.
3 pkt – obliczenie liczby moli anionów chlorkowych na podstawie odczytanej z wykresu objętości titranta potrzebnej do strącenia tych jonów oraz obliczenie stężenia molowego anionów chlorkowych w roztworze, którego próbkę o objętości V0 = 10,00 cm3 pobrano do miareczkowania, ale rozwiązanie zawiera błędy (arytmetyczne, odczytu danych, wynik jest podany z błędną jednostką lub bez jednostki).
2 pkt – poprawne obliczenie liczby jonów chlorkowych w próbce.
1 pkt – zastosowanie poprawnej metody prowadzącej do obliczenia liczby jonów chlorkowych w próbce – wykorzystanie w rozwiązaniu iloczynu rozpuszczalności – ale niewykonanie obliczeń (brak liczby jonów chlorkowych w próbce).
0 pkt – rozwiązanie, w którym nie ma niewielkiego postępu, albo brak rozwiązania.
Rozwiązanie
Obliczenie liczby moli anionów chlorkowych na podstawie odczytanej z wykresu
objętości titranta potrzebnej do strącenia tych jonów.
Vtitranta w I PR: 11,00 cm3 (10,50–11,50 cm3)
Vtitranta w II PR: 21,50 cm3 (21,00–22,00 cm3)
nCl− = nAg+ = cAgNO3 ∙ (VIIAgNO3 − VIAgNO3)
nCl− = 0,05 mmol∙cm−3 ∙ (21,5 cm3 − 11 cm3)
nCl− = 0,53 mmol ALBO 0,525 mmol
ALBO
nCl− = 0,53 ∙ 10−3 mol ALBO 0,525 ∙ 10−3 mol
Obliczenie stężenia molowego anionów chlorkowych w roztworze, którego próbkę o objętości V0 = 10,00 cm3 pobrano do miareczkowania.
V0 = 10,00 cm3 = 10,00 ∙ 10−3 dm3
nCl− = 0,525 mmol = 0,525 ∙ 10−3 mol
⇒
cCl− = nCl−V0 = 0,525 ∙ 10−3 mol10,00 ∙ 10−3 dm3 = 0,053 mol ∙ dm−3
