Matura Maj 2023, Poziom rozszerzony (Formuła 2023) - Zadanie 10. (2 pkt)
Badano reakcje mocnego kwasu HA i słabego kwasu HX z mocną zasadą. W tym celu wykonano miareczkowanie wodnych roztworów tych kwasów za pomocą wodnego roztworu wodorotlenku potasu – zgodnie z poniższym opisem.
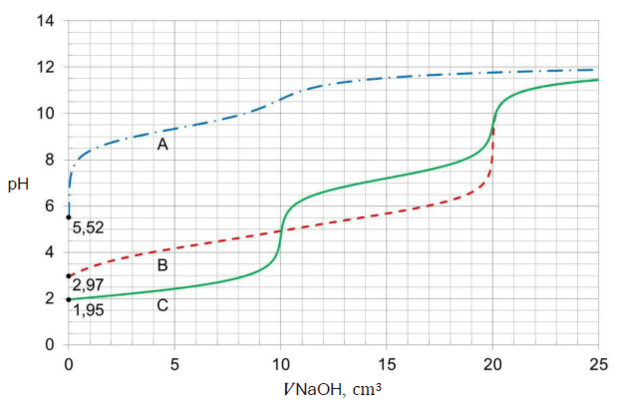
Umieszczono w zlewce 20,0 cm3 roztworu wybranego kwasu o stężeniu 0,10 mol ∙ dm−3 i zmierzono pH tego roztworu. Następnie do zlewki z roztworem kwasu dodawano porcjami wodny roztwór KOH o stężeniu 0,10 mol ∙ dm−3. Po dodaniu każdej porcji roztworu wodorotlenku mierzono pH mieszaniny reakcyjnej. Punkt równoważnikowy (PR) został osiągnięty po dodaniu takiej objętości roztworu KOH, w jakiej liczba moli zasady jest równa liczbie moli kwasu. Uzyskane wyniki przedstawiono w formie wykresu zależności mierzonego pH od objętości roztworu KOH – naniesione punkty połączono, w wyniku czego otrzymano krzywą miareczkowania.
Poniżej przedstawiono krzywą miareczkowania wodnego roztworu jednego z tych kwasów (HA albo HX) wodnym roztworem wodorotlenku potasu.
Rozstrzygnij, czy przedstawiony wykres ilustruje wyniki miareczkowania wodnego roztworu słabego kwasu HX wodnym roztworem KOH w opisanym doświadczeniu. Odpowiedź uzasadnij – przytocz dwa różne argumenty.
Rozstrzygnięcie:
Uzasadnienie: