Chemia - Informator CKE, Poziom rozszerzony (Formuła 2023)
Zadania z informatora maturalnego wydanego przez CKE dla podstawy programowej z adnotacjami dotyczącymi aktualnych zmian.
Zadanie 1. (4 pkt)
O dwóch pierwiastkach umownie oznaczonych literami X i Z wiadomo, że:
- konfigurację elektronową atomu pierwiastka X w jednym ze stanów wzbudzonych przedstawia zapis:
- łączna liczba elektronów na ostatniej powłoce i na podpowłoce 3d atomu w stanie podstawowym pierwiastka Z jest dwa razy większa od liczby elektronów walencyjnych atomu pierwiastka X.
1.1. (0–2)
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, numer grupy układu okresowego oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.
| Symbol pierwiastka | Numer grupy | Symbol bloku | |
|---|---|---|---|
| pierwiastek X | |||
| pierwiastek Z |
1.2. (0–1)
Wpisz do tabeli wartości dwóch liczb kwantowych: głównej i pobocznej, opisujące stan kwantowo-mechaniczny jednego z niesparowanych elektronów o najwyższej energii atomu pierwiastka X w przedstawionym stanie wzbudzonym.
| Liczby kwantowe | główna liczba kwantowa, n | poboczna liczba kwantowa, l |
|---|---|---|
| Wartość liczb kwantowych |
1.3. (0–1)
Przedstaw pełną konfigurację elektronową jonu Z2+ w stanie podstawowym. Zastosuj zapis konfiguracji elektronowej z uwzględnieniem podpowłok.
Zadanie 2. (1 pkt)
Wybierz parę pierwiastków, których atomy w stanie podstawowym mają różne liczby niesparowanych elektronów. Zaznacz poprawną odpowiedź.
- krzem i tytan
- siarka i tytan
- krzem i żelazo
- siarka i nikiel
Zadanie 3. (1 pkt)
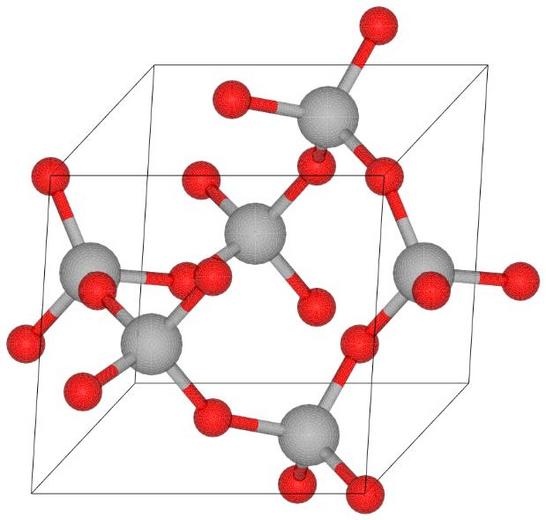
Tlenek krzemu (SiO2), nazywany potocznie krzemionką, jest bardzo rozpowszechniony w przyrodzie. Czysta krzemionka występuje w postaci krystalicznej, np. jako minerał kwarc. Poniżej przedstawiono zdjęcie kryształów kwarcu oraz model jego struktury krystalicznej.
Dokończ zdanie. Zaznacz odpowiedź spośród A–D i jej uzasadnienie spośród 1.–4.
Kwarc można zaliczyć do kryształów
| A. | metalicznych, | ponieważ | 1. | składa się z cząsteczek SiO2 połączonych oddziaływaniami międzycząsteczkowymi. |
| B. | jonowych, | 2. | jego strukturę tworzą rdzenie atomowe otoczone wspólną „chmurą” elektronów zdelokalizowanych. | |
| C. | kowalencyjnych, | 3. | jest zbudowany z anionów tlenkowych (O2–) i kationów krzemu (Si4+). | |
| D. | molekularnych, | 4. | jest zbudowany z atomów połączonych wiązaniami kowalencyjnymi spolaryzowanymi. |
Zadanie 4. (1 pkt)
Podczas bombardowania folii aluminiowej cząstkami alfa zachodzą procesy jądrowe z równoczesną emisją pozytonów i neutronów. Stwierdzono, że przemiana jest dwuetapowa: w pierwszej reakcji jądrowej powstają niestabilne jądro i neutron, a potem następuje rozpad β+ tego niestabilnego jądra, któremu towarzyszy emisja neutrino ν.
Napisz równania opisanej przemiany jądrowej. Uzupełnij emisja poniższe schematy.
Zadanie 5. (1 pkt)
Promieniotwórczość ciężkojonowa to szczególny i rzadki rodzaj promieniotwórczości. Polega na emisji z ciężkiego jądra atomowego jąder atomów lekkiego pierwiastka. Równania takich rozpadów promieniotwórczych zapisuje się zgodnie z zasadami zachowania: ładunku elektrycznego jąder oraz liczby nukleonów.
Napisz równanie rozpadu jądra promieniotwórczego izotopu 22389Ac, z którego jest emitowane jądro izotopu węgla zawierające 8 neutronów.
Zadanie 6. (2 pkt)
Atom siarki tworzy z atomami fluoru m.in. cząsteczki o wzorze SF2 i SF6.
6.1. (0–1)
Narysuj wzór elektronowy cząsteczki SF2 – zaznacz kreskami wspólne pary elektronowe oraz wolne pary elektronowe atomów siarki i fluoru. Określ kształt cząsteczki (liniowa, kątowa, tetraedryczna).
Wzór elektronowy:
Kształt cząsteczki:
6.2. (0–1)
Poniżej zamieszczono model ilustrujący kształt cząsteczki SF6.
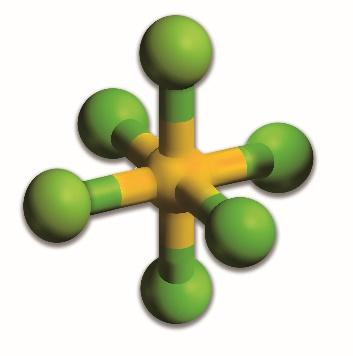
Wykaż na podstawie teorii VSEPR (odpychanie par elektronowych powłoki walencyjnej), że przedstawiony model jest poprawną ilustracją kształtu cząsteczki SF6.
Zadanie 7. (2 pkt)
Zbadano wpływ zmian temperatury (doświadczenie I) i zmian ciśnienia (doświadczenie II) w układzie na wydajność otrzymywania produktu X w reakcji opisanej schematem:
aA (g) + bB (g) ⇄ xX (g)
Wyniki pomiarów zamieszczono w poniższych tabelach. Zawartość produktu X w mieszaninie równowagowej wyrażono w procentach objętościowych.
Doświadczenie I
| Ciśnienie, MPa | Temperatura, °C | Zawartość produktu X w mieszaninie równowagowej |
|---|---|---|
| 20 | 300 | 63% |
| 500 | 18% | |
| 700 | 4% |
Doświadczenie II
| Temperatura, °C | Ciśnienie, MPa | Zawartość produktu X w mieszaninie równowagowej |
|---|---|---|
| 400 | 0,1 | 0.4% |
| 10 | 26% | |
| 60 | 66% |
Na podstawie przedstawionych wyników pomiarów wybierz spośród wymienionych poniżej proces, który zachodził w badanym układzie. Napisz numer wybranego procesu. Odpowiedź uzasadnij.
| Numer procesu | Równanie reakcji | ∆H°, kJ |
|---|---|---|
| 1 | N2 (g) + O2 ⇄ 2NO (g) | 182,6 |
| 2 | 2F2 (g) + O2 ⇄ 2F2O (g) | 49,0 |
| 3 | N2 (g) + 3H2 (g) ⇄ 2NH3 (g) | -91,8 |
| 4 | Cl2 (g) + H2 (g) ⇄ 2HCl (g) | -184,6 |
Numer procesu:
Uzasadnienie:
Zadanie 8. (1 pkt)
Przeprowadzono doświadczenie, którego celem była obserwacja zmian energii wewnętrznej badanego układu w wyniku przemiany chemicznej. W procesie przeprowadzonym w warunkach izotermiczno-izobarycznych wprowadzono do cylindra gazowy tlen oraz sproszkowane żelazo i zamknięto ten cylinder ruchomym tłokiem. Schemat doświadczenia przedstawiono na poniższym rysunku.
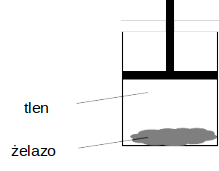
W warunkach doświadczenia reakcja zachodziła z niewielką szybkością. Ścianki cylindra umożliwiały wymianę ciepła z otoczeniem.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
W wyniku przebiegu opisanego procesu tlen się zużywa, a tłok przesuwa się (w dół / w górę), wykonując pracę nad układem. Przemianie żelaza w tlenek żelaza(III) towarzyszyło odprowadzenie ciepła do otoczenia, co oznacza, że ta reakcja jest procesem (endoenergetycznym / egzoenergetycznym).
Zadanie 9. (2 pkt)
Reakcja rozkładu azotanu(V) ołowiu(II) jest procesem endoenergetycznym i przebiega zgodnie z równaniem:
2Pb(NO3)2 → 2PbO + 4NO2↑ + O2↑
Wartości standardowych entalpii tworzenia związków biorących udział w opisanej reakcji podano w poniższej tabeli.
| Pb(NO3)2 | PbO | NO2 | |
|---|---|---|---|
| standardowa entalpia tworzenia ΔH°, kJ ⋅ mol−1 | −449,2 | −218,6 | 34,2 |
Oblicz, ile energii na sposób ciepła należy dostarczyć, aby całkowicie rozłożyć 3,31 g Pb(NO3)2.
Obliczenia:
Zadanie 10. (1 pkt)
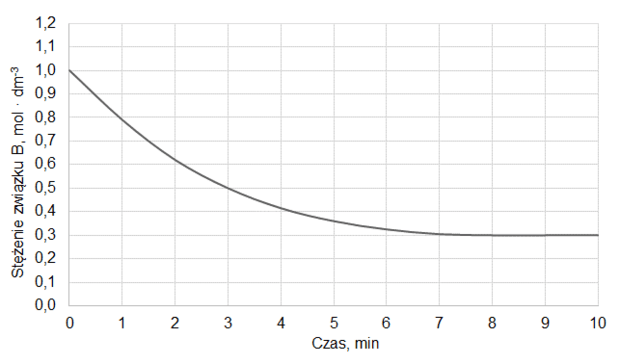
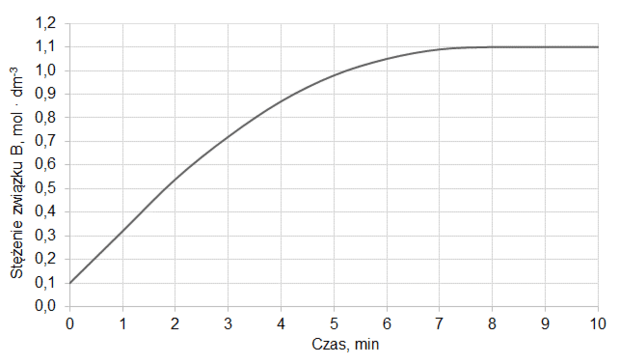
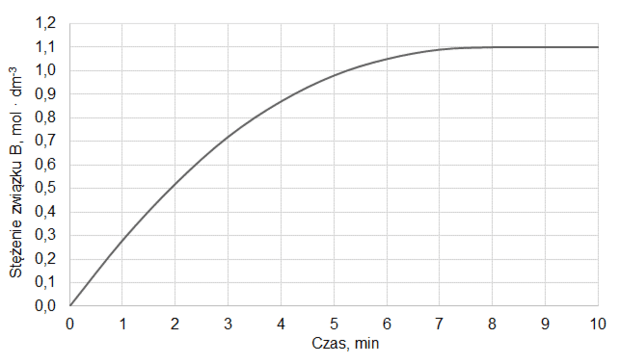
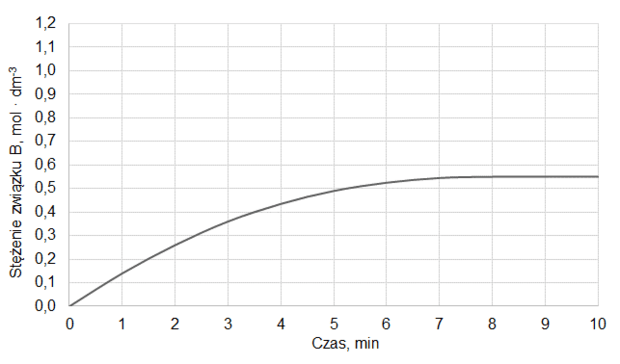
Do reaktora o stałej pojemności, z którego usunięto powietrze, wprowadzono próbkę gazowego związku A i zainicjowano reakcję. W zamkniętym reaktorze ustaliła się równowaga opisana równaniem:
A (g) ⇄ 2B (g)
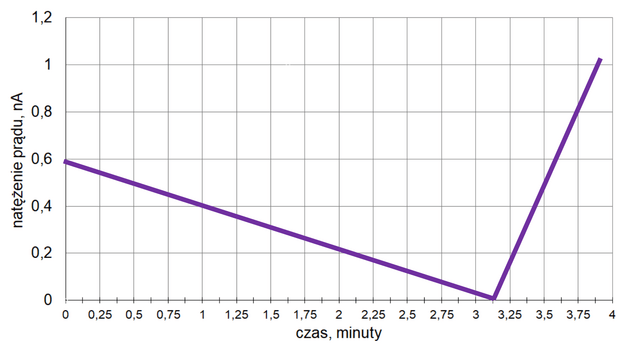
Mierzono stężenie związku A w czasie trwania reakcji. Tę zależność przedstawiono na poniższym wykresie:
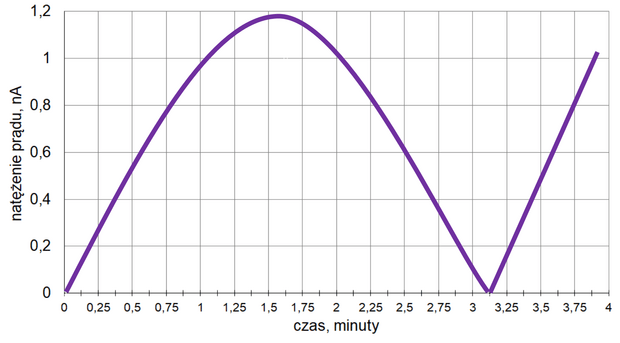
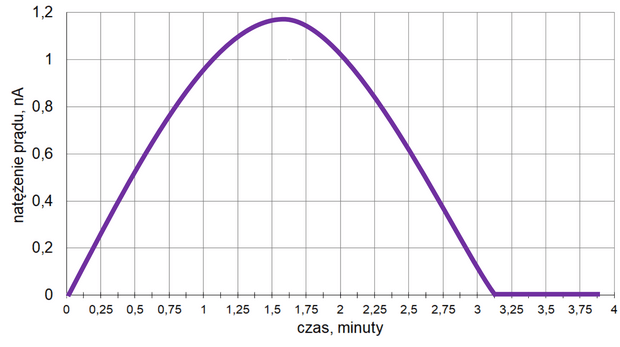
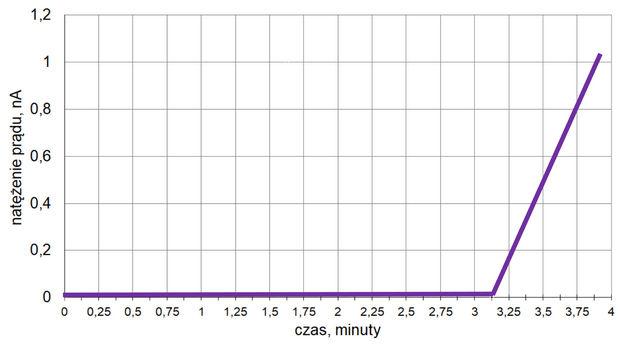
Z poniższych wykresów wybierz ten, który jest ilustracją zależność stężenia związku B od czasu trwania reakcji. Zaznacz wykres A, B, C albo D i uzasadnij swój wybór.
Uzasadnienie:
Zadanie 11. (2 pkt)
Skład mieszaniny można wyrazić za pomocą ułamków molowych. Ułamek molowy składnika A, xn(A), to iloraz liczby moli tego składnika, nA, i sumy liczb moli wszystkich składników mieszaniny. Np. dla mieszaniny trójskładnikowej A. B. C:
Xn(A) = nAnA + nB + nC
W pewnych warunkach ciśnienia i temperatury sporządzono mieszaninę dwóch gazowych substancji: wodoru i jodu, w zamkniętym reaktorze o objętości V = 20,0 dm3.
Po zainicjowaniu procesu opisanego równaniem:
H2 (g) + I2 (g) mieszaninę ⇄ 2HI (g) ∆H = 26,5 kJmol HI (g)
uzyskano w stanie równowagi mieszaninę o składzie m(I2) = 381 g, n(HI) - 1,50 mol oraz pewną ilość wodoru. Sumaryczna liczba moli wszystkich składników uzyskanej mieszaniny równowagowej wynosiła 6,00 moli.
Oblicz wartość stężeniowej stałej równowagi reakcji syntezy jodowodoru w warunkach temperatury i ciśnienia, w których wykonano pomiar, oraz oblicz skład początkowej mieszaniny substratów reakcji w ułamkach molowych.
Zadanie 12. (1 pkt)
Skład mieszaniny można wyrazić za pomocą ułamków molowych. Ułamek molowy składnika A, xn(A), to iloraz liczby moli tego składnika, nA, i sumy liczb moli wszystkich składników mieszaniny. Np. dla mieszaniny trójskładnikowej A. B. C:
Xn(A) = nAnA + nB + nC
W pewnych warunkach ciśnienia i temperatury sporządzono mieszaninę dwóch gazowych substancji: wodoru i jodu, w zamkniętym reaktorze o objętości V = 20,0 dm3.
Po zainicjowaniu procesu opisanego równaniem:
H2 (g) + I2 (g) mieszaninę ⇄ 2HI (g) ∆H = 26,5 kJmol HI (g)
uzyskano w stanie równowagi mieszaninę o składzie m(I2) = 381 g, n(HI) - 1,50 mol oraz pewną ilość wodoru. Sumaryczna liczba moli wszystkich składników uzyskanej mieszaniny równowagowej wynosiła 6,00 moli.
Narysuj wykres przedstawiający zmiany liczby moli wszystkich reagentów w czasie trwania reakcji: od momentu rozpoczęcia eksperymentu – P, przez moment, w którym układ osiągnął stan równowagi – R, do momentu zakończenia eksperymentu – Z. W tym celu narysuj trzy krzywe obrazujące zmiany liczb moli reagentów i wprowadź oznaczenia tych krzywych: n(H2), n(I2) oraz n(HI).
Zadanie 13. (1 pkt)
Skład mieszaniny można wyrazić za pomocą ułamków molowych. Ułamek molowy składnika A, xn(A), to iloraz liczby moli tego składnika, nA, i sumy liczb moli wszystkich składników mieszaniny. Np. dla mieszaniny trójskładnikowej A. B. C:
Xn(A) = nAnA + nB + nC
W pewnych warunkach ciśnienia i temperatury sporządzono mieszaninę dwóch gazowych substancji: wodoru i jodu, w zamkniętym reaktorze o objętości V = 20,0 dm3.
Po zainicjowaniu procesu opisanego równaniem:
H2 (g) + I2 (g) mieszaninę ⇄ 2HI (g) ∆H = 26,5 kJmol HI (g)
uzyskano w stanie równowagi mieszaninę o składzie m(I2) = 381 g, n(HI) - 1,50 mol oraz pewną ilość wodoru. Sumaryczna liczba moli wszystkich składników uzyskanej mieszaniny równowagowej wynosiła 6,00 moli.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Wraz ze wzrostem temperatury, w warunkach izobarycznych, wartość stałej równowagi reakcji syntezy jodowodoru będzie malała. | P | F |
| 2. | Wraz ze wzrostem temperatury, w warunkach izobarycznych, wartość ułamka molowego jodowodoru w mieszaninie równowagowej będzie wzrastała. | P | F |
| 3. | Szybkość reakcji H2 (g) + I2 (g) → 2HI (g) na początku eksperymentu jest większa od szybkości reakcji 2HI (g) → H2 (g) + I2 (g) mierzonej w tym samym momencie. | P | F |
Zadanie 14. (3 pkt)
Termograwimetria to technika badania związków chemicznych pozwalająca m.in. na rejestrację zmian masy próbki w trakcie jej rozkładu termicznego. Wynikiem takiego badania jest krzywa zwana termogramem, ilustrująca zmianę masy próbki w funkcji wzrastającej ze stałą szybkością temperatury.
Próbkę zawierającą 3∙10–4 mola uwodnionego węglanu kobaltu(II), CoCO3∙xH2O, ogrzewano w atmosferze argonu. Rejestrowano zmiany masy próbki wraz z rosnącą temperaturą w przedziale od 0°C do 550°C. Badanie prowadzono do chwili, w której masa próbki nie ulegała już dalszym zmianom. Stwierdzono, że rozkład termiczny zachodzi w dwóch etapach. Analiza gazowych produktów rozkładu powstających w trakcie eksperymentu w obu etapach wykazała, że w każdym z nich wydziela się tylko jeden rodzaj gazu, w każdym z etapów – inny. Uzyskany termogram przedstawiono na schemacie.
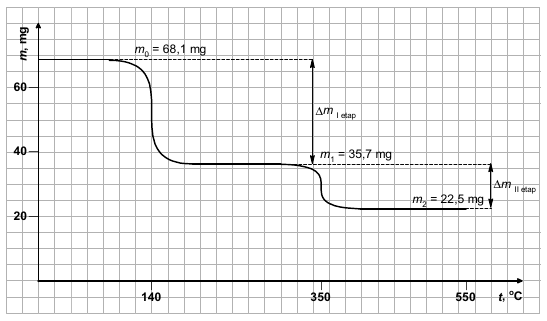
Na podstawie obliczeń ustal przebieg rozkładu hydratu węglanu kobaltu(II) – napisz równania reakcji przebiegających w I i II etapie rozkładu.
Równanie reakcji rozkładu w I etapie:
Równanie reakcji rozkładu w II etapie:
Zadanie 15. (3 pkt)
Przeprowadzono doświadczenie, w którym na podstawie zachodzącej reakcji chemicznej można stwierdzić, że wolny chlor jest silniejszym utleniaczem niż wolny brom.
15.1. (0–1)
Uzupełnij schemat przeprowadzonego doświadczenia – zaznacz po jednym wzorze odczynnika w zestawach I i II.
15.2. (0–1)
Do probówki zawierającej kilka cm3 bezbarwnego rozpuszczalnika CHCl3 wlano podobną objętość odczynnika, który został wybrany z zestawu I, a następnie zawartość probówki energicznie wstrząsano. Zaobserwowano rozdzielenie się cieczy na dwie warstwy (etap 1.). Następnie do probówki dodano odczynnik wybrany z zestawu II, ponownie wstrząsano zawartość probówki i zaobserwowano rozdzielenie się cieczy na dwie warstwy (etap 2.).
Zaznacz numer zdjęcia, na którym zilustrowany jest wynik po etapie 1., oraz numer zdjęcia przedstawiającego wynik po etapie 2. doświadczenia.
Po etapie 1.:
Po etapie 2.:
15.3. (0–1)
Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas przeprowadzonego doświadczenia.
Zadanie 16. (2 pkt)
Jod bardzo słabo rozpuszcza się w wodzie i jego nasycony roztwór, nazywany wodą jodową, w temperaturze 25°C ma stężenie ok. 1,3·10‒3 mol·dm‒3. Dużo lepiej jod rozpuszcza się (roztwarza) w roztworze zawierającym jony jodkowe, gdyż przebiega tam reakcja opisana równaniem:
I2 + I‒ ⇄ I–3
Stężeniowa stała tej równowagi w temperaturze 25°C jest równa 700.
W niektórych schorzeniach tarczycy stosuje się tzw. płyn Lugola, który można przyrządzić,
jeśli wymiesza się 1 g jodu i 2 g jodku potasu z 97 g wody.
Oblicz masę jodu rozpuszczonego w 100 g nasyconego wodnego roztworu w temperaturze 25°C. Oblicz, ile razy masa jodu, który rozpuszczono, aby przygotować 100 g płynu Lugola, jest większa niż masa jodu w 100 g wody jodowej. Przyjmij, że gęstość wody jodowej jest równa 1,0 g·cm–3.
Zadanie 17. (2 pkt)
Jod bardzo słabo rozpuszcza się w wodzie i jego nasycony roztwór, nazywany wodą jodową, w temperaturze 25°C ma stężenie ok. 1,3·10‒3 mol·dm‒3. Dużo lepiej jod rozpuszcza się (roztwarza) w roztworze zawierającym jony jodkowe, gdyż przebiega tam reakcja opisana równaniem:
I2 + I‒ ⇄ I–3
Stężeniowa stała tej równowagi w temperaturze 25°C jest równa 700.
W niektórych schorzeniach tarczycy stosuje się tzw. płyn Lugola, który można przyrządzić,
jeśli wymiesza się 1 g jodu i 2 g jodku potasu z 97 g wody.
Oblicz równowagowe stężenie jonów jodkowych (I‒) w płynie Lugola w temperaturze 25°C. Przyjmij, że gęstość tego roztworu w temperaturze pokojowej jest równa 1,05 g·cm‒3.
Zadanie 18. (1 pkt)
Jod bardzo słabo rozpuszcza się w wodzie i jego nasycony roztwór, nazywany wodą jodową, w temperaturze 25°C ma stężenie ok. 1,3·10‒3 mol·dm‒3. Dużo lepiej jod rozpuszcza się (roztwarza) w roztworze zawierającym jony jodkowe, gdyż przebiega tam reakcja opisana równaniem:
I2 + I‒ ⇄ I–3
Stężeniowa stała tej równowagi w temperaturze 25°C jest równa 700.
W niektórych schorzeniach tarczycy stosuje się tzw. płyn Lugola, który można przyrządzić,
jeśli wymiesza się 1 g jodu i 2 g jodku potasu z 97 g wody.
Jon trijodkowy I‒3 ma budowę liniową.
Narysuj wzór elektronowy jonu trijodkowego. Zaznacz kreskami wszystkie wspólne i wolne pary elektronowe atomów.
Zadanie 19. (1 pkt)
Jod bardzo słabo rozpuszcza się w wodzie i jego nasycony roztwór, nazywany wodą jodową, w temperaturze 25°C ma stężenie ok. 1,3·10‒3 mol·dm‒3. Dużo lepiej jod rozpuszcza się (roztwarza) w roztworze zawierającym jony jodkowe, gdyż przebiega tam reakcja opisana równaniem:
I2 + I‒ ⇄ I–3
Stężeniowa stała tej równowagi w temperaturze 25°C jest równa 700.
W niektórych schorzeniach tarczycy stosuje się tzw. płyn Lugola, który można przyrządzić,
jeśli wymiesza się 1 g jodu i 2 g jodku potasu z 97 g wody.
W roztworze wodnym o odczynie zasadowym cząsteczki jodu ulegają reakcji dysproporcjonowania, w wyniku czego tworzą się jony jodkowe i jony jodanowe(I). Jodany(I) są tak nietrwałe, że łatwo ulegają kolejnej przemianie, której produktami są jodki i jodany(V).
Napisz w formie jonowej sumaryczne równanie reakcji zachodzącej po wprowadzeniu jodu do wodnego roztworu wodorotlenku sodu.
Zadanie 20. (4 pkt)
W poniższych tabelach zamieszczone są dane dotyczące wodnych roztworów jodku potasu.
Tabela 1. Zależność rozpuszczalności jodku potasu (KI) od temperatury
| Temperatura, °C | Rozpuszczalność, g/100 g wody |
|---|---|
| 0 | 127 |
| 10 | 136 |
| 25 | 148 |
| 40 | 160 |
| 50 | 169 |
| 60 | 176 |
Tabela 2. Zależność gęstości roztworów jodku potasu od stężenia (t = 20°C)
| Stężenie, % mas. | Gęstość, g ∙ cm–3 |
|---|---|
| 12 | 1,093 |
| 14 | 1,111 |
| 16 | 1,128 |
| 18 | 1,147 |
| 20 | 1,166 |
| 22 | 1,186 |
| 24 | 1,206 |
| 26 | 1,227 |
| 28 | 1,249 |
| 30 | 1,271 |
| 32 | 1,294 |
| 34 | 1,319 |
Przygotowano 100 g wodnego roztworu jodku potasu w temperaturze t = 20°C, a następnie go rozcieńczono, dodając 195 g wody i utrzymując stałą temperaturę 20°C.
Na podstawie zamieszczonych informacji narysuj wykres zależności rozpuszczalności jodku potasu od temperatury, a następnie oblicz stężenie molowe roztworu otrzymanego po zmieszaniu 100 g roztworu nasyconego i 195 g wody w temperaturze 20°C.

Zadanie 21. (3 pkt)
Dwa tlenki metali, oznaczone umownie wzorami A2O i XO3, reagują ze sobą w stosunku molowym 1:1. Produktem reakcji jest jonowy związek Z, w którym masowa zawartość procentowa pierwiastka A wynosi 40,2%, natomiast dla pierwiastka X ta wielkość jest równa 26,8%.
21.1. (0–2)
Na podstawie obliczeń ustal symbole pierwiastków A i X.
Symbol pierwiastka A:
Symbol pierwiastka X:
21.2. (0–1)
Zaznacz numer zdjęcia, na którym przedstawiono związek Z.
Zadanie 22. (3 pkt)
W dwóch kolbach znajdują się dwa różne, ale podobnie wyglądające roztwory wodne:
22.1. (0–1)
Spośród wymienionych niżej roztworów wybierz te, które mogą wyglądać tak jak roztwory pokazane na ilustracjach. Zaznacz ich wzory lub nazwy.
| Roztwory | |
| K2CrO4 (aq) | CuSO4 (aq) |
| KMnO4 (aq) | MnSO4 (aq) |
| HCl (aq) z dodatkiem wodnego roztworu oranżu metylowego |
KOH (aq) z dodatkiem alkoholowego roztworu fenoloftaleiny |
22.2. (0–1)
Przeprowadzono dwa niezależne doświadczenia, w których do roztworów z obu naczyń dodano jeden taki sam odczynnik. W każdym z tych doświadczeń nastąpiła wyraźna zmiana barwy tylko jednego roztworu.
Wybierz dwa odczynniki, z których każdy po dodaniu (w odpowiedniej ilości) do obu badanych roztworów spowoduje wyraźną zmianę barwy tylko jednego z nich. Zaznacz wzory wybranych odczynników.
| Odczynniki | |
| HBr (aq) | K2SO4 (aq) |
| NaOH (aq) | NaNO2 (aq) |
| H2SO4 (aq) | NaNO3 (aq) |
22.3. (0–1)
Napisz w formie jonowej skróconej równania reakcji, których przebieg był przyczyną zmiany barwy roztworu z każdego naczynia.
Zadanie 23. (2 pkt)
Uczniowie wykonywali doświadczenie, podczas którego działali kwasem solnym na węglan wapnia, w zestawie umożliwiającym pochłanianie wydzielającego się CO2 w roztworze KOH. Naczynie z tym roztworem miało być zważone przed doświadczeniem i po jego zakończeniu. Reakcje wydzielania i pochłaniania CO2 opisują równania:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CO2 + 2KOH → K2CO3 + H2O
Węglan wapnia był stosowany w nadmiarze, natomiast kwas solny miał nieznane stężenie, ale mógł zostać dokładnie odmierzony. Na podstawie jego objętości oraz przyrostu masy naczynia z KOH, uczniowie mieli oszacować stężenie roztworu HCl. Swoje pomiary zapisali w poniższej tabeli:
| Uczeń | Objętość roztworu HCl | Przyrost masy w naczyniu z KOH |
|---|---|---|
| I | 10,0 cm3 | 1,1 g |
| II | 20,0 cm3 | 11,0 g |
Okazało się, że jeden z uczniów błędnie zmierzył lub błędnie zapisał przyrost masy.
Oblicz stężenie molowe badanego roztworu na podstawie wyników ucznia I i ucznia II. Wskaż ucznia, który poprawnie wykonał doświadczenie. Odpowiedź uzasadnij.
Doświadczenie poprawnie wykonał uczeń .
Uzasadnienie:
Zadanie 24. (2 pkt)
Azotki to grupa związków chemicznych o zróżnicowanej budowie i właściwościach, w której atomom azotu przypisuje się stopień utlenienia równy –III. Niżej opisano wybrane właściwości dwóch azotków.
- Azotek litu, Li3 N, w temperaturze T = 298 K i pod ciśnieniem p = 1000 hPa jest krystalicznym ciałem stałym, o wysokiej temperaturze topnienia. Po stopieniu azotek litu przewodzi prąd elektryczny. Azotek litu otrzymuje się w reakcji syntezy z pierwiastków. Jest substancją higroskopijną, a w kontakcie z wodą rozkłada się z wydzieleniem amoniaku. Roztwór po reakcji azotku litu z wodą i usunięciu amoniaku z roztworu ma pH > 7. Li3N reaguje też z wodnymi roztworami kwasów.
- Azotek boru, BN, to w temperaturze T = 298 K i pod ciśnieniem p = 1000 hPa krystaliczne, bezbarwne ciało stałe, o bardzo wysokiej temperaturze topnienia, występujące w kilku odmianach polimorficznych. Stopiony azotek boru nie przewodzi prądu elektrycznego. Zależnie od rodzaju odmiany polimorficznej wykazuje zróżnicowaną twardość od twardości zbliżonej do twardości grafitu aż do twardości diamentu. Otrzymuje się go wieloma metodami, a jedną z nich jest reakcja mocznika, CO(NH2)2, z tlenkiem boru, B2O3, w temperaturze 1000°C, przy czym produktami ubocznymi są para wodna i tlenek węgla(IV).
24.1. (0–1)
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych
w każdym nawiasie.
Azotek litu tworzy kryształy (jonowe / kowalencyjne / metaliczne), a azotek boru tworzy kryształy (jonowe / kowalencyjne / metaliczne).
24.2. (0–1)
Napisz równanie syntezy azotku litu z pierwiastków i równanie reakcji otrzymywania azotku boru z mocznika i tlenku boru.
Równanie syntezy azotku litu:
Równanie reakcji otrzymywania azotku boru:
Zadanie 25. (3 pkt)
Azotki to grupa związków chemicznych o zróżnicowanej budowie i właściwościach, w której atomom azotu przypisuje się stopień utlenienia równy –III. Niżej opisano wybrane właściwości dwóch azotków.
- Azotek litu, Li3 N, w temperaturze T = 298 K i pod ciśnieniem p = 1000 hPa jest krystalicznym ciałem stałym, o wysokiej temperaturze topnienia. Po stopieniu azotek litu przewodzi prąd elektryczny. Azotek litu otrzymuje się w reakcji syntezy z pierwiastków. Jest substancją higroskopijną, a w kontakcie z wodą rozkłada się z wydzieleniem amoniaku. Roztwór po reakcji azotku litu z wodą i usunięciu amoniaku z roztworu ma pH > 7. Li3N reaguje też z wodnymi roztworami kwasów.
- Azotek boru, BN, to w temperaturze T = 298 K i pod ciśnieniem p = 1000 hPa krystaliczne, bezbarwne ciało stałe, o bardzo wysokiej temperaturze topnienia, występujące w kilku odmianach polimorficznych. Stopiony azotek boru nie przewodzi prądu elektrycznego. Zależnie od rodzaju odmiany polimorficznej wykazuje zróżnicowaną twardość od twardości zbliżonej do twardości grafitu aż do twardości diamentu. Otrzymuje się go wieloma metodami, a jedną z nich jest reakcja mocznika, CO(NH2)2, z tlenkiem boru, B2O3, w temperaturze 1000°C, przy czym produktami ubocznymi są para wodna i tlenek węgla(IV).
Po wprowadzeniu do wody próbki Li3N o masie 43,75 mg zaszła reakcja dana równaniem:
Li3N (s) + 3H2O (c) → 3LiOH (aq) + NH3 (g)
Powstały roztwór ogrzewano aż do całkowitego usunięcia wydzielającego się w reakcji gazu. Po wystudzeniu do temperatury 25°C mieszaninę uzupełniono wodą do końcowej objętości 750 cm3 i uzyskano bezbarwny, klarowny roztwór o gęstości 1,002 g∙cm–3, który oznaczono symbolem S. Ustalono, że wartość pH roztworu S wynosi 11,7.
25.1. (0–2)
Na podstawie obliczeń wykaż, że pH otrzymanego roztworu S było równe 11,7.
25.2. (0–1)
Metoda kolorymetryczna to jedna z szybszych doświadczalnych metod oznaczania orientacyjnej wartości pH roztworu. Polega na użyciu kilku wskaźników do wyznaczenia przedziału, w którym zawiera się wartość pH badanego roztworu.
Pobrano trzy jednakowe próbki roztworu S do trzech probówek i wprowadzono do każdej z nich z osobna po kilka kropli roztworów wskaźników I, II i III.
Wskaźnik I
Zakresy zmian barw oznaczone są dla przedziałów wartości pH: (1,2–2,8) i (8,0–9,6).

Wskaźnik II
Zakresy zmian barw oznaczone są dla przedziałów wartości pH: (11,6–14,0).

Wskaźnik III
Zakresy zmian barw oznaczone są dla przedziałów wartości pH: (0,1–2,0) i (11,5–13,2).

Napisz, w jakim przedziale mieści się wartość pH roztworu S wyznaczona metodą kolorymetryczną.
| Wskaźnik | Przedział wartości pH |
| I | |
| II | |
| III |
Wartość pH badanego roztworu wyznaczona na podstawie barw wybranych wskaźników jest większa niż i mniejsza niż .
Zadanie 26. (2 pkt)
Przygotowano wodne roztwory pięciu substancji chemicznych o podanych niżej wzorach. Wszystkie roztwory miały takie samo stężenie molowe 0,1 mol·dm–3.
26.1. (0–1)
Uszereguj związki o podanych wzorach zgodnie ze wzrastającym stężeniem jonów OH− ich wodnych roztworów. Napisz wzory tych związków w odpowiedniej kolejności.
26.2. (0–1)
Napisz wzory tych związków, których wodne roztwory po dodaniu do nich wodnego roztworu oranżu metylowego zabarwią się na czerwono.
Zadanie 27. (2 pkt)
W praktyce analitycznej stosuje się roztwory zawierające mieszaninę dwóch kwasów lub zasad. Jeżeli roztwór zawiera mieszaninę dwóch słabych kwasów jednoprotonowych, można przyjąć z pewnym przybliżeniem, że stężenie jonów hydroniowych w tym roztworze jest równe:
[H3O+] = KaI ⋅ cI + KaII ⋅ cII
gdzie:
KaI i KaII – stałe dysocjacji kwasów
cI i cII – stężenia kwasów w otrzymanej mieszaninie.
W temperaturze T zmieszano 50,0 cm3 wodnego roztworu kwasu metanowego (mrówkowego) o stężeniu 0,10 mol · dm–3 z 50,0 cm3 wodnego roztworu kwasu etanowego (octowego) o stężeniu 0,10 mol · dm–3. W temperaturze T stała dysocjacji kwasu metanowego jest równa 1,77 · 10–4, a stała dysocjacji kwasu etanowego wynosi 1,75 · 10–5.
Oblicz pH otrzymanego roztworu. W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości roztworów wyjściowych. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Zadanie 28. (3 pkt)
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady nazywane są roztworami buforowymi. Przykładem buforu może być mieszanina roztworu octanu sodu i roztworu kwasu octowego. W takim roztworze ustala się równowaga chemiczna:
HA + H2O ⇄ H3O+ + A–
opisywana przez stałą dysocjacji kwasu HA.
Ponieważ
Ka = [CH3COO–][H3O+][CH3COOH],
to pH buforu octanowego można z pewnym przybliżeniem obliczyć ze wzoru:
pH = –logKa + log[CH3COO–][CH3COOH]
Wartość pH buforu prawie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
28.1. (0–1)
Zaznacz wzory dwóch związków chemicznych, których roztwory po zmieszaniu w odpowiednim stosunku pozwolą uzyskać roztwór buforowy.
28.2. (0–2)
Zmieszano 100 cm3 roztworu octanu sodu o stężeniu 0,875 mol∙dm−3 i 400 cm3 roztworu kwasu octowego o stężeniu 0,125 mol∙dm−3. Uzyskano 500 cm3 roztworu w temperaturze 298 K.
Oblicz pH uzyskanego roztworu buforowego.
Zadanie 29. (2 pkt)
W kolbie umieszczono 1,0 g tlenku wapnia, dodano 100 cm3 wody, wymieszano i kolbę zamkniętą korkiem pozostawiono na kilka godzin. Następnie pobrano trochę roztworu i w temperaturze 25°C zmierzono jego pH. Po pewnym czasie pomiar powtórzono, ale wartość pH nie zmieniła się i wynosiła 12,33. Przyjęto, że cały tlenek wapnia przereagował zgodnie z równaniem:
CaO + H2O → Ca(OH)2
i ustaliła się równowaga między fazą stałą a roztworem:
Ca(OH)2 ⇄ Ca2+ + 2OH−
Oblicz wartość iloczynu rozpuszczalności (Ks) wodorotlenku wapnia w warunkach doświadczenia.
Zadanie 30. (4 pkt)
Woda ciężka (tlenek deuteru, D2O), której cząsteczki zawierają deuter – izotop wodoru 2H, podobnie jak zwykła woda, ulega odwracalnemu procesowi autodysocjacji opisanemu równaniem:
2D2O ⇄ D3O+ + OD−.
Proces autodysocjacji można opisać stałą dysocjacji KD2O zależną od temperatury. Wygodnym sposobem posługiwania się stałą dysocjacji jest wyrażenie jej wartości w formie zlogarytmowanej: pKD2O = − logKD2O .
Zestawienie wartości pKD2O w różnych temperaturach podano w tabeli.
| Temperatura, °C | 10 | 20 | 30 | 40 | 50 |
| pKD2O | 15,44 | 15,05 | 14,70 | 14,39 | 14,10 |
Wartość pKH2O (pKw) dla procesu autodysocjacji wody zwykłej w temperaturze 25°C wynosi 14,00.
Narysuj wykres zależności pKD2O od temperatury i oblicz stężenie jonów OD− w ciężkiej wodzie w temperaturze 25°C. Rozstrzygnij, który proces dysocjacji – D2O czy H2O – zachodzi w większym stopniu w temperaturze 25°C.
Obliczenia:
Zadanie 31. (1 pkt)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | W ogniwie opisanym schematem Fe | Fe2+ || Ag+ | Ag funkcję katody pełni półogniwo żelazne, a funkcję anody − półogniwo srebrowe. |
P | F |
| 2. | W pracującym ogniwie opisanym schematem Zn | Zn2+ || Cu2+ | Cu na katodzie przebiega reakcja opisana równaniem Cu2+ + 2e– → Cu. |
P | F |
| 3. | Podczas pracy ogniwa zbudowanego z półogniwa magnezowego i półogniwa ołowiowego następuje roztwarzanie magnezu i wydzielanie się ołowiu. | P | F |
Zadanie 32. (2 pkt)
W półogniwach A i B zachodzą reakcje opisane równaniami:
| Półogniwo | Równanie reakcji elektrodowej | Potencjał standardowy redukcji E0, V |
| A | MnO2 + 4H+ + 2e− ⇄ Mn2+ + 2H2O | +1,224 |
| B | MnO−4 + 4H+ + 3e− ⇄ MnO2 + 2H2O | +1,679 |
Zbudowano ogniwo z półogniw A i B.
32.1 (0-1)
Oblicz siłę elektromotoryczną (SEM) ogniwa zbudowanego z półogniwa A i półogniwa B w warunkach standardowych.
32.2 (0-1)
Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w ogniwie zbudowanym z półogniw A i B.
Zadanie 33. (1 pkt)
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w nawiasie.
W procesie elektrolizy, podczas przepływu prądu przez wodny roztwór siarczanu(VI) miedzi(II) elektrony (są pobierane z katody / są przekazywane na katodę) przez kationy Cu2+. Obecne w roztworze jony miedzi(II) ulegają procesowi (redukcji / utleniania), a efektem tego jest (zwiększenie / zmniejszenie) masy katody.
Zadanie 34. (2 pkt)
Przeprowadzono oddzielnie elektrolizę wodnego roztworu chlorku sodu i wodnego roztworu wodorotlenku sodu z użyciem elektrod grafitowych. W wyniku doświadczenia na elektrodach ujemnych w obu elektrolizerach otrzymano ten sam gazowy produkt. Na elektrodach dodatnich wydzielił się jeden produkt gazowy – w każdym elektrolizerze inny. Po zakończeniu elektrolizy stwierdzono, że w elektrolizerze, w którym znajdował się roztwór chlorku sodu, nastąpiła zmiana odczynu roztworu.
34.1. (0–1)
Napisz równania reakcji prowadzących do wydzielenia gazowego produktu na elektrodzie dodatniej podczas elektrolizy wodnego roztworu chlorku sodu (równanie 1.) i podczas elektrolizy wodnego roztworu wodorotlenku sodu (równanie 2.).
34.2. (0–1)
Napisz, jaki był odczyn roztworu w elektrolizerze, w którym znajdował się wodny roztwór chlorku sodu, po zakończeniu elektrolizy. Odpowiedź uzasadnij – odwołaj się do procesu zachodzącego podczas elektrolizy na elektrodzie ujemnej.
Odczyn roztworu był
Uzasadnienie:
Zadanie 35. (2 pkt)
W czasie elektrolizy stopionego tlenku glinu prowadzonej w temperaturze 2050°C i pod ciśnieniem 1013 hPa zachodzą procesy elektrodowe zilustrowane równaniami:
Al3+ + 3e− → Al
2O2− → O2 + 4e−
Podczas tego procesu wydzielił się tlen. Objętość tlenu zmierzona w warunkach prowadzenia elektrolizy była równa 43,85 dm3.
Oblicz, ile gramów glinu otrzymano w czasie elektrolizy stopionego tlenku glinu. Przyjmij, że oba procesy elektrodowe przebiegły z wydajnością równą 100%. Uniwersalna stała gazowa R = 83,1 dm3 · hPa · mol–1 ⋅ K–1.
Zadanie 36. (4 pkt)
W analizie potencjometrycznej wykorzystuje się zależność potencjału odpowiednich elektrod od stężenia jonów oznaczanych. Pomiary potencjometryczne polegają na mierzeniu SEM ogniwa zestawionego z dwóch półogniw: tzw. elektrody wskaźnikowej, zanurzonej w badanym roztworze, oraz tzw. elektrody odniesienia, zanurzonej w roztworze o niezmiennym składzie, której potencjał w warunkach pomiaru pozostaje stały.
Rozróżnia się dwa główne typy elektrod. Elektrody pierwszego rodzaju to elektrody odwracalne względem kationu: są zbudowane z metalu i są w równowadze z roztworem zawierającym jony tego metalu (M oznacza symbol metalu):
M(s) + ⇄ Mn+(aq) + 𝑛e–
Elektrody drugiego rodzaju są odwracalne względem anionu, tworzącego z metalem elektrody trudno rozpuszczalny związek. Elektrodą drugiego rodzaju jest elektroda halogenosrebrowa. Działanie tej elektrody opisuje równanie (X oznacza symbol halogenu):
AgX(s) + e– ⇄ Ag(s) + X–(aq)
Jedną z metod potencjometrycznych jest miareczkowanie potencjometryczne. Przeprowadzono miareczkowanie potencjometryczne w celu oznaczenia stężenia anionów chlorkowych i jodkowych w badanym roztworze.
Próbkę roztworu o objętości V0 = 10,00 cm3 rozcieńczono wodą do objętości 50,00 cm3. Ten rozcieńczony roztwór stanowił analit. Z elektrody srebrowej jako elektrody wskaźnikowej oraz elektrody halogenosrebrowej jako elektrody odniesienia zbudowano ogniwo, po czym zmierzono jego SEM. Następnie do analitu stopniowo wkraplano roztwór azotanu(V) srebra o stężeniu cAgNO3 = 0,05 mol ⋅ dm3. Po dodaniu każdej porcji titranta mierzono SEM ogniwa. W czasie miareczkowania wytrącały się kolejno osady halogenków srebra, czemu towarzyszyły dwie duże zmiany mierzonej siły elektromotorycznej odpowiadające dwóm punktom równoważnikowym miareczkowania.
Punkt równoważnikowy I odpowiadał momentowi, w którym liczba dodanych moli jonów Ag+ była równa liczbie moli jonów halogenkowych wytrącających się jako pierwsze. Analogicznie przebiegało oznaczenie drugiego rodzaju jonów halogenkowych i momentowi, w którym zaszła równość liczb moli, odpowiadał punkt równoważnikowy II.
Aby wyznaczyć objętość titranta w I i II punkcie równoważnikowym miareczkowania, dla każdej dodanej porcji titranta ΔVtitranta obliczono zmianę siły elektromotorycznej ogniwa ΔSEM, a następnie sporządzono wykres ΔSEMΔVtitranta jako funkcji Vtitranta.
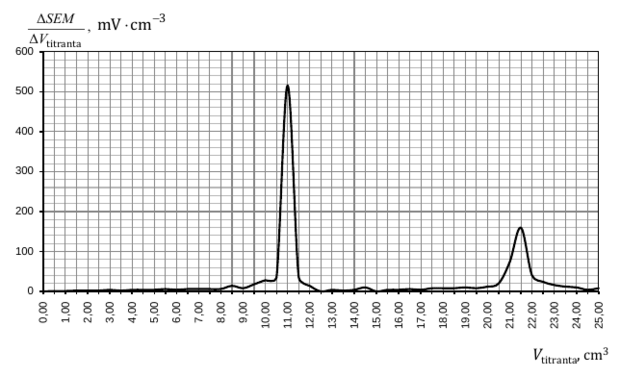
W temperaturze 298 K iloczyn rozpuszczalności chlorku srebra Kso[AgCl] = 1,6 ∙ 10−10, a jodku srebra – KSO [AgI] = 1,5 ∙ 10−16.
Oblicz stężenie molowe jonów chlorkowych w roztworze, którego próbkę o objętości V0 = 10,00 cm3 pobrano do miareczkowania.
Zadanie 37. (1 pkt)
W analizie potencjometrycznej wykorzystuje się zależność potencjału odpowiednich elektrod od stężenia jonów oznaczanych. Pomiary potencjometryczne polegają na mierzeniu SEM ogniwa zestawionego z dwóch półogniw: tzw. elektrody wskaźnikowej, zanurzonej w badanym roztworze, oraz tzw. elektrody odniesienia, zanurzonej w roztworze o niezmiennym składzie, której potencjał w warunkach pomiaru pozostaje stały.
Rozróżnia się dwa główne typy elektrod. Elektrody pierwszego rodzaju to elektrody odwracalne względem kationu: są zbudowane z metalu i są w równowadze z roztworem zawierającym jony tego metalu (M oznacza symbol metalu):
M(s) + ⇄ Mn+(aq) + 𝑛e–
Elektrody drugiego rodzaju są odwracalne względem anionu, tworzącego z metalem elektrody trudno rozpuszczalny związek. Elektrodą drugiego rodzaju jest elektroda halogenosrebrowa. Działanie tej elektrody opisuje równanie (X oznacza symbol halogenu):
AgX(s) + e– ⇄ Ag(s) + X–(aq)
Przykładem elektrody halogenosrebrowej jest elektroda chlorosrebrowa:
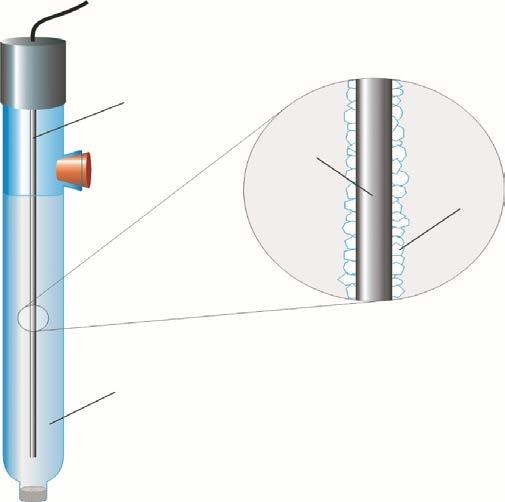
Działanie elektrody chlorosrebrowej opisuje równanie:
AgCl(s) + e− ⇄ Ag(s) + Cl− (aq)
Potencjał tej elektrody zależy od stężenia jonów chlorkowych w roztworze, który stanowi jej
element, i wyraża się równaniem: EAg/AgCl = EoAg/AgCl − 0,059log cCl− (w temperaturze 298 K).
Przygotowano dwie elektrody chlorosrebrowe: elektroda I zawierała wodny roztwór chlorku
potasu o stężeniu równym 0,10 mol ∙ dm–3, a elektroda II – wodny roztwór tej samej soli
o stężeniu równym 0,01 mol ∙ dm–3
Rozstrzygnij, która elektroda chlorosrebrowa (I czy II) ma – w tej samej temperaturze – wyższy potencjał. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 38. (1 pkt)
W analizie potencjometrycznej wykorzystuje się zależność potencjału odpowiednich elektrod od stężenia jonów oznaczanych. Pomiary potencjometryczne polegają na mierzeniu SEM ogniwa zestawionego z dwóch półogniw: tzw. elektrody wskaźnikowej, zanurzonej w badanym roztworze, oraz tzw. elektrody odniesienia, zanurzonej w roztworze o niezmiennym składzie, której potencjał w warunkach pomiaru pozostaje stały.
Rozróżnia się dwa główne typy elektrod. Elektrody pierwszego rodzaju to elektrody odwracalne względem kationu: są zbudowane z metalu i są w równowadze z roztworem zawierającym jony tego metalu (M oznacza symbol metalu):
M(s) + ⇄ Mn+(aq) + 𝑛e–
Elektrody drugiego rodzaju są odwracalne względem anionu, tworzącego z metalem elektrody trudno rozpuszczalny związek. Elektrodą drugiego rodzaju jest elektroda halogenosrebrowa. Działanie tej elektrody opisuje równanie (X oznacza symbol halogenu):
AgX(s) + e– ⇄ Ag(s) + X–(aq)
Jako elektroda odniesienia w opisanym miareczkowaniu potencjometrycznym może być zastosowana tzw. nasycona elektroda kalomelowa.
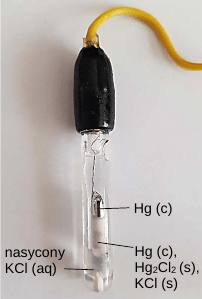
Schemat tej elektrody przedstawiono poniżej:
Hg │ Hg2Cl2 (s), KCl ( roztwór nasycony)
Zasada działania tej elektrody jest taka sama jak elektrody chlorosrebrowej.
Napisz równanie reakcji elektrodowej zachodzącej w elektrodzie kalomelowej.
Zadanie 39. (5 pkt)
Heksacyjanożelazian(II) potasu to sól zawierająca kompleksowy jon o wzorze [Fe(CN)6]4–.
Zawartość tego związku w badanej próbce można określić na podstawie jego reakcji ze znaną
ilością bromu.
Przeprowadzono doświadczenie, którego celem było określenie liczby moli
heksacyjanożelazianu(II) potasu w roztworze. Aby przygotować roztwór bromu
o znanym stężeniu, zastosowano metodę elektrolitycznego wytwarzania bromu w układzie
dwóch elektrod platynowych. W tym celu w zlewce umieszczono roztwór bromku potasu
i kwasu siarkowego(VI) o znanym stężeniu. Następnie do tego roztworu dodano próbkę
K4Fe(CN)6 o nieznanym stężeniu. W tak sporządzonym roztworze zanurzono dwie platynowe
elektrody oznaczone symbolami E1 oraz E2 i przeprowadzono elektrolizę prądem o natężeniu
0,005 A. W jej wyniku wydzielił się brom, który przereagował z K4Fe(CN)6. Wydajność obu
reakcji wynosiła 100%.
39.1. (0–1)
Napisz równania reakcji przebiegających na anodzie i na katodzie podczas opisanego procesu wytwarzania bromu.
Anoda:
Katoda:
39.2. (0–1)
Jon heksacyjanożelazianu(II) reaguje z bromem zgodnie ze schematem:
Br2 + Fe(CN)4−6 → Br− + Fe(CN)3−6
Napisz w formie jonowej skróconej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany.
Równanie reakcji redukcji:
Równanie reakcji utlenienia:
39.3. (0–1)
Czas trwania elektrolizy prowadzącej do otrzymania stechiometrycznej ilości bromu w stosunku do K4Fe(CN)6 określa się w równoległym eksperymencie – w układzie dwóch elektrod platynowych E3 oraz E4. Umieszcza się je w badanym roztworze i przykłada do nich niewielką różnicę potencjałów. Podczas eksperymentu rejestruje się natężenie prądu przepływającego w układzie pomiarowym. Na początku elektrolizy natężenie prądu wzrasta proporcjonalnie do ilości powstających jonów Fe(CN)3−6. Maksymalna wartość natężenia prądu obserwowana jest w chwili, gdy liczba moli jonów Fe(CN)3−6 jest równa liczbie moli jonów Fe(CN)4−6. Następnie natężenie prądu spada prawie do zera i osiąga minimum w momencie całkowitego przereagowania jonów Fe(CN)4−6. W dalszym etapie elektrolizy natężenie prądu przepływającego między elektrodami E3 i E4 wzrasta.
Przeanalizuj poniższe wykresy i zaznacz ten, który odpowiada opisanym zmianom natężenia prądu przepływającego w układzie elektrod oznaczonych symbolami E3 oraz E4.
39.4. (0–2)
Liczba moli elektronów wymienionych podczas elektrolizy jest określona następującym wzorem:
ne = i ∙ tF
gdzie:
i – natężenie prądu, A
t – czas trwania elektrolizy, s
F – stała Faradaya, 96500 C · mol–1.
Oblicz liczbę moli jonów [Fe(CN)6]4– w badanym roztworze. Czas potrzebny do otrzymania stechiometrycznej ilości bromu odczytaj z wykresu wybranego w zadaniu 39.3.
Zadanie 40. (3 pkt)
Wzory trzech związków organicznych oznaczono numerami I–III i zestawiono w poniższej tabeli. Te związki różnią się wartościami temperatury wrzenia.
Poniżej przedstawiono – w przypadkowej kolejności – wartości temperatury wrzenia wymienionych związków (pod ciśnieniem 1013 hPa):
Przyporządkuj każdemu związkowi charakteryzującą go temperaturę wrzenia. Uzupełnij tabelę. Podaj nazwę systematyczną związku o najwyższej temperaturze wrzenia i nazwę systematyczną związku o najniższej temperaturze wrzenia. W obu przypadkach uzasadnij swoje przyporządkowanie.
| Numer związku | I | II | III |
| Temperatura wrzenia |
Nazwa systematyczna związku o najwyższej temperaturze wrzenia:
Uzasadnienie:
Nazwa systematyczna związku o najniższej temperaturze wrzenia:
Uzasadnienie:
Zadanie 41. (2 pkt)
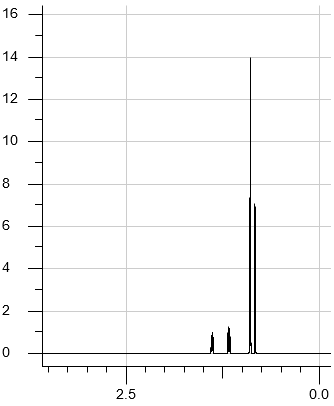
Jedną z najważniejszych metod fizykochemicznych stosowanych do badania struktury związków organicznych jest spektroskopia magnetycznego rezonansu jądrowego, NMR. Wykorzystuje się w niej właściwość polegającą na tym, że jądra atomów większości pierwiastków mają niezerowy spin. Najczęściej wykorzystuje się izotop wodoru 1H, którego jądra – czyli protony – są opisane liczbą spinową ½. Po umieszczeniu w silnym polu magnetycznym protony mogą się znajdować w dwóch stanach energetycznych – podstawowym i wzbudzonym. Aby wykonać pomiar, umieszcza się próbkę badanego związku w polu magnetycznym i wzbudza jądra 1H za pomocą fal radiowych. Powrót jąder ze stanu wzbudzonego do stanu podstawowego skutkuje wysłaniem sygnału rejestrowanego za pomocą detektora. Częstotliwość tego sygnału zależy od położenia atomów w cząsteczce. Zarejestrowane sygnały tworzą obraz zwany widmem NMR (rysunek poniżej), które dostarcza ważnych informacji o budowie cząsteczki związku.
Liczba sygnałów w widmie jest równa liczbie grup równocennych atomów wodoru w cząsteczce związku. Przykładowo – w cząsteczce octanu etylu obecne są trzy grupy równocennych atomów wodoru: dwie różne grupy –CH3 i jedna grupa –CH2–, czyli w widmie są obecne trzy sygnały. Te sygnały mogą mieć w określonych przypadkach złożony kształt, co w pokazanym widmie skutkuje ich rozszczepieniem (poszerzeniem).
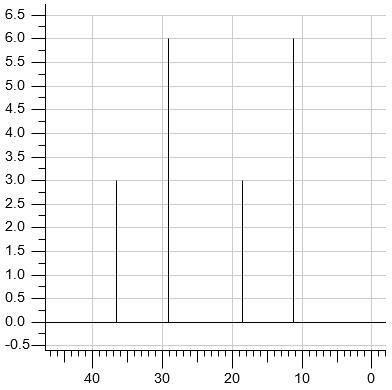
Drugim nuklidem często wykorzystywanym w pomiarach NMR jest izotop węgla 13C, którego zawartość w naturalnym węglu wynosi ok. 1%. Jego jądro ma także spin ½, w odróżnieniu od izotopu 12C, którego jądra mają spin zerowy i dlatego są nieaktywne w NMR. Widma NMR węgla 13C rejestruje się w taki sposób, że sygnały są pojedynczymi liniami.
W cząsteczce octanu etylu są cztery nierównocenne atomy węgla, w związku z czym w widmie 13C są obecne cztery sygnały.
Na podstawie analizy elementarnej ustalono wzór sumaryczny alkanu A: C5H12. Analiza widm NMR dla związku A dała następujące wyniki: w widmie 1H NMR znajduje się jeden sygnał, w widmie 13C NMR znajdują się dwa sygnały. Związek A i jego pochodne poddano przemianom, które ilustruje poniższy schemat:
A +Br2, UV A1 +NaOH, H2O A2 +CuO, T A3
Stwierdzono, że stosunek ilościowy atomów wchodzących w skład cząsteczki związku A3 wynosił NC : NH : NO = 5 : 10 : 1.
Podaj nazwę systematyczną związku A oraz wzór półstrukturalny (grupowy) związku A3 i uzupełnij tabelę: określ liczbę sygnałów w widmach 1H NMR i 13C NMR dla związku A3.
Nazwa systematyczna związku A:
Wzór półstrukturalny (grupowy) związku A3:
| Liczba sygnałów dla związku A3 | |
| w widmie 1H NMR | w widmie 13C NMR |
Zadanie 42. (2 pkt)
Jedną z najważniejszych metod fizykochemicznych stosowanych do badania struktury związków organicznych jest spektroskopia magnetycznego rezonansu jądrowego, NMR. Wykorzystuje się w niej właściwość polegającą na tym, że jądra atomów większości pierwiastków mają niezerowy spin. Najczęściej wykorzystuje się izotop wodoru 1H, którego jądra – czyli protony – są opisane liczbą spinową ½. Po umieszczeniu w silnym polu magnetycznym protony mogą się znajdować w dwóch stanach energetycznych – podstawowym i wzbudzonym. Aby wykonać pomiar, umieszcza się próbkę badanego związku w polu magnetycznym i wzbudza jądra 1H za pomocą fal radiowych. Powrót jąder ze stanu wzbudzonego do stanu podstawowego skutkuje wysłaniem sygnału rejestrowanego za pomocą detektora. Częstotliwość tego sygnału zależy od położenia atomów w cząsteczce. Zarejestrowane sygnały tworzą obraz zwany widmem NMR (rysunek poniżej), które dostarcza ważnych informacji o budowie cząsteczki związku.
Liczba sygnałów w widmie jest równa liczbie grup równocennych atomów wodoru w cząsteczce związku. Przykładowo – w cząsteczce octanu etylu obecne są trzy grupy równocennych atomów wodoru: dwie różne grupy –CH3 i jedna grupa –CH2–, czyli w widmie są obecne trzy sygnały. Te sygnały mogą mieć w określonych przypadkach złożony kształt, co w pokazanym widmie skutkuje ich rozszczepieniem (poszerzeniem).
Drugim nuklidem często wykorzystywanym w pomiarach NMR jest izotop węgla 13C, którego zawartość w naturalnym węglu wynosi ok. 1%. Jego jądro ma także spin ½, w odróżnieniu od izotopu 12C, którego jądra mają spin zerowy i dlatego są nieaktywne w NMR. Widma NMR węgla 13C rejestruje się w taki sposób, że sygnały są pojedynczymi liniami.
W cząsteczce octanu etylu są cztery nierównocenne atomy węgla, w związku z czym w widmie 13C są obecne cztery sygnały.
W produkcji benzyn wysokooktanowych wykorzystuje się procesy przemysłowe: kraking i reforming, które umożliwiają uzyskanie pożądanych, rozgałęzionych węglowodorów. Podczas rafinacji pewnej benzyny uzyskano węglowodór W, który poddano badaniu 1H NMR oraz 13C NMR, w wyniku czego uzyskano widma przedstawione niżej.
Dla węglowodoru W zaproponowano trzy wzory półstrukturalne:
Uzupełnij poniższe zdanie – wybierz i zaznacz wzór węglowodoru W. Odpowiedź uzasadnij na podstawie zamieszczonych widm 1H NMR i 13C NMR.
Węglowodorem W może być (heksan / 2,3‑dimetylobutan / 3‑metylopentan).
Uzasadnienie na podstawie widma 1H NMR:
Uzasadnienie na podstawie widma 13C NMR:
Zadanie 43. (2 pkt)
Dwa węglowodory aromatyczne – A i B – mają wzór sumaryczny C8H10. Izomer A w wyniku reakcji nitrowania tworzy wyłącznie jedną mononitropochodną. Izomer B poddany reakcji monochlorowania w obecności światła, a następnie – reakcji z wodnym roztworem KOH, tworzy alkohol drugorzędowy.
43.1. (0–1)
Napisz równanie reakcji mononitrowania związku A – zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych. Podaj nazwę systematyczną produktu mononitrowania związku A.
Równanie reakcji:
Nazwa systematyczna produktu mononitrowania związku A:
43.2. (0–1)
Uzupełnij schemat ciągu przemian prowadzonych od związku B do alkoholu. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych) albo uproszczonych.
Zadanie 44. (5 pkt)
Dehydratacja (odwodnienie) alkoholi – reakcja, w wyniku której, w obecności kwasu, z alkoholu otrzymuje się alken – przebiega według mechanizmu obejmującego trzy etapy. Początkowo (etap I) powstaje protonowana forma alkoholu, następnie zachodzą jej powolna dysocjacja (etap II) z utworzeniem karbokationu oraz szybkie odszczepienie protonu od sąsiedniego atomu węgla z utworzeniem alkenu (etap III).
Opisany proces można zilustrować schematem:
Wiązanie podwójne w alkenie powstającym podczas dehydratacji, będącym głównym produktem reakcji, znajduje się często w innym miejscu niż wynikałoby to z położenia grupy −OH w substracie. Dzieje się tak dlatego, że powstający karbokation ulega przegrupowaniu polegającemu na przeniesieniu atomu wodoru lub grupy alkilowej od sąsiedniego atomu węgla z jednoczesnym przemieszczeniem się ładunku dodatniego. Takie przegrupowanie zachodzi zawsze wtedy, gdy może ono spowodować powstanie trwalszego karbokationu, czyli takiego, w którym ładunek dodatni znajduje się na atomie węgla o możliwie najwyższej rzędowości.
44.1. (0–1)
Napisz numer tego etapu opisanego mechanizmu dehydratacji alkoholi, który decyduje o szybkości powstawania alkenu z alkoholu.
44.2. (0–1)
Spośród poniższych wzorów wybierz i podkreśl wzór najtrwalszego karbokationu.
44.3. (0–2)
W wyniku dehydratacji butan‑1‑olu – zachodzącej pod wpływem ogrzewania w obecności stężonego kwasu fosforowego – powstają trzy izomeryczne alkeny A, B i C o prostym łańcuchu węglowym. Alkeny B i C są względem siebie izomerami cis–trans.
Napisz wzory alkenów A, B i C. Zastosuj wzór półstrukturalny (grupowy) związku A. Przedstaw geometrię cząsteczek alkenów B (izomer cis) i C (izomer trans).
| alken A | alken B (izomer cis) | alken C (izomer trans) |
44.4. (0–1)
Napisz wzór półstrukturalny (grupowy) pierwszorzędowego alkoholu, którego produktem reakcji dehydratacji jest 2‑metylobut‑2‑en. Uwzględnij, że karbokation powstający z alkoholu uległ przegrupowaniu polegającemu na przeniesieniu atomu wodoru.
Zadanie 45. (1 pkt)
W dwóch probówkach A i B znajdują się oddzielnie dwa alkohole: 2‑metylopropan‑2‑ol i butan‑1‑ol. Do obu probówek dodano wodny roztwór manganianu(VII) potasu i parę kropli wodnego roztworu kwasu siarkowego(VI). Następnie zawartość probówek dokładnie wymieszano. Po pewnym czasie od wykonania doświadczeń roztwory w próbówkach wyglądały tak jak na zdjęciach poniżej:
Podaj nazwę alkoholu, który znajdował się w probówce A. Odpowiedź uzasadnij.
Nazwa alkoholu:
Uzasadnienie:
Zadanie 46. (3 pkt)
Aldehydy i ketony, których cząsteczki mają przynajmniej jeden atom wodoru związany z atomem węgla sąsiadującym z grupą karbonylową (atomem węgla α) ulegają pod wpływem katalitycznej ilości mocnej zasady reakcji aldolowej. Reakcja przebiega w taki sposób, że zasada odrywa jon H+ od atomu węgla α związku karbonylowego, a utworzony karboanion przyłącza się do atomu węgla grupy karbonylowej drugiej cząsteczki aldehydu lub ketonu. W ostatnim etapie następuje przyłączenie jonu H+ do utworzonego anionu, w wyniku czego powstaje końcowy produkt.
Zilustrowano to na poniższym schemacie reakcji, w której jako zasadę wykorzystano etanolan sodu (Et oznacza grupę etylową):
Przykładowo z dwóch cząsteczek etanalu pod wpływem roztworu etanolanu sodu w etanolu powstaje 3‑hydroksybutanal:
CH3–CHO + CH3–CHO EtONa, EtOH CH3–CHOH–CH2–CHO
W reakcji aldolowej mogą uczestniczyć zarówno cząsteczki tego samego związku karbonylowego, jak i dwóch różnych związków, z których tylko jeden musi zawierać atom wodoru związany z atomem węgla α.
Zależnie od budowy reagentów oraz warunków reakcji produkt reakcji aldolowej może ulegać eliminacji cząsteczki wody, w wyniku czego powstaje albo nienasycony aldehyd, albo keton, w którym wiązanie podwójne węgiel – węgiel sąsiaduje bezpośrednio z grupą karbonylową, np.:
CH3–CHOH–CH2–CHO → CH3–CH=CH–CHO + H2O
Taką reakcję, w której powstaje finalnie produkt eliminacji wody z utworzonego początkowo adduktu, nazywa się kondensacją aldolową.
46.1. (0–1)
W wyniku reakcji aldolowej propanonu (acetonu) z następczą eliminacją wody, czyli w wyniku kondensacji aldolowej, powstaje związek nazywany zwyczajowo tlenkiem mezytylu.
Napisz wzór półstrukturalny (grupowy) tlenku mezytylu i jego nazwę systematyczną.
Wzór tlenku mezytylu:
Nazwa systematyczna tlenku mezytylu:
46.2. (0–1)
Aldehyd cynamonowy o wzorze:
otrzymuje się w wyniku kondensacji aldolowej dwóch aldehydów A i B, z których tylko aldehyd B ma atomy wodoru związane z atomem węgla α.
Napisz wzory grupowe (półstrukturalne) aldehydów A i B.
| Wzór aldehydu A | Wzór aldehydu B |
46.3. (0–1)
Ustal, ile różnych produktów może powstać w wyniku reakcji aldolowej przeprowadzonej dla równomolowej mieszaniny etanalu i propanalu. Odpowiedź uzasadnij.
Liczba produktów reakcji:
Uzasadnienie:
Zadanie 47. (2 pkt)
Poniżej przedstawiono wzory Fischera trzech stereoizomerów kwasu winowego (2,3-dihydroksybutanodiowego).
47.1. (0–1)
Uzupełnij poniższe zdanie. Wybierz i zaznacz właściwe określenie w każdym nawiasie.
Związki I i II są (enancjomerami / diastereoizomerami), a związki II i III stanowią parę (enancjomerów / diastereoizomerów).
47.2. (0–1)
Wymienionym w tabeli właściwościom fizycznym substancji przyporządkuj wzory właściwych stereoizomerów (I i II) – wpisz ich numery. Dla stereoizomeru III wpisz w tabeli przewidywane wartości temperatury topnienia, rozpuszczalności i skręcalności właściwej.
| Numer stereoizomeru | Temperatura topnienia, °C | Rozpuszczalność, g/100 g H2O | Skręcalność właściwa |
| 170 | 139 | +12° | |
| 148 | 125 | 0 ° | |
| III |
Zadanie 48. (2 pkt)
Błękit indygo jest naturalnym barwnikiem, który w końcu XIX w. zaczęto otrzymywać syntetycznie. W jednej z opracowanych wtedy metod produkcji tego związku surowcem była pochodna glicyny, N‑(2‑karboksyfenylo)glicyna (związek I). Ten substrat w pierwszym etapie syntezy ogrzewano z NaOH, co prowadziło do zamknięcia pierścienia pięcioczłonowego.

Tę reakcję opisuje schemat:
Etap I
Otrzymaną mieszaninę zakwaszono w celu utworzenia związku II. W drugim etapie syntezy zachodziła dekarboksylacja związku II oraz pewien proces X, w którym uczestniczył tlen z powietrza. Reakcje te prowadziły do powstania indyga, zgodnie ze schematem:
Etap II
48.1. (0–1)
Napisz wzór nieorganicznego produktu ubocznego pierwszego etapu syntezy.
48.2. (0–1)
Podaj stosunek molowy tlenu O2 do związku II w reakcji zachodzącej podczas procesu X.
Zadanie 49. (4 pkt)
Agar to substancja żelująca wytwarzana z krasnorostów. W jej skład wchodzi m.in. agaroza – polisacharyd, który jest polimerem β‑D‑galaktozy i α‑3,6‑anhydro‑L‑galaktozy.
49.1. (0–1)
Wiązanie O-glikozydowe powstaje w wyniku kondensacji dwóch grup –OH należących do dwóch cząsteczek monosacharydów, przy czym przynajmniej jedna z tych grup związana była z anomerycznym (półacetalowym) atomem węgla w cząsteczce monosacharydu.
3,6-anhydrogalaktoza powstaje w wyniku kondensacji grup hydroksylowych znajdujących się przy 3. i 6. atomie węgla cząsteczki galaktozy prowadzącej do oderwania cząsteczki wody.
Na poniższym schemacie budowy fragmentu łańcucha agarozy zakreśl atomy tlenu uczestniczące w tworzeniu wiązań O‑glikozydowych. Napisz sumaryczny wzór α-3,6-anhydrogalaktozy.
Wzór sumaryczny α‑3,6‑anhydro‑L‑galaktozy:
49.2. (0–1)
Uzupełnij poniższy schemat tak, aby przedstawiał wzór β‑D‑galaktozy (β‑D‑galaktopiranozy).
49.3. (0–2)
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Agar dobrze rozpuszcza się w gorącej wodzie i tworzy (roztwór właściwy / układ koloidalny). Stygnąc, przyjmuje postać (zolu / żelu). Takie właściwości agaru są możliwe dzięki oddziaływaniu jego cząsteczek z cząsteczkami wody polegającym na tworzeniu licznych wiązań (jonowych / kowalencyjnych / wodorowych). Podobne właściwości wykazuje otrzymywana z kości i skór zwierząt rzeźnych żelatyna, która jest (białkiem / dekstryną / polisacharydem).
Zadanie 50. (2 pkt)
Poniżej przedstawiono wybrane piktogramy stosowane do oznaczania niebezpiecznych substancji i mieszanin.
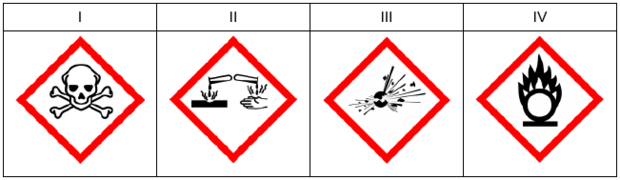
Spośród przedstawionych piktogramów wybierz dwa stosowane do opisu zagrożeń wynikających ze stosowania w laboratorium kwasu azotowego(V). Uzupełnij tabelę – w pisz oznaczenia cyfrowe wybranych piktogramów i zaznacz literę wskazującą znaczenie danego piktogramu.
| Warunki bezpieczeństwa | Piktogram | Znaczenie piktogramu: substancja |
| Pracować w rękawicach i odzieży ochronnej; stosować ochronę oczu i twarzy. | A. żrąca lub korodująca metale B. utleniająca C. wybuchowa D. toksyczna |
|
| Przechowywać z dala od odzieży i innych materiałów zapalnych. | A. żrąca lub korodująca metale B. utleniająca C. wybuchowa D. toksyczna |
Zadanie 51. (2 pkt)
Superfosfat jest nawozem sztucznym zawierającym diwodoroortofosforan(V) wapnia (Ca(H2PO4)2), siarczan(VI) wapnia (CaSO4) oraz zanieczyszczenia niezawierające wapnia i siarki. W superfosfacie zawartość procentowa siarki wynosi 11,9%, a zawartość procentowa wapnia jest równa 22,2%.
Oblicz w procentach masowych zawartość diwodoroortofosforanu(V) wapnia w superfosfacie.
Zadanie 52. (4 pkt)
Jakość gleb zależy m.in. od zawartości tzw. próchnicy, stanowiącej mieszaninę związków chemicznych pochodzących z rozkładu szczątków organicznych. Sposób określenia w przybliżeniu zawartości próchnicy w glebie polega na ilościowym utlenieniu związków organicznych, których głównym składnikiem jest węgiel.
Utlenianie węgla zawartego w związkach organicznych można przeprowadzić za pomocą dichromianu(VI) potasu, w środowisku kwasu siarkowego(VI) z dodatkiem siarczanu(VI) rtęci(II) jako katalizatora (reakcja 1.), co w uproszczeniu można zilustrować równaniem:
3C + 2K2Cr2O7 + 8H2SO4 T, … katalizator 3CO2 + 2K2SO4 + 2Cr2(SO4)3 + 8H2O
W tej metodzie stosuje się nadmiar dichromianu(VI), a następnie – w obecności wskaźnika – utleniacz dodany w nadmiarze poddaje się reakcji z jonami żelaza Fe2+ jako reduktorem (reakcja 2.).
6Fe2+ + Cr2O2−7 + 14H+ → 6Fe3+ + 2Cr3+ + 7H2O
Jest to tzw. miareczkowanie reduktometryczne, podczas którego roztwór soli żelaza(II) o znanym stężeniu znajduje się w biurecie. Ten roztwór dodaje się stopniowo do kolby z utleniaczem i na końcu dokładnie odczytuje, jaka jego objętość została zużyta w reakcji.
W celu ustalenia zawartości próchnicy pobrano próbkę gleby o masie 450 mg. Do próbki dodano roztwór dichromianu(VI) potasu o stężeniu 0,10 mol ∙ dm–3, tak aby nadmiar utleniacza stanowił 15% przy założeniu, że zawartość próchnicy w glebie jest maksymalna (tabela 1.), a średnia zawartość węgla w próchnicy wynosi 58% (w procentach masowych). Na reakcję z nadmiarem utleniacza zużyto 42,6 cm3 roztworu reduktora (jony Fe2+) o stężeniu 0,10 mol ∙ dm–3.
Tabela 1.
| Nazwa gleby | Zawartość próchnicy, procent masy |
| gleby bielicowe | 0,6–1,8 |
| gleby płowe | 1,2–2,3 |
| czarnoziemy | 2,6–4,0 |
| rędziny | 2,0–6,0 |
| mady | 1,1–4,2 |
Tabela 2.
| Zawartość próchnicy, procent masy | Interpretacja wyniku |
| < 1,0 | niska |
| 1,0–2,0 | średnia |
| 2,1–3,0 | wysoka |
| > 3,0 | bardzo wysoka |
Na podstawie obliczeń ustal zawartość próchnicy w badanej glebie. Zinterpretuj otrzymany wynik na podstawie kryteriów podanych w tabeli 2.
Zadanie 53. (1 pkt)
Jakość gleb zależy m.in. od zawartości tzw. próchnicy, stanowiącej mieszaninę związków chemicznych pochodzących z rozkładu szczątków organicznych. Sposób określenia w przybliżeniu zawartości próchnicy w glebie polega na ilościowym utlenieniu związków organicznych, których głównym składnikiem jest węgiel.
Utlenianie węgla zawartego w związkach organicznych można przeprowadzić za pomocą dichromianu(VI) potasu, w środowisku kwasu siarkowego(VI) z dodatkiem siarczanu(VI) rtęci(II) jako katalizatora (reakcja 1.), co w uproszczeniu można zilustrować równaniem:
3C + 2K2Cr2O7 + 8H2SO4 T, … katalizator 3CO2 + 2K2SO4 + 2Cr2(SO4)3 + 8H2O
W tej metodzie stosuje się nadmiar dichromianu(VI), a następnie – w obecności wskaźnika – utleniacz dodany w nadmiarze poddaje się reakcji z jonami żelaza Fe2+ jako reduktorem (reakcja 2.).
6Fe2+ + Cr2O2−7 + 14H+ → 6Fe3+ + 2Cr3+ + 7H2O
Jest to tzw. miareczkowanie reduktometryczne, podczas którego roztwór soli żelaza(II) o znanym stężeniu znajduje się w biurecie. Ten roztwór dodaje się stopniowo do kolby z utleniaczem i na końcu dokładnie odczytuje, jaka jego objętość została zużyta w reakcji.
Do przygotowania roztworu soli żelaza(II) najczęściej stosuje się tzw. sól Mohra o wzorze (NH4)2SO4·FeSO4·6H2O.
Oblicz masę próbki soli Mohra, którą trzeba odważyć, żeby w kolbie miarowej o pojemności 100 cm3 przygotować roztwór o stężeniu jonów Fe2+ równym 0,1 mol ∙ dm–3.
Zadanie 54. (3 pkt)
Jakość gleb zależy m.in. od zawartości tzw. próchnicy, stanowiącej mieszaninę związków chemicznych pochodzących z rozkładu szczątków organicznych. Sposób określenia w przybliżeniu zawartości próchnicy w glebie polega na ilościowym utlenieniu związków organicznych, których głównym składnikiem jest węgiel.
Utlenianie węgla zawartego w związkach organicznych można przeprowadzić za pomocą dichromianu(VI) potasu, w środowisku kwasu siarkowego(VI) z dodatkiem siarczanu(VI) rtęci(II) jako katalizatora (reakcja 1.), co w uproszczeniu można zilustrować równaniem:
3C + 2K2Cr2O7 + 8H2SO4 T, … katalizator 3CO2 + 2K2SO4 + 2Cr2(SO4)3 + 8H2O
W tej metodzie stosuje się nadmiar dichromianu(VI), a następnie – w obecności wskaźnika – utleniacz dodany w nadmiarze poddaje się reakcji z jonami żelaza Fe2+ jako reduktorem (reakcja 2.).
6Fe2+ + Cr2O2−7 + 14H+ → 6Fe3+ + 2Cr3+ + 7H2O
Jest to tzw. miareczkowanie reduktometryczne, podczas którego roztwór soli żelaza(II) o znanym stężeniu znajduje się w biurecie. Ten roztwór dodaje się stopniowo do kolby z utleniaczem i na końcu dokładnie odczytuje, jaka jego objętość została zużyta w reakcji.
Przed rozpoczęciem miareczkowania wprowadza się do kolby kilka kropel wodnego roztworu wskaźnika, którym jest o-fenantrolina (1,10-fenantrolina) przedstawiona wzorem 1. Sam ten wskaźnik jest bezbarwny, ale tworzy z jonami żelaza Fe2+ kompleks (wzór 2.) o intensywnej czerwonej barwie.
54.1. (0–1)
Wyjaśnij na podstawie struktury o‑fenantroliny, dlaczego może ona, podobnie jak amoniak, pełnić funkcję ligandu w jonie kompleksowym.
54.2. (0–2)
Przyporządkuj kolby z roztworami (I–III) do kolejnych etapów miareczkowania jonów dichromianowych(VI) jonami żelaza(II) w obecności o‑fenantroliny. Odpowiedź uzasadnij.
Przed rozpoczęciem miareczkowania – kolba
Uzasadnienie:
Podczas dodawania roztworu soli żelaza(II) – kolba
Uzasadnienie:
W punkcie końcowym miareczkowania – kolba
Uzasadnienie:
Zadanie 55. (1 pkt)
Poniżej przedstawiono opis jednej z najnowocześniejszych, a jednocześnie powszechnie stosowanej metody pokrywania karoserii samochodowych powłokami antykorozyjnymi lub dekoracyjnymi.
Do malowania wykorzystuje się farby tworzące z wodą układy koloidalne. Malowanie zachodzi w wyniku przepływu prądu elektrycznego. W polu elektrycznym obdarzone ładunkiem elektrycznym koloidalne cząstki farby poruszają się do elektrody, którą jest karoseria samochodu. Proces nakładania powłoki prowadzi się z zastosowaniem prądu stałego o określonym napięciu.
Zaznacz nazwę zjawiska stanowiącego podstawę opisanego procesu.
- elektroliza
- elektroforeza
- ekstrakcja
- sedymentacja
Zadanie 56. (1 pkt)
Wobec ciągle wzrastającej ilości odpadów, w których duży udział mają tworzywa sztuczne, coraz bardziej istotnym kryterium doboru i stosowania polimerów staje się ich zdolność do biodegradacji. Ten proces polega na rozkładzie makrocząsteczek pod wpływem mikroorganizmów takich jak drożdże lub bakterie. Produktami całkowitej biodegradacji są zwykle gazy, np. CO2, CH4, NH3 i para wodna.
Czynniki sprzyjające biodegradacji to niska masa cząsteczkowa polimeru, jego właściwości hydrofilowe oraz obecność grup funkcyjnych podatnych na enzymatyczną hydrolizę lub utlenianie.
Poniżej przedstawiono wzory trzech polimerów: dwa z nich powstają w wyniku procesów polimeryzacji, a jeden – w reakcji polikondensacji.
Wybierz spośród przedstawionych polimerów ten, który będzie najłatwiej ulegał biodegradacji, i napisz równanie reakcji jego otrzymywania z odpowiedniego monomeru.
Zadanie 57. (2 pkt)
W pracującym ogniwie paliwowym zasilanym bezpośrednio metanolem na elektrodach biegną reakcje chemiczne:
57.1. (0–1)
Napisz sumaryczne równanie reakcji biegnącej w opisanym ogniwie paliwowym.
57.2. (0–1)
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
W opisanym ogniwie paliwowym na katodzie biegnie reakcja (1 / 2), a na anodzie biegnie reakcja (1 / 2). W sumarycznym procesie bierze udział (4 / 6 / 12) moli elektronów w przeliczeniu na 1 mol reduktora.
Zadanie 58. (2 pkt)
W pracującym ogniwie paliwowym zasilanym bezpośrednio metanolem na elektrodach biegną reakcje chemiczne:
Oblicz efekt cieplny sumarycznego procesu przebiegającego w opisanym ogniwie paliwowym w przeliczeniu na 1 mol metanolu. Przyjmij, że w warunkach pracy ogniwa:
ΔHtw.(CH3OH (g)) = – 201,0 kJ∙mol–1,
ΔHtw.(H2O (c)) = – 285,8 kJ∙mol–1,
ΔHtw.(CO2 (g)) = – 393,5 kJ∙mol–1.
Zadanie 59. (4 pkt)
Równanie kinetyczne wyznacza się doświadczalnie. W tym celu dokonuje się wielokrotnego pomiaru szybkości reakcji przy zmianie stężenia tylko jednego z reagentów. Takie postępowanie pozwala określić, jak zmiana stężenia wpływa na wartość szybkości reakcji. Przeprowadzono trzy doświadczenia, w których określono początkową szybkość reakcji przebiegającej w temperaturze T według równania:
S2O2−8 (aq) + 3I− (aq) → 2SO2−4 (aq) + I−3 (aq)
Równanie kinetyczne przedstawionego procesu ma postać:
𝑣 = 𝑘 ∙ c 𝑚S2O2−8 ∙ c𝑛I−
Wartości stężenia jonów S2O2−8 i I− oraz uzyskane wartości początkowej szybkości zaniku jonów S2O2−8 podano w poniższej tabeli. Przedstawione dane pozwoliły określić współczynniki 𝑚 i 𝑛 w równaniu kinetycznym tej reakcji.
| Doświadczenie | Początkowe stężenie, mol · dm−3 | Początkowa szybkość, mol · dm−3 ∙ s−1 |
|
|---|---|---|---|
| S2O2−8 | I− | ||
| 1. | 0,15 | 0,21 | 1,14 |
| 2. | 0,22 | 0,21 | 1,70 |
| 3. | 0,22 | 0,12 | 0,98 |
Oblicz szybkość reakcji (wyrażoną w jednostce: mol · dm−3 · s−1) w doświadczeniu 1. w chwili, gdy w wyniku zachodzącej reakcji stężenie jonów S2O2−8 obniży się do wartości 0,10 mol · dm−3.
Zadanie 60. (4 pkt)
Próbkę pewnego związku organicznego A o masie 4,4 g spalono w tlenie i otrzymano wyłącznie 8,8 g tlenku węgla(IV) oraz 3,6 g wody. Stwierdzono, że:
- łańcuch węglowy cząsteczki tego związku jest nierozgałęziony
- ten związek w roztworze wodnym dysocjuje z odszczepieniem jonu wodorowego
- całkowite spalenie 0,05 mol tego związku wymaga użycia 0,25 mol tlenu.
Ustalono także, że związki umownie oznaczone literami X i Y są izomerami związku organicznego A. Związek X jest kwasem karboksylowym. Cząsteczki związku Y o nierozgałęzionym łańcuchu węglowym nie są chiralne, a wynik reakcji tego związku z odczynnikiem Trommera przedstawiono na zdjęciu. Związek Y może brać udział w reakcjach estryfikacji.

Napisz wzór półstrukturalny (grupowy) opisanego związku organicznego A oraz wzory półstrukturalne (grupowe) związków X i Y.
Wzór związku organicznego A:
| Wzór związku X | Wzór związku Y |
|---|---|