Chemia - Informator CKE, Poziom rozszerzony (Formuła 2023) - Zadanie 38.
W analizie potencjometrycznej wykorzystuje się zależność potencjału odpowiednich elektrod od stężenia jonów oznaczanych. Pomiary potencjometryczne polegają na mierzeniu SEM ogniwa zestawionego z dwóch półogniw: tzw. elektrody wskaźnikowej, zanurzonej w badanym roztworze, oraz tzw. elektrody odniesienia, zanurzonej w roztworze o niezmiennym składzie, której potencjał w warunkach pomiaru pozostaje stały.
Rozróżnia się dwa główne typy elektrod. Elektrody pierwszego rodzaju to elektrody odwracalne względem kationu: są zbudowane z metalu i są w równowadze z roztworem zawierającym jony tego metalu (M oznacza symbol metalu):
M(s) + ⇄ Mn+(aq) + 𝑛e–
Elektrody drugiego rodzaju są odwracalne względem anionu, tworzącego z metalem elektrody trudno rozpuszczalny związek. Elektrodą drugiego rodzaju jest elektroda halogenosrebrowa. Działanie tej elektrody opisuje równanie (X oznacza symbol halogenu):
AgX(s) + e– ⇄ Ag(s) + X–(aq)
Jako elektroda odniesienia w opisanym miareczkowaniu potencjometrycznym może być zastosowana tzw. nasycona elektroda kalomelowa.
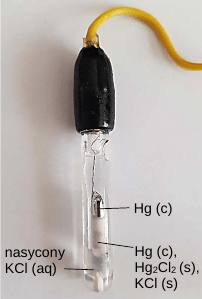
Schemat tej elektrody przedstawiono poniżej:
Hg │ Hg2Cl2 (s), KCl ( roztwór nasycony)
Zasada działania tej elektrody jest taka sama jak elektrody chlorosrebrowej.
Napisz równanie reakcji elektrodowej zachodzącej w elektrodzie kalomelowej.
Rozwiązanie
Zasady oceniania
1 pkt – poprawne napisanie równania reakcji elektrodowej zachodzącej w elektrodzie
kalomelowej.
0 pkt – odpowiedź niespełniająca powyższego kryterium albo brak odpowiedzi.
Rozwiązanie
Hg2Cl2 (s) + 2e− ⇄ 2Hg(c) + 2Cl− (aq)
ALBO
Hg2Cl2 + 2e− ⇄ 2Hg + 2Cl−
