Chemia - Informator CKE, Poziom rozszerzony (Formuła 2023) - Zadanie 6.
Atom siarki tworzy z atomami fluoru m.in. cząsteczki o wzorze SF2 i SF6.
6.1. (0–1)
Narysuj wzór elektronowy cząsteczki SF2 – zaznacz kreskami wspólne pary elektronowe oraz wolne pary elektronowe atomów siarki i fluoru. Określ kształt cząsteczki (liniowa, kątowa, tetraedryczna).
Wzór elektronowy:
Kształt cząsteczki:
6.2. (0–1)
Poniżej zamieszczono model ilustrujący kształt cząsteczki SF6.
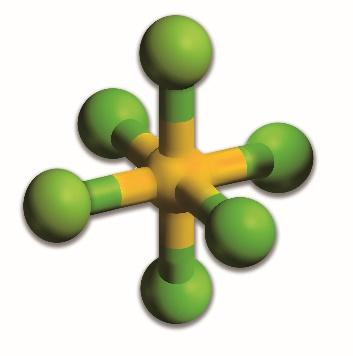
Wykaż na podstawie teorii VSEPR (odpychanie par elektronowych powłoki walencyjnej), że przedstawiony model jest poprawną ilustracją kształtu cząsteczki SF6.
Rozwiązanie
6.1. (0–1)
Zasady oceniania
1 pkt – poprawne narysowanie wzoru elektronowego cząsteczki.
0 pkt – odpowiedź niespełniająca powyższego kryterium albo brak odpowiedzi.
Rozwiązanie
Wzór elektronowy:
Kształt cząsteczki: kątowa ALBO V‑kształtna
6.2. (0–1)
Zasady oceniania
1 pkt – poprawne określenie kształtu cząsteczki metodą VSEPR.
0 pkt – odpowiedź niespełniająca powyższego kryterium albo brak odpowiedzi.
Rozwiązanie
Liczba elektronów walencyjnych w cząsteczce SF6: Lew = 48
Liczba atomów wodoru: LH = 0
Liczba atomów fluoru: LF = 6
Liczba wolnych par elektronowych: Lw = 48 − 6 ∙ 82 = 0,
więc liczba przestrzenna Lp = 0 + 6 = 6
