Chemia - Matura Czerwiec 2018, Poziom rozszerzony (Formuła 2007) - Zadanie 6.
Poniżej przedstawiono wykres rozpuszczalności w wodzie dwóch soli KI i KNO3 w zależności od temperatury.
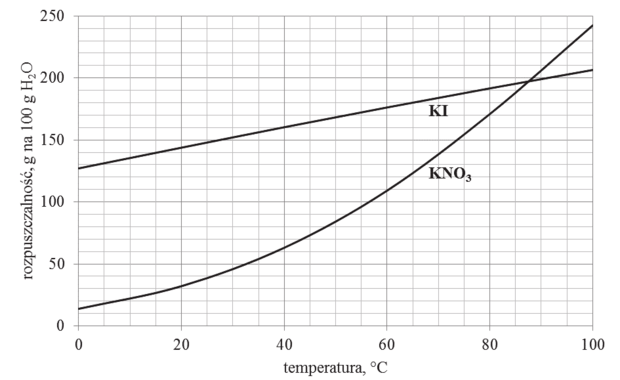
6.1. (1 pkt)
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeżeli jest fałszywa.
| 1. | Po wprowadzeniu 100 g azotanu(V) potasu do 100 g wody i po ogrzaniu mieszaniny do temperatury 40°C, na dnie zlewki pozostaje około 38 g substancji stałej. | P | F |
| 2. | Po ochłodzeniu do temperatury 20°C nasyconych w temperaturze 60°C roztworów obu soli otrzymano w zlewce z roztworem jodku potasu roztwór nasycony, a zlewce z roztworem azotanu(V) potasu – roztwór nienasycony. | P | F |
| 3. | W temperaturze około 87,5°C stężenie molowe nasyconego roztworu jodku potasu jest takie samo jak stężenie molowe nasyconego roztworu azotanu(V) potasu. | P | F |
6.2. (2 pkt)
Do 150 g roztworu jodku potasu nasyconego w temperaturze 15°C dodano 100 g tej soli i zawartość zlewki ogrzano do temperatury 65°C.
Oblicz, o ile procent wzrośnie masa roztworu w zlewce.
Rozwiązanie
6.1. (1 pkt)
Schemat punktowania
1 p. – za poprawne wskazanie trzech odpowiedzi.
0 p. – za odpowiedź niepełną lub błędną albo brak odpowiedzi.
Poprawna odpowiedź
1. P; 2. F; 3. F
6.2. (2 pkt)
Schemat punktowania
2 p. – za zastosowanie poprawnej metody, poprawne wykonanie obliczeń i podanie wyniku
w procentach.
1 p. – za zastosowanie poprawnej metody, ale:
– popełnienie błędów rachunkowych prowadzących do błędnego wyniku liczbowego
lub
– niepodanie wyniku w procentach.
0 p. – za zastosowanie błędnej metody obliczenia albo brak rozwiązania.
Uwaga: Należy zwrócić uwagę na zależność wartości wyniku końcowego od ewentualnych wcześniejszych zaokrągleń.
Przykładowe rozwiązanie
Rozpuszczalność KI w temperaturze 15°C wynosi 140 g KI na 100 g H2O, skład roztworu w tej
temperaturze jest następujący:
150 g roztworu
⸺
x
⇒
m (KI w roztworze) = x = 87,5 g
m (H2O) = 150 g – 87,5 g = 62,5 g
Po dodaniu do roztworu stałego jodku potasu oraz podgrzaniu roztworu zmienia się masa roztworu (i masa rozpuszczonej soli), nie zmienia się masa wody.
Łączna masa KI w zlewce: 87,5 g + 100 g = 187,5 g
Rozpuszczalność KI w temperaturze 65°C wynosi 180 g KI na 100 g H2O:
y g KI
⸺
62,5 g H2O
m (KI w roztworze) = y = 112,5 g (< 187,5 g)
Po dosypaniu soli oraz ogrzaniu roztworu rozpuściło się dodatkowo: 112,5 g – 87,5 g = 25 g KI, o tyle też wzrośnie masa roztworu w zlewce.
25 g roztworu
⸺
z
⇒ z = 16,7 (%)
