Chemia - Informator CKE, Poziom rozszerzony (Formuła 2023) - Zadanie 14.
Termograwimetria to technika badania związków chemicznych pozwalająca m.in. na rejestrację zmian masy próbki w trakcie jej rozkładu termicznego. Wynikiem takiego badania jest krzywa zwana termogramem, ilustrująca zmianę masy próbki w funkcji wzrastającej ze stałą szybkością temperatury.
Próbkę zawierającą 3∙10–4 mola uwodnionego węglanu kobaltu(II), CoCO3∙xH2O, ogrzewano w atmosferze argonu. Rejestrowano zmiany masy próbki wraz z rosnącą temperaturą w przedziale od 0°C do 550°C. Badanie prowadzono do chwili, w której masa próbki nie ulegała już dalszym zmianom. Stwierdzono, że rozkład termiczny zachodzi w dwóch etapach. Analiza gazowych produktów rozkładu powstających w trakcie eksperymentu w obu etapach wykazała, że w każdym z nich wydziela się tylko jeden rodzaj gazu, w każdym z etapów – inny. Uzyskany termogram przedstawiono na schemacie.
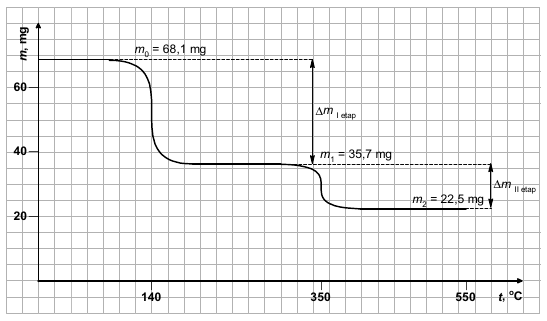
Na podstawie obliczeń ustal przebieg rozkładu hydratu węglanu kobaltu(II) – napisz równania reakcji przebiegających w I i II etapie rozkładu.
Równanie reakcji rozkładu w I etapie:
Równanie reakcji rozkładu w II etapie:
Rozwiązanie
Zasady oceniania
3 pkt – zastosowanie poprawnej metody, poprawne wykonanie obliczeń oraz podanie dwóch
równań reakcji rozkładu.
2 pkt – zastosowanie poprawnej metody i poprawne wykonanie obliczeń oraz błędne
napisanie równań reakcji lub brak równań reakcji rozkładu.
ALBO
– zastosowanie poprawnej metody, ale popełnienie błędów rachunkowych, które
umożliwiają podanie równań reakcji, przy czym w pierwszym etapie równanie
przedstawia proces odwodnienia hydratu, a w drugim – rozkład węglanu.
1 pkt – zastosowanie poprawnej metody, ale popełnienie błędów rachunkowych oraz błędne
napisanie równań reakcji lub brak równań reakcji rozkładu.
0 pkt – zastosowanie błędnej metody albo brak rozwiązania.
Rozwiązanie
Obliczenie masy molowej hydratu, CoCO3∙xH2O:
1 mol
⸺
M
M = 227 g
M(CoCO3) = 119 g ∙ mol−1, zatem: x = 6.
1 mol
⸺
18∙103 mg H2O
x = 32,4 mg H2O – co odpowiada ΔmI
y
⸺
44∙103 mg CO2
y = 13,2 mg CO2 – w co odpowiada ΔmII
Równanie reakcji rozkładu w I etapie: CoCO3∙6H2O → CoCO3 + 6H2O
Równanie reakcji rozkładu w II etapie: CoCO3 → CoO + CO2
