Chemia - Matura Czerwiec 2018, Poziom rozszerzony (Formuła 2007) - Zadanie 11.
W oddzielnych naczyniach umieszczono po 100 cm3 wodnych roztworów kwasów jednoprotonowych o wzorach HA i HB i stężeniach 0,1 mol · dm–3. Do każdego naczynia dodawano porcjami wodny roztwór wodorotlenku sodu o stężeniu 0,1 mol · dm–3. Za pomocą pehametru mierzono pH każdej mieszaniny reakcyjnej. Wyniki pomiarów przedstawiono na wykresie.
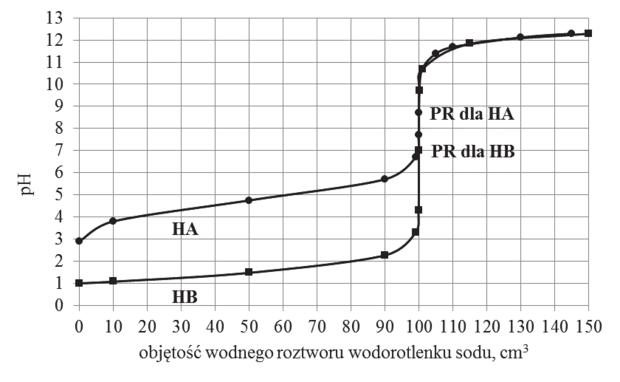
Dla każdego z kwasów zaznaczono punkt równoważnikowy (PR), czyli wartość pH roztworu otrzymanego po zmieszaniu roztworów zawierających stechiometryczne ilości kwasu i wodorotlenku sodu.
11.1. (1 pkt)
Uzupełnij poniższe zdania – wybierz i podkreśl jedno właściwe określenie spośród podanych w każdym nawiasie.
- Różna wartość pH wyjściowych roztworów wynika z tego, że użyto elektrolitów o różnej mocy. Kwas HA użyty w doświadczaniu to (mocny / słaby) elektrolit, a kwasem HB może być kwas (solny / octowy).
- Wartość pH w punkcie równoważnikowym dla kwasu HB wynosi 7, co oznacza, że po dodaniu do roztworu tego kwasu stechiometrycznej ilości wodnego roztworu wodorotlenku sodu stężenie kationów wodorowych i stężenie anionów wodorotlenkowych w roztworze są (jednakowe / różne). Wartość stężenia jonów wodorotlenkowych w tym roztworze jest równa (1 · 10–14 / 1 · 10–7).
11.2. (1 pkt)
Wartość pH w punkcie równoważnikowym dla kwasu HA wynosi 8,70.
Napisz w formie jonowej skróconej równanie reakcji, która powoduje, że roztwór w punkcie równoważnikowym nie ma odczynu obojętnego. Zastosuj wzór ogólny kwasu HA.
Rozwiązanie
11.1. (1 pkt)
Schemat punktowania
1 p. – za poprawne uzupełnienie dwóch akapitów.
0 p. – za odpowiedź niepełną lub błędną albo brak odpowiedzi.
Poprawna odpowiedź
- Różna wartość pH wyjściowych roztworów wynika z tego, że użyto elektrolitów o różnej mocy. Kwas HA użyty w doświadczaniu to (mocny / słaby) elektrolit, a kwasem HB może być kwas (solny / octowy).
- Wartość pH w punkcie równoważnikowym dla kwasu HB wynosi 7, co oznacza, że po dodaniu do roztworu tego kwasu stechiometrycznej ilości wodnego roztworu wodorotlenku sodu stężenie kationów wodorowych i stężenie anionów wodorotlenkowych w roztworze są (jednakowe / różne). Wartość stężenia jonów wodorotlenkowych w tym roztworze jest równa (1 · 10–14 / 1 · 10–7).
11.2. (1 pkt)
Schemat punktowania
1 p. – za poprawne napisanie równania reakcji hydrolizy.
0 p. – za błędne napisanie równania reakcji (błędne wzory reagentów, błędne współczynniki stechiometryczne, niewłaściwa forma zapisu) albo brak odpowiedzi.
Poprawna odpowiedź
A– + H2O ⇄ HA + OH–
Uwaga: Należy uznać za poprawne równanie reakcji, w którym zdający napisze poprawnie równanie hydrolizy anionu octanowego.
