Chemia - Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 122.
Przeprowadzono doświadczenie zilustrowane rysunkiem:
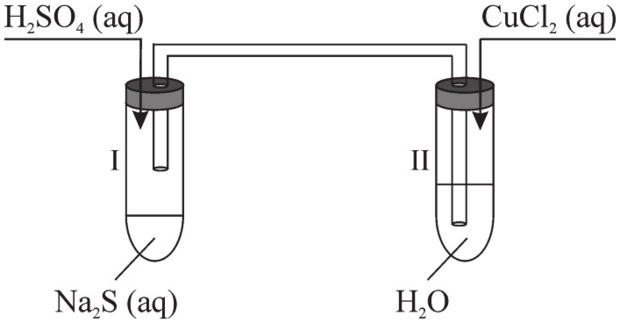
122.1 (0-1)
Napisz w formie cząsteczkowej równanie reakcji zachodzącej w probówce I.
122.2 (0-1)
Napisz, co zaobserwowano podczas doświadczenia w probówce II. Odpowiedź uzasadnij, pisząc w formie jonowej skróconej równanie reakcji, która zaszła w tej probówce.
Rozwiązanie
122.1 (0-1)
Na2S + H2SO4 → H2S + Na2SO4
122.2 (0-1)
Wytrącił się (czarny) osad.
Cu2+ + H2S → CuS + 2H+
Wskazówki
122.1 (0-1)
Kwas siarkowy(VI) wypiera siarkowodór z jego soli, czyli siarczków, dlatego w probówce I
powstaje gazowy siarkowodór, a w roztworze pozostają jony Na+ i SO2−4, które
po odparowaniu wody dają siarczan(VI) sodu. Substratami tej reakcji (w ujęciu niejonowym)
są więc kwas siarkowy(VI) i siarczek sodu, a produktami – siarkowodór i siarczan(VI) sodu:
Na2S + H2SO4 → H2S + Na2SO4.
122.2 (0-1)
Powstały w probówce I siarkowodór jest gazem, który rurką przedostaje się do probówki II.
Reagując z jonami miedzi(II), powoduje wytrącenie nierozpuszczalnego w wodzie siarczku
miedzi(II). Fakt, że chlorek miedzi(II) jest rozpuszczalny, a siarczek miedzi(II) nie
rozpuszcza się w wodzie, odczytujemy z tablicy rozpuszczalności, która jest zamieszczona
w zestawie Wybranych wzorów i stałych fizykochemicznych na egzamin maturalny z biologii,
chemii i fizyki. Możemy zatem ustalić, że w probówce II do roztworu, w którym obecne są
jony miedzi(II) zostaje wprowadzony siarkowodór, co prowadzi do powstania
nierozpuszczalnego siarczku miedzi(II):
Cu2+ + H2S → CuS + 2H+.
Siarczek ten tworzy
czarny osad, ale podanie barwy osadu nie jest konieczne.
