Chemia - Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015)
Zadanie 1. (1 pkt)
Pierwszym skutecznym lekiem przeciw malarii była chinina, organiczny związek chemiczny o masie cząsteczkowej 324 u , który składa się z 74,07% masowych węgla, 7,41% masowych wodoru, 8,64% masowych azotu i 9,88% masowych tlenu. W temperaturze pokojowej chinina jest trudno rozpuszczalną w wodzie, białą, krystaliczną substancją o intensywnie gorzkim smaku. Związek ten rozpuszczalny jest m.in. w olejach, benzynie, etanolu i glicerynie. Ze względu na swój gorzki smak chinina znalazła zastosowanie w przemyśle spożywczym jako aromat. Dodawana jest do produktów spożywczych w postaci chlorowodorku chininy, soli dobrze rozpuszczalnej w wodzie. W Polsce za maksymalną dopuszczalną zawartość chlorowodorku chininy w napojach bezalkoholowych typu tonik (których podstawą jest woda) przyjęto 7,50 mg na każde 100 cm3 napoju, co w przeliczeniu na czystą chininę oznacza, że 100 cm3 tego napoju dostarcza konsumentowi 6,74 mg chininy.
Na podstawie odpowiednich obliczeń ustal wzór empiryczny oraz rzeczywisty chininy
(patrz → informacja do zadania powyżej).
Zadanie 2. (1 pkt)
Pierwszym skutecznym lekiem przeciw malarii była chinina, organiczny związek chemiczny o masie cząsteczkowej 324 u , który składa się z 74,07% masowych węgla, 7,41% masowych wodoru, 8,64% masowych azotu i 9,88% masowych tlenu. W temperaturze pokojowej chinina jest trudno rozpuszczalną w wodzie, białą, krystaliczną substancją o intensywnie gorzkim smaku. Związek ten rozpuszczalny jest m.in. w olejach, benzynie, etanolu i glicerynie. Ze względu na swój gorzki smak chinina znalazła zastosowanie w przemyśle spożywczym jako aromat. Dodawana jest do produktów spożywczych w postaci chlorowodorku chininy, soli dobrze rozpuszczalnej w wodzie. W Polsce za maksymalną dopuszczalną zawartość chlorowodorku chininy w napojach bezalkoholowych typu tonik (których podstawą jest woda) przyjęto 7,50 mg na każde 100 cm3 napoju, co w przeliczeniu na czystą chininę oznacza, że 100 cm3 tego napoju dostarcza konsumentowi 6,74 mg chininy.
Oblicz masę cząsteczki chininy w gramach
(patrz → informacja do zadania powyżej).
Zadanie 3. (1 pkt)
Pierwszym skutecznym lekiem przeciw malarii była chinina, organiczny związek chemiczny o masie cząsteczkowej 324 u , który składa się z 74,07% masowych węgla, 7,41% masowych wodoru, 8,64% masowych azotu i 9,88% masowych tlenu. W temperaturze pokojowej chinina jest trudno rozpuszczalną w wodzie, białą, krystaliczną substancją o intensywnie gorzkim smaku. Związek ten rozpuszczalny jest m.in. w olejach, benzynie, etanolu i glicerynie. Ze względu na swój gorzki smak chinina znalazła zastosowanie w przemyśle spożywczym jako aromat. Dodawana jest do produktów spożywczych w postaci chlorowodorku chininy, soli dobrze rozpuszczalnej w wodzie. W Polsce za maksymalną dopuszczalną zawartość chlorowodorku chininy w napojach bezalkoholowych typu tonik (których podstawą jest woda) przyjęto 7,50 mg na każde 100 cm3 napoju, co w przeliczeniu na czystą chininę oznacza, że 100 cm3 tego napoju dostarcza konsumentowi 6,74 mg chininy.
W pewnym napoju typu tonik wykryto maksymalną dopuszczalną zawartość chlorowodorku chininy.
Podkreśl poprawne dokończenie zdania
(patrz → informacja do zadania powyżej).
Masa cząsteczkowa chlorowodorku chininy jest większa od masy cząsteczkowej chininy o
- 35,5 u.
- 71 u.
- 36,5 u.
- 73 u.
Zadanie 4. (1 pkt)
Pierwszym skutecznym lekiem przeciw malarii była chinina, organiczny związek chemiczny o masie cząsteczkowej 324 u , który składa się z 74,07% masowych węgla, 7,41% masowych wodoru, 8,64% masowych azotu i 9,88% masowych tlenu. W temperaturze pokojowej chinina jest trudno rozpuszczalną w wodzie, białą, krystaliczną substancją o intensywnie gorzkim smaku. Związek ten rozpuszczalny jest m.in. w olejach, benzynie, etanolu i glicerynie. Ze względu na swój gorzki smak chinina znalazła zastosowanie w przemyśle spożywczym jako aromat. Dodawana jest do produktów spożywczych w postaci chlorowodorku chininy, soli dobrze rozpuszczalnej w wodzie. W Polsce za maksymalną dopuszczalną zawartość chlorowodorku chininy w napojach bezalkoholowych typu tonik (których podstawą jest woda) przyjęto 7,50 mg na każde 100 cm3 napoju, co w przeliczeniu na czystą chininę oznacza, że 100 cm3 tego napoju dostarcza konsumentowi 6,74 mg chininy.
Wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeśli jest fałszywe
(patrz → informacja do zadania powyżej.).
| Zdanie | P/F | |
|---|---|---|
| 1. | W temperaturze pokojowej chinina jest białą krystaliczną substancją o gorzkim smaku, rozpuszczalną w etanolu. | |
| 2. | W celu uzyskania gorzkiego smaku napojów, których podstawą jest woda, dodawany jest do nich chlorowodorek chininy, ponieważ sól ta, w przeciwieństwie do chininy, jest dobrze rozpuszczalna w wodzie. | |
| 3. | W 250 cm3 napoju typu tonik maksymalnie może być zawarte 18,75 mg chininy. |
Zadanie 5. (2 pkt)
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g) Δ H = –92,4 kJ
Oblicz, ile metrów sześciennych azotu odmierzonego w warunkach normalnych i ile kilogramów wodoru należy użyć do otrzymania 30,6 kg amoniaku, jeżeli reakcja syntezy amoniaku przebiega z wydajnością równą 30%.
Zadanie 6. (1 pkt)
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g) Δ H = –92,4 kJ
Początkowe stężenia substratów reakcji były równe cN2 = 2 mol · dm−3 , cH2 = 6 mol · dm−3 i przebiegała ona w reaktorze o objętości 1 dm3 w stałej temperaturze T.
Oblicz stężenia H2, N2 i NH3 po osiągnięciu stanu równowagi w temperaturze T, jeżeli ustalił się on po przereagowaniu 30% początkowej ilości wodoru.
Zadanie 7. (1 pkt)
Blaszkę miedzianą o masie 0,48 g roztworzono całkowicie w stężonym wodnym roztworze kwasu azotowego(V). Doświadczenie wykonano pod wyciągiem. Przebieg reakcji miedzi z kwasem azotowym(V) ilustruje poniższe równanie.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2 H2O
Oblicz, ile centymetrów sześciennych (w przeliczeniu na warunki normalne) gazu wydzieliło się w czasie opisanej reakcji.
Zadanie 8. (3 pkt)
Wzory soli można w sposób uproszczony przedstawić w postaci tlenkowej, na przykład wzór
CaCO3 można przedstawić jako CaO · CO2.
Superfosfat podwójny jest nawozem, którego głównym składnikiem jest diwodorofosforan(V)
wapnia o wzorze Ca(H2PO4)2, stosowanym do wzbogacania gleby w fosfor.
| a) | Zapisz wzór diwodorofosforanu wapnia w postaci wzoru tlenkowego. |
| b) | Oblicz w procentach masowych zawartość P2O5 w tym związku chemicznym. |
| c) | Dokończ zdanie, zaznaczając wniosek A lub B i jego uzasadnienie 1. lub 2. |
Jako nawozu fosforowego używa się diwodorofosforanu(V) wapnia, a nie fosforanu(V) wapnia, ponieważ diwodorofosforan(V) wapnia
| A. | jest | rozpuszczalny w wodzie i zawiera | 1. | mniejszy procent masowy P2O5. |
| B. | nie jest | 2. | większy procent masowy P2O5. |
Zadanie 9. (1 pkt)
Jedną z laboratoryjnych metod otrzymywania tlenu jest termiczny rozkład chloranu(V) potasu przebiegający zgodnie z równaniem:
2KClO3 → 2KCl + 3O2
Oblicz objętość tlenu, w przeliczeniu na warunki normalne, powstałego z rozkładu 30,6 g chloranu(V) potasu, który zawierał 10% masowych zanieczyszczeń. Przyjmij, że wydajność reakcji była równa 80%.
Zadanie 10. (2 pkt)
Blaszkę z glinu o masie 10,80 g o odpowiednio przygotowanej powierzchni zanurzono w wodnym roztworze Cu(NO3)2, utrzymując odpowiednie pH tego roztworu. Po pewnym czasie stwierdzono, że powierzchnia blaszki znajdująca się w roztworze pokryła się różowym nalotem o metalicznym połysku, a barwa roztworu stała się mniej intensywna, turkusowa, ale roztwór pozostał klarowny i nie stwierdzono w nim wytrącenia żadnego osadu. Następnie blaszkę wyjęto z roztworu, osuszono i ponownie zważono. Jej masa wyniosła 12,17 g. Zaobserwowane zmiany pozwoliły stwierdzić, że w czasie doświadczenia zachodziła reakcja chemiczna, której przebieg opisuje równanie:
3Cu2+ + 2Al → 3Cu + 2Al3+
Oblicz, ile gramów miedzi wydzieliło się w czasie opisanego doświadczenia.
Zadanie 11. (1 pkt)
Dimetyloglioksym jest związkiem organicznym o następującym wzorze:
Związek ten jest wykorzystywany w analizie chemicznej między innymi do wykrywania i określania ilości jonów niklu(II), z którymi tworzy trudno rozpuszczalny w wodzie osad dimetyloglioksymianu niklu(II) o różowym zabarwieniu. Reakcja ta przebiega zgodnie z równaniem:
Napisz wzór sumaryczny dimetyloglioksymu.
Zadanie 12. (1 pkt)
Dimetyloglioksym jest związkiem organicznym o następującym wzorze:
Związek ten jest wykorzystywany w analizie chemicznej między innymi do wykrywania i określania ilości jonów niklu(II), z którymi tworzy trudno rozpuszczalny w wodzie osad dimetyloglioksymianu niklu(II) o różowym zabarwieniu. Reakcja ta przebiega zgodnie z równaniem:
Uzupełnij tabelę. Określ liczbę wiązań typu σ i typu π w cząsteczce dimetyloglioksymu oraz liczbę wolnych par elektronowych przy atomach tworzących tę cząsteczkę.
| Liczba wiązań typu σ | Liczba wiązań typu π | Liczba wolnych par elektronowych |
Zadanie 13. (1 pkt)
Dimetyloglioksym jest związkiem organicznym o następującym wzorze:
Związek ten jest wykorzystywany w analizie chemicznej między innymi do wykrywania i określania ilości jonów niklu(II), z którymi tworzy trudno rozpuszczalny w wodzie osad dimetyloglioksymianu niklu(II) o różowym zabarwieniu. Reakcja ta przebiega zgodnie z równaniem:
Uzupełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeżeli jest fałszywe.
| Zadanie | P/F | |
|---|---|---|
| 1. | Dla wszystkich atomów węgla w cząsteczce dimetyloglioksymu należy przyjąć hybrydyzację typu sp2. | |
| 2. | We wzorze dimetyloglioksymianu niklu(II) strzałkami zaznaczono wiązania koordynacyjne, a kropkami wiązania wodorowe. | |
| 3. | W reakcji wytrącania dimetyloglioksymianu niklu(II) dimetyloglioksym jest kwasem Brønsteda, ponieważ jest dawcą protonów. |
Zadanie 14. (1 pkt)
Dimetyloglioksym jest związkiem organicznym o następującym wzorze:
Związek ten jest wykorzystywany w analizie chemicznej między innymi do wykrywania i określania ilości jonów niklu(II), z którymi tworzy trudno rozpuszczalny w wodzie osad dimetyloglioksymianu niklu(II) o różowym zabarwieniu. Reakcja ta przebiega zgodnie z równaniem:
Napisz konfigurację elektronową atomu niklu w stanie podstawowym, uwzględniając rozmieszczenie elektronów na podpowłokach, i przedstaw schemat klatkowy rozmieszczenia elektronów walencyjnych atomu tego pierwiastka chemicznego.
Zadanie 15. (3 pkt)
Dimetyloglioksym jest związkiem organicznym o następującym wzorze:
Związek ten jest wykorzystywany w analizie chemicznej między innymi do wykrywania i określania ilości jonów niklu(II), z którymi tworzy trudno rozpuszczalny w wodzie osad dimetyloglioksymianu niklu(II) o różowym zabarwieniu. Reakcja ta przebiega zgodnie z równaniem:
Aby wyznaczyć masę niklu w postaci jonów Ni2+ w próbce pewnego roztworu o objętości 100,00 cm3, z próbki tej pobrano trzy równe porcje oznaczone numerami I–III o objętości 10,00 cm3 każda. Pobranie do analizy trzech, a nie jednej porcji badanego roztworu miało na celu zmniejszenie wpływu na wynik analizy błędów przypadkowych. Każdą porcję poddano niezależnie takim samym czynnościom laboratoryjnym, uzyskując wyniki, z których obliczono średnią arytmetyczną.
Pobrane porcje wprowadzono do oddzielnych zlewek, zakwaszono, uzupełniono wodą destylowaną do objętości 50 cm3 i ogrzano do temperatury ok. 60°C. Następnie do każdej zlewki wprowadzono niewielki nadmiar alkoholowego roztworu dimetyloglioksymu i mieszając, dodano wodę amoniakalną w celu osiągnięcia odpowiedniego pH roztworu. We wszystkich naczyniach zaobserwowano wytrącenie różowego osadu. Osad otrzymany w każdej zlewce odsączono pod zmniejszonym ciśnieniem w uprzednio zważonych tyglach szklanych z porowatym dnem, które pełnią podwójną funkcję: sączka i tygla. Odsączone osady przemyto i wysuszono do stałej masy.
W poniższej tabeli zestawiono wyniki pomiarów masy pustych tygli oraz tygli z osadem dla trzech porcji, które pobrano z badanego roztworu. Pomiary masy wykonano na wadze analitycznej z dokładnością do 0,1 mg.
T. Lipiec, Z.S. Szmal, Chemia analityczna z elementami analizy instrumentalnej, Warszawa 1976, s. 330.
| a) | Uzupełnij tabelę, wpisując masę osadów dla trzech porcji badanego roztworu oraz średnią masę osadu. |
| Numer porcji roztworu | Masa pustego tygla, g | Masa tygla z osadem, g | Masa osadu, g |
| Porcja I | 28,5914 | 28,6849 | |
| Porcja II | 29,0523 | 29,1535 | |
| Porcja III | 28,9936 | 29,0942 | |
| Średnia masa osadu m, g: | |||
| b) | Oblicz, ile gramów niklu w postaci jonów Ni2+ zawierała próbka 100,00 cm3 badanego roztworu, wykorzystując średnią masę osadu dimetyloglioksymianu niklu(II). Masa molowa dimetyloglioksymianu niklu(II) jest równa 288,91 g ⋅ mol-1. |
Błąd bezwzględny, jakim jest obarczony wynik analizy dla danej porcji, jest różnicą między tym wynikiem a wartością rzeczywistą, której nie znamy. Przyjmujemy, że odpowiada jej obliczona średnia arytmetyczna: Δmbezwzgl. = mi - m, gdzie i oznacza numer porcji.
Błąd względny jest stosunkiem błędu bezwzględnego do wartości rzeczywistej wyrażonym w procentach. W tym przypadku nieznaną wartość rzeczywistą również zastępujemy średnią
arytmetyczną: Δmwzgl. = Δmbezwgl.m ⋅ 100% = mi - mm ⋅ 100%
| c) | Wskaż porcję (I, II albo III), dla której wynik analizy najbardziej odbiega od średniej masy niklu i oblicz błąd względny wyznaczenia masy niklu w postaci jonów Ni2+ w badanym roztworze opisaną metodą dla tej porcji. |
Zadanie 16. (1 pkt)
Pierwiastek chemiczny X tworzy hydrat o wzorze XSO4 · 7H2O, którego 45,5% masy stanowi woda. Ustal masę molową pierwiastka X w zaokrągleniu do jedności.
Zadanie 17. (2 pkt)
Miedź tworzy kationy Cu+ oraz Cu2+.
| a) | Określ, ile elektronów i z jakiej podpowłoki albo podpowłok oddaje atom miedzi, tworząc kation Cu2+. Dokończ poniższe zdanie, wpisując liczbę elektronów i symbol odpowiedniej podpowłoki lub podpowłok. |
Tworzenie kationu Cu2+ oznacza oddanie przez atom miedzi
| b) | Uzupełnij poniższą tabelę, wpisując schemat klatkowy konfiguracji elektronów walencyjnych jonu Cu2+ w stanie podstawowym oraz wartości głównej liczby kwantowej n i pobocznej liczby kwantowej l dla niesparowanego elektronu w tym jonie. |
| Schemat klatkowy elektronów walencyjnych | Główna liczba kwantowa n | Poboczna liczba kwantowa l |
|---|---|---|
Zadanie 18. (1 pkt)
Liczba atomowa pewnego pierwiastka wynosi 26. W poniższej tabeli przedstawiono masy atomowe i zawartość procentową trwałych izotopów tego pierwiastka występujących w przyrodzie.
| Masa atomowa izotopu, u | Zawartość procentowa izotopu, % atomów |
|---|---|
| 53,94 | 5,85 |
| 55,93 | 91,75 |
| 56,94 | 2,12 |
| 57,93 | 0,28 |
Uzupełnij poniższą tabelę. Wpisz symbol opisanego pierwiastka, symbol bloku konfiguracyjnego (energetycznego), do którego należy ten pierwiastek oraz stosując zapis pełny (podpowłokowy), konfigurację elektronową atomu (w stanie podstawowym) tego pierwiastka.
| Symbol pierwiastka | Symbol bloku konfiguracyjnego | Konfiguracja elektronowa |
|---|---|---|
Zadanie 19. (2 pkt)
Liczba atomowa pewnego pierwiastka wynosi 26. W poniższej tabeli przedstawiono masy atomowe i zawartość procentową trwałych izotopów tego pierwiastka występujących w przyrodzie.
| Masa atomowa izotopu, u | Zawartość procentowa izotopu, % atomów |
|---|---|
| 53,94 | 5,85 |
| 55,93 | 91,75 |
| 56,94 | 2,12 |
| 57,93 | 0,28 |
Uzupełnij poniższe zdania. Wybierz i podkreśl właściwe określenie w każdym nawiasie tak, aby zdania były prawdziwe. Następnie wpisz odpowiednią liczbę odnoszącą się do opisanego pierwiastka lub wyjaśnij, dlaczego nie można określić danej wielkości.
- Znając liczbę atomową pierwiastka, (można określić liczbę protonów / nie można określić liczby protonów) wchodzących w skład jądra atomu tego pierwiastka.
Liczba protonów lub wyjaśnienie: - Znając liczbę atomową pierwiastka, (można określić liczbę neutronów / nie można określić liczby neutronów) wchodzących w skład jądra atomu tego pierwiastka.
Liczba neutronów lub wyjaśnienie: - Znając liczbę atomową pierwiastka, (można określić ładunek / nie można określić ładunku) jądra atomu tego pierwiastka.
Ładunek jądra atomu lub wyjaśnienie: - Znając liczbę atomową pierwiastka, (można określić liczbę masową / nie można określić liczby masowej) dowolnego izotopu tego pierwiastka.
Liczba masowa lub wyjaśnienie:
Zadanie 20. (1 pkt)
Liczba atomowa pewnego pierwiastka wynosi 26. W poniższej tabeli przedstawiono masy atomowe i zawartość procentową trwałych izotopów tego pierwiastka występujących w przyrodzie.
| Masa atomowa izotopu, u | Zawartość procentowa izotopu, % atomów |
|---|---|
| 53,94 | 5,85 |
| 55,93 | 91,75 |
| 56,94 | 2,12 |
| 57,93 | 0,28 |
Oblicz średnią masę atomową opisanego pierwiastka.
Zadanie 21. (2 pkt)
Pierwiastek X leży w siódmej grupie i czwartym okresie układu okresowego. Pierwiastek ten tworzy jon prosty X2+. Wszystkie atomy pierwiastka X występujące w przyrodzie mają liczbę masową równą 55.
| a) | Napisz skróconą konfigurację elektronową jonu X2+ w stanie podstawowym. |
| b) | Określ i wpisz do tabeli liczbę protonów i neutronów znajdujących się w jądrze atomu pierwiastka X oraz liczbę elektronów tworzących rdzeń atomu tego pierwiastka. |
| Pierwiastek X | Liczba cząstek elementarnych znajdujących się w jądrze atomu X |
Liczba elektronów znajdujących się w rdzeniu atomu X |
Zadanie 22. (2 pkt)
Zależnie od tego, czy pierwiastek dąży do tworzenia jonów dodatnich, czy ujemnych, rozróżnia się pierwiastki elektrododatnie i elektroujemne. Pierwiastki elektroujemne mają wiele elektronów walencyjnych, a pobierając elektrony, tworzą jony ujemne o trwałej konfiguracji elektronowej. Pierwiastki elektrododatnie, oddając elektrony, tworzą jony dodatnie o trwałej konfiguracji.
| a) | Uzupełnij poniższe zdanie. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie tak, aby zdanie było prawdziwe. |
Pierwiastek, którego atom w stanie podstawowym ma następującą konfigurację elektronową: 1s22s22p63s23p63d54s1, należy do bloku konfiguracyjnego (s/p/d), jest pierwiastkiem (elektrododatnim/elektroujemnym), a tlenek tego pierwiastka na VI stopniu utlenienia wykazuje właściwości (kwasowe/zasadowe/amfoteryczne).
| b) | Napisz wzór oraz skróconą konfigurację jonu w stanie podstawowym pierwiastka zidentyfikowanego w podpunkcie a) tego zadania, w którym pierwiastek ten przyjmuje stopień utlenienia równy II. |
Zadanie 23. (2 pkt)
Zależnie od tego, czy pierwiastek dąży do tworzenia jonów dodatnich, czy ujemnych, rozróżnia się pierwiastki elektrododatnie i elektroujemne. Pierwiastki elektroujemne mają wiele elektronów walencyjnych, a pobierając elektrony, tworzą jony ujemne o trwałej konfiguracji elektronowej. Pierwiastki elektrododatnie, oddając elektrony, tworzą jony dodatnie o trwałej konfiguracji.
Atom pewnego pierwiastka ma w stanie podstawowym następującą konfigurację elektronową:
1s22s22p63s23p63d54s1
Tlenek i wodorotlenek tego pierwiastka, w których przyjmuje on pewien stopień utlenienia, wykazują właściwości amfoteryczne. Na tym stopniu utlenienia opisany pierwiastek występuje także w postaci jonów prostych.
| a) | Napisz wzór i skróconą konfigurację elektronową tego jonu prostego opisanego pierwiastka. |
| b) | Podaj wartość głównej liczby kwantowej n i wartość pobocznej liczby kwantowej l opisujących stan dowolnego niesparowanego elektronu walencyjnego w tym jonie. |
Zadanie 24. (3 pkt)
Poniżej przedstawiono konfigurację elektronową atomów w stanie podstawowym wybranych metali należących do 1. grupy układu okresowego pierwiastków. Metale te oznaczono numerami I, II i III.
Pierwsza energia jonizacji to energia, jaką należy dostarczyć, aby oderwać elektron od obojętnego atomu.
| a) | Zaznacz poprawne dokończenie zdania. |
Najmniejszą pierwszą energię jonizacji ma atom pierwiastka oznaczonego numerem
- I, ponieważ jego elektron walencyjny jest najmniej oddalony od jądra atomowego.
- I, ponieważ ma obsadzone elektronami tylko dwie powłoki elektronowe.
- II, ponieważ jego elektron walencyjny jest najbardziej oddalony od jądra atomowego.
- III, ponieważ ma najmniejszą elektroujemność.
| b) | Określ liczbę elektronów w rdzeniu atomu metalu oznaczonego numerem III. |
| c) | Napisz wzór sumaryczny związku metalu oznaczonego numerem II z chlorem i określ charakter wiązania chemicznego (jonowe, kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane), które w tym związku występuje. |
Zadanie 25. (1 pkt)
Zapisz pełną konfigurację elektronową atomu chromu w stanie podstawowym.
Zadanie 26. (1 pkt)
Podaj liczbę elektronów walencyjnych atomu chromu w stanie podstawowym, obsadzających wyłącznie powłokę elektronową opisaną główną liczbą kwantową n=3.
Zadanie 27. (1 pkt)
Podaj wartość pobocznej liczby kwantowej l dla jednego z elektronów walencyjnych atomu chromu, obsadzających najdalej położoną od jądra atomu powłokę elektronową.
Zadanie 28. (1 pkt)
Jądra atomowe, w których stosunek liczby neutronów do liczby protonów przekracza znacznie wartość 1, ulegają przemianom nazywanym promieniotwórczymi. W przemianach tych zachowana jest zarówno masa, jak i ładunek elektryczny, a produktami tych przemian mogą być: jądra 42He nazywane cząstkami α, elektrony nazywane cząstkami β– , jądra innych pierwiastków, a także neutrony. Cząstki niebędące składnikami jądra atomowego powstają na skutek przemian zachodzących pomiędzy nukleonami, czyli cząstkami tworzącymi jądro atomu. Wielkością charakteryzującą przemiany promieniotwórcze jest okres półtrwania jądra pierwiastka aktywnego promieniotwórczo, zdefiniowany jako czas, po którym pozostaje połowa liczby aktywnych jąder tego pierwiastka. Przykładem pierwiastka ulegającego przemianom promieniotwórczym jest pluton. Izotop plutonu 23994Pu , jako produkt przemiany zachodzącej z emisją cząstki β– izotopu neptunu o liczbie masowej równej 239, po raz pierwszy został wyodrębniony w 1941 r. przez grupę badaczy McMillana i Seaborga. Ta sama grupa badawcza odkryła go w 1942 r. w rudach uranu w ilości około 10–9%. Izotop ten jest uważany za najtrwalszy produkt rozpadu izotopu uranu o liczbie masowej równej 238.
Poniżej przedstawiono równanie przemiany przeprowadzonej przez McMillana i Seaborga.
23892U + 21H → 2 AZX + 23893Np
W równaniu tym symbolem X oznaczono cząstkę, która – obok izotopu 23893Np – jest produktem tej przemiany.
Ustal wartość liczby atomowej Z i wartość liczby masowej A cząstki X oraz podaj jej nazwę.
Zadanie 29. (1 pkt)
Jądra atomowe, w których stosunek liczby neutronów do liczby protonów przekracza znacznie wartość 1, ulegają przemianom nazywanym promieniotwórczymi. W przemianach tych zachowana jest zarówno masa, jak i ładunek elektryczny, a produktami tych przemian mogą być: jądra 42He nazywane cząstkami α, elektrony nazywane cząstkami β– , jądra innych pierwiastków, a także neutrony. Cząstki niebędące składnikami jądra atomowego powstają na skutek przemian zachodzących pomiędzy nukleonami, czyli cząstkami tworzącymi jądro atomu. Wielkością charakteryzującą przemiany promieniotwórcze jest okres półtrwania jądra pierwiastka aktywnego promieniotwórczo, zdefiniowany jako czas, po którym pozostaje połowa liczby aktywnych jąder tego pierwiastka. Przykładem pierwiastka ulegającego przemianom promieniotwórczym jest pluton. Izotop plutonu 23994Pu , jako produkt przemiany zachodzącej z emisją cząstki β– izotopu neptunu o liczbie masowej równej 239, po raz pierwszy został wyodrębniony w 1941 r. przez grupę badaczy McMillana i Seaborga. Ta sama grupa badawcza odkryła go w 1942 r. w rudach uranu w ilości około 10–9%. Izotop ten jest uważany za najtrwalszy produkt rozpadu izotopu uranu o liczbie masowej równej 238.
Uzupełnij tekst tak, aby powstały zdania prawdziwe, wpisując w odpowiedniej formie gramatycznej określenia wybrane spośród podanych poniżej.
proton, elektron, neutron, dodatni, obojętny, ujemny, większy, mniejszy
Podczas przemiany promieniotwórczej przeprowadzonej przez zespół McMillana i Seaborga w 1941 r. izotop plutonu o liczbie masowej równej 239 otrzymano w wyniku rozpadu β– izotopu neptunu o liczbie masowej równej 239. W trakcie tej przemiany zostaje wyemitowany , czyli cząstka o ładunku i masie równej 9,11 · 10–31 kg. Liczba neutronów zawartych w jądrze otrzymanego izotopu jest o 1 od liczby neutronów zawartych w jądrze izotopu wyjściowego.
Zadanie 30. (1 pkt)
Jądra atomowe, w których stosunek liczby neutronów do liczby protonów przekracza znacznie wartość 1, ulegają przemianom nazywanym promieniotwórczymi. W przemianach tych zachowana jest zarówno masa, jak i ładunek elektryczny, a produktami tych przemian mogą być: jądra 42He nazywane cząstkami α, elektrony nazywane cząstkami β– , jądra innych pierwiastków, a także neutrony. Cząstki niebędące składnikami jądra atomowego powstają na skutek przemian zachodzących pomiędzy nukleonami, czyli cząstkami tworzącymi jądro atomu. Wielkością charakteryzującą przemiany promieniotwórcze jest okres półtrwania jądra pierwiastka aktywnego promieniotwórczo, zdefiniowany jako czas, po którym pozostaje połowa liczby aktywnych jąder tego pierwiastka. Przykładem pierwiastka ulegającego przemianom promieniotwórczym jest pluton. Izotop plutonu 23994Pu , jako produkt przemiany zachodzącej z emisją cząstki β– izotopu neptunu o liczbie masowej równej 239, po raz pierwszy został wyodrębniony w 1941 r. przez grupę badaczy McMillana i Seaborga. Ta sama grupa badawcza odkryła go w 1942 r. w rudach uranu w ilości około 10–9%. Izotop ten jest uważany za najtrwalszy produkt rozpadu izotopu uranu o liczbie masowej równej 238.
Wyjaśnij, dlaczego podczas przemiany promieniotwórczej zaobserwowanej przez zespół McMillana i Seaborga w 1941 r. doszło do emisji cząstki, która nie jest składnikiem jądra atomowego. Dlaczego przemianę tę nazywamy przemianą jądrową?
Zadanie 31. (1 pkt)
Jądra atomowe, w których stosunek liczby neutronów do liczby protonów przekracza znacznie wartość 1, ulegają przemianom nazywanym promieniotwórczymi. W przemianach tych zachowana jest zarówno masa, jak i ładunek elektryczny, a produktami tych przemian mogą być: jądra 42He nazywane cząstkami α, elektrony nazywane cząstkami β– , jądra innych pierwiastków, a także neutrony. Cząstki niebędące składnikami jądra atomowego powstają na skutek przemian zachodzących pomiędzy nukleonami, czyli cząstkami tworzącymi jądro atomu. Wielkością charakteryzującą przemiany promieniotwórcze jest okres półtrwania jądra pierwiastka aktywnego promieniotwórczo, zdefiniowany jako czas, po którym pozostaje połowa liczby aktywnych jąder tego pierwiastka. Przykładem pierwiastka ulegającego przemianom promieniotwórczym jest pluton. Izotop plutonu 23994Pu , jako produkt przemiany zachodzącej z emisją cząstki β– izotopu neptunu o liczbie masowej równej 239, po raz pierwszy został wyodrębniony w 1941 r. przez grupę badaczy McMillana i Seaborga. Ta sama grupa badawcza odkryła go w 1942 r. w rudach uranu w ilości około 10–9%. Izotop ten jest uważany za najtrwalszy produkt rozpadu izotopu uranu o liczbie masowej równej 238.
Okres półtrwania τ1/2 izotopu 23893Np otrzymanego przez McMillana i Seaborga wynosi 50 h 48 min 28 s. Masa próbki tego izotopu neptunu po 16,936 dniach od zakończenia eksperymentu wyniosła 526 ng.
Oblicz początkową masę próbki izotopu 23893Np otrzymanej przez grupę amerykańskich badaczy. Wynik podaj w mikrogramach w zaokrągleniu do jedności.
Zadanie 32. (1 pkt)
W teorii orbitali molekularnych powstawanie wiązań chemicznych typu σ lub π wyjaśnia się, stosując do opisu tych wiązań orbitale cząsteczkowe odpowiedniego typu (σ lub π), które można utworzyć w wyniku właściwego nakładania odpowiednich orbitali atomowych atomów tworzących cząsteczkę. Na poniższych schematach zilustrowano powstawanie orbitali cząsteczkowych.
Na podstawie: K.H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007, s. 111–120.
Dane są cząsteczki: Cl2, H2, HF.
Ustal, nakładanie jakich orbitali atomowych (s czy p) obu atomów należy koniecznie uwzględnić, aby wyjaśnić tworzenie wiązań w cząsteczkach o podanych powyżej wzorach. W tym celu przyporządkuj każdemu wzorowi odpowiedni numer schematu.
Cl2:
H2:
HF:
Zadanie 33. (2 pkt)
Na poniższych rysunkach przedstawiono schemat oddziaływania orbitali zhybrydyzowanych atomów węgla i orbitali 1s atomów wodoru, w którego wyniku powstają wiązania chemiczne w cząsteczkach pewnych węglowodorów.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2011, s. 157.
| a) | Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeżeli jest fałszywe. |
| Zadanie | P/F | |
|---|---|---|
| 1. | Rysunek I przedstawia przestrzenne rozmieszczenie wiązań chemicznych w cząsteczce, w której każdy atom węgla ma hybrydyzację sp3. | |
| 2. | Rysunek II przedstawia przestrzenne rozmieszczenie wiązań chemicznych w cząsteczce, w której każdy atom węgla ma hybrydyzację sp. | |
| 3. | Odległość między jądrami atomu węgla w cząsteczce, której kształt przedstawiono na rysunku I, jest mniejsza niż odległość między jądrami atomu węgla w cząsteczce, której kształt przedstawiono na rysunku II. |
| b) | Wypełnij tabelę, wpisując liczbę wiązań σ i liczbę wiązań π w cząsteczkach, których kształt przedstawiono na rysunkach I i II. |
| Numer rysunku | Liczba wiązań σ | Liczba wiązań π |
|---|---|---|
| I | ||
| II |
Zadanie 34. (1 pkt)
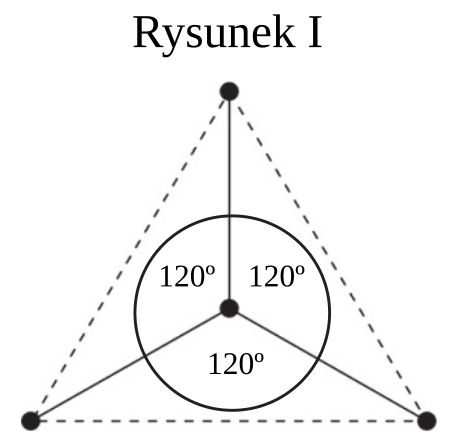
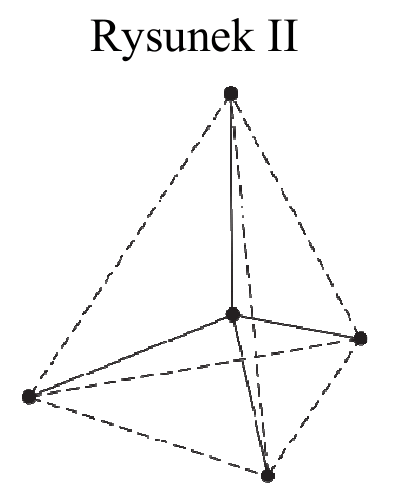
Na rysunkach przedstawiono przestrzenne rozmieszczenie wiązań chemicznych tworzonych przez orbitale zhybrydyzowane atomów węgla w cząsteczkach dwóch węglowodorów. Punktami schematycznie oznaczono położenie środków atomów połączonych tymi wiązaniami, linią ciągłą – osie wiązań, a linią przerywaną – kontury figury geometrycznej, w której narożach znajdują się atomy otaczające atom centralny. Hybrydyzacja polegająca na wymieszaniu 1 orbitalu s oraz 3 orbitali p daje hybrydyzację tetraedryczną ze względu na skierowanie orbitali zhybrydyzowanych ku narożom tetraedru. Wymieszanie 1 orbitalu s oraz 2 orbitali p daje hybrydyzację trygonalną. Wiązania utworzone za pomocą tych orbitali leżą w tej samej płaszczyźnie, a kąty pomiędzy nimi wynoszą 120°.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie tak, aby zdania były prawdziwe.
- Rysunek I przedstawia przestrzenne rozmieszczenie wiązań chemicznych tworzonych przez orbitale zhybrydyzowane atomów węgla w cząsteczkach (metanu/etenu/etynu), a rysunek II – w cząsteczkach (metanu/etenu/etynu).
- W cząsteczce węglowodoru, której strukturę przedstawia rysunek I, (występuje/nie występuje) wiązanie typu π, dlatego węglowodór ten ulega reakcjom (substytucji/addycji) i (powoduje odbarwienie /nie powoduje odbarwienia) wody bromowej.
Zadanie 35. (3 pkt)
Na rysunkach przedstawiono przestrzenne rozmieszczenie wiązań chemicznych tworzonych przez orbitale zhybrydyzowane atomów węgla w cząsteczkach dwóch węglowodorów. Punktami schematycznie oznaczono położenie środków atomów połączonych tymi wiązaniami, linią ciągłą – osie wiązań, a linią przerywaną – kontury figury geometrycznej, w której narożach znajdują się atomy otaczające atom centralny. Hybrydyzacja polegająca na wymieszaniu 1 orbitalu s oraz 3 orbitali p daje hybrydyzację tetraedryczną ze względu na skierowanie orbitali zhybrydyzowanych ku narożom tetraedru. Wymieszanie 1 orbitalu s oraz 2 orbitali p daje hybrydyzację trygonalną. Wiązania utworzone za pomocą tych orbitali leżą w tej samej płaszczyźnie, a kąty pomiędzy nimi wynoszą 120°.
| a) | Spośród odczynników wymienionych poniżej wybierz wszystkie te, które pozwolą na odróżnienie węglowodoru o strukturze przestrzennej przedstawionej na rysunku I od węglowodoru o strukturze przedstawionej na rysunku II. |
Br2 (aq), KMnO4 (aq), świeżo wytrącony Cu(OH)2, KOH (aq) i roztwór fenoloftaleiny
| b) | Napisz, jakie zmiany możliwe do zaobserwowania podczas reakcji każdego wybranego odczynnika z węglowodorami o strukturach przedstawionych na rysunkach I i II, pozwalają na odróżnienie tych węglowodorów. |
| c) | Uzasadnij swój wybór odczynników, pisząc odpowiednie równania reakcji. |
Zadanie 36. (3 pkt)
Dwa pierwiastki X i Y tworzą związek chemiczny, w którego cząsteczkach atom pierwiastka X jest atomem centralnym, a wszystkie połączone z nim atomy pierwiastka Y są równocenne. Pierwiastek X znajduje się w 13. grupie układu okresowego pierwiastków chemicznych, w rdzeniu atomowym ma 2 elektrony. Pierwiastek Y znajduje się w 3. okresie i jego atom tworzy trwały jon prosty o wzorze Y−.
| a) | Napisz wzór sumaryczny związku pierwiastka X i Y, podaj typ hybrydyzacji (sp, sp2, sp3) atomu pierwiastka X w cząsteczce tego związku oraz określ budowę przestrzenną (liniowa, trójkątna, tetraedryczna) tej cząsteczki. |
Wzór sumaryczny:
Typ hybrydyzacji:
Budowa przestrzenna:
| b) | Określ charakter wiązania chemicznego (jonowe, kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane) występującego w opisanym związku. |
| c) | Określ stosunek masowy i stosunek molowy pierwiastka X do pierwiastka Y w opisanym związku chemicznym. |
Zadanie 37. (1 pkt)
Cząsteczka arsenowodoru AsH3 ma kształt piramidy o podstawie trójkąta równobocznego, w którego narożach znajdują się środki atomów wodoru.
Napisz wzór elektronowy cząsteczki arsenowodoru, zaznaczając kreskami wiązania chemiczne i wolne pary elektronowe. Określ typ hybrydyzacji atomu arsenu w cząsteczce tego związku chemicznego.
Wzór:
Typ hybrydyzacji:
Zadanie 38. (1 pkt)
Witamina A to zbiorcza nazwa organicznych związków chemicznych z grupy retinoidów pełniących w organizmie funkcję niezbędnego składnika pokarmowego. Podstawową formą, w jakiej występuje witamina A, jest retinol, czyli cząsteczka o następującym wzorze:
Podaj liczbę atomów węgla o typie hybrydyzacji sp2 występujących w cząsteczce retinolu.
Zadanie 39. (1 pkt)
Żelazo tworzy jony proste Fe2+ i Fe3+. Jony te ulegają w roztworach wodnych hydratacji, przyłączając 4 lub 6 cząsteczek wody. Najbardziej pospolitymi kompleksami kationowymi żelaza są heksaakwakompleksy występujące między innymi w roztworach soli żelaza(II) i żelaza(III). Jony te wykazują słabe właściwości kwasowe:
II
[Fe(H2O)6]3+ + H2O ⇄ [Fe(H2O)5(OH)]2+ + H3O+
Ka = 10−3,05
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 934.
Określ, które jony – żelaza(II) czy żelaza(III) – wykazują słabsze właściwości kwasowe i uzasadnij swoją odpowiedź.
Zadanie 40. (1 pkt)
Żelazo tworzy jony proste Fe2+ i Fe3+. Jony te ulegają w roztworach wodnych hydratacji, przyłączając 4 lub 6 cząsteczek wody. Najbardziej pospolitymi kompleksami kationowymi żelaza są heksaakwakompleksy występujące między innymi w roztworach soli żelaza(II) i żelaza(III). Jony te wykazują słabe właściwości kwasowe:
II
[Fe(H2O)6]3+ + H2O ⇄ [Fe(H2O)5(OH)]2+ + H3O+
Ka = 10−3,05
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 934.
Dla przemiany oznaczonej numerem II napisz wzory kwasów i zasad, które zgodnie z teorią Brønsteda tworzą sprzężone pary.
Zadanie 41. (2 pkt)
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g) Δ H = –92,4 kJ
Na położenie stanu równowagi tej reakcji wpływ mają temperatura i ciśnienie. W poniższej tabeli przedstawiono równowagowe zawartości amoniaku (w procentach objętościowych) w stechiometrycznej mieszaninie azotu i wodoru pod różnym ciśnieniem i w różnych temperaturach.
| Temperatura, °C | Ciśnienie, MPa | ||||
| 0,1 | 3 | 10 | 20 | 100 | |
| 200 | 15,2 | 67,6 | 80,6 | 85,8 | 98,3 |
| 300 | 2,18 | 31,8 | 52,1 | 62,8 | 92,6 |
| 400 | 0,44 | 10,7 | 25,1 | 36,3 | 79,8 |
| 500 | 0,129 | 3,62 | 10,4 | 17,6 | 57,5 |
| 600 | 0,049 | 1,43 | 4,47 | 8,25 | 31,4 |
| 700 | 0,0223 | 0,66 | 2,14 | 4,11 | 12,9 |
| 900 | 0,000212 | 0,0044 | 0,13 | 0,44 | 0,87 |
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 649.
| a) | Dokonaj analizy danych zawartych w tabeli i uzupełnij poniższe zdanie. Podkreśl właściwe określenie w każdym nawiasie. |
Po ustaleniu się stanu równowagi ilość amoniaku w układzie jest tym większa, im (niższa/wyższa) jest temperatura oraz im (niższe/wyższe) jest ciśnienie.
| b) | Uzasadnij na podstawie reguły przekory Le Chateliera zmianę zawartości amoniaku w stechiometrycznej mieszaninie azotu i wodoru w zależności od ciśnienia i temperatury. |
Zadanie 42. (1 pkt)
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g) Δ H = –92,4 kJ
Na położenie stanu równowagi tej reakcji wpływ mają temperatura i ciśnienie. W poniższej tabeli przedstawiono równowagowe zawartości amoniaku (w procentach objętościowych) w stechiometrycznej mieszaninie azotu i wodoru pod różnym ciśnieniem i w różnych temperaturach.
| Temperatura, °C | Ciśnienie, MPa | ||||
| 0,1 | 3 | 10 | 20 | 100 | |
| 200 | 15,2 | 67,6 | 80,6 | 85,8 | 98,3 |
| 300 | 2,18 | 31,8 | 52,1 | 62,8 | 92,6 |
| 400 | 0,44 | 10,7 | 25,1 | 36,3 | 79,8 |
| 500 | 0,129 | 3,62 | 10,4 | 17,6 | 57,5 |
| 600 | 0,049 | 1,43 | 4,47 | 8,25 | 31,4 |
| 700 | 0,0223 | 0,66 | 2,14 | 4,11 | 12,9 |
| 900 | 0,000212 | 0,0044 | 0,13 | 0,44 | 0,87 |
Zależność wiążąca wszystkie parametry określające stan gazowy materii, czyli podająca zależność pomiędzy ciśnieniem (p), objętością (V), temperaturą (T) oraz liczbą moli gazu (n) zwana jest równaniem stanu gazu doskonałego lub równaniem Clapeyrona. Równanie ma postać:
p · V = n · R · T
R oznacza uniwersalną stałą gazową. Wartość R odczytaną z zestawu Wybranych wzorów i stałych fizykochemicznych na egzamin maturalny z biologii, chemii i fizyki można używać w równaniu Clapeyrona, jeżeli p wyrażone jest w paskalach, V w metrach sześciennych, n w molach i T w kelwinach.
Oblicz, ile moli amoniaku znajduje się w 2 m3 mieszaniny reakcyjnej w temperaturze 300°C i pod ciśnieniem 10 MPa (107 Pa) po ustaleniu stanu równowagi.
Zadanie 43. (1 pkt)
Do kolby, w której znajdowało się 990 cm3 świeżo destylowanej wody, dodano 10 cm3 kwasu solnego o stężeniu 1 mol ⋅ dm−3.
Przeczytaj poniższy tekst. Zaznacz odpowiedź A, B, C albo D, w której podano poprawne uzupełnienie luk 1. i 2.
Przed dodaniem kwasu solnego pH świeżo destylowanej wody było równe 7. Po dodaniu kwasu pH 1. ___. W stosunku do wartości początkowej stężenie jonów wodorowych 2. ___ .
| Luka 1. | Luka 2. | |
| A | wzrosło | zmniejszyło się 100 razy |
| B | wzrosło | zmniejszyło się 1000 razy |
| C | zmalało | zwiększyło się 10 000 razy |
| D | zmalało | zwiększyło się 100 000 razy |
Zadanie 44. (2 pkt)
Przeprowadzono dwa doświadczenia A i B zilustrowane poniższymi rysunkami. W każdej probówce znajdowały się kawałki blaszki cynkowej o masie 1 g i jednakowym stopniu rozdrobnienia.
| a) | Podaj numer probówki, w której w doświadczeniu A i w doświadczeniu B szybkość reakcji była większa. Uzasadnij swój wybór. |
| b) | Reakcja kwasu octowego z cynkiem przebiega zgodnie z równaniem: |
Zn + 2CH3COOH → (CH3COO)2Zn + H2
Wykonując obliczenia, sprawdź, czy 10 cm3 roztworu CH3COOH o stężeniu molowym równym 0,1 mol · dm−3 wystarczy do roztworzenia 1 g cynku.
Zadanie 45. (2 pkt)
Reakcja wodoru z jodem w fazie gazowej przebiega zgodnie z równaniem:
H2 (g) + I2 (g) ⇄ 2HI (g) ΔH > 0
Do zamkniętego reaktora wprowadzono wodór i pary jodu, uzyskując stężenie początkowe
wodoru równe 1,5 mol · dm−3, a jodu 1,0 mol · dm−3 i utrzymując stałą temperaturę.
Szybkość reakcji chemicznej zależy od stężenia substratów. Równanie kinetyczne opisujące
tę zależność dla syntezy jodowodoru ma postać: v = k ⋅ cH2 ⋅ cI2,
gdzie v jest szybkością reakcji, k jest stałą szybkości reakcji, która nie zależy od stężeń
substratów, a cH2 i cI2 oznaczają stężenia substratów reakcji.
| a) | Wykonując obliczenia, określ, jak zmieni się (wzrośnie czy zmaleje) i ile razy szybkość tej reakcji po przereagowaniu 50% początkowej ilości jodu w stosunku do szybkości początkowej. |
| b) | Oceń, jak zmieni się wydajność tworzenia jodowodoru (wzrośnie, zmaleje, nie zmieni się), jeżeli w reaktorze, w którym ustaliła się równowaga tej reakcji: |
2) tylko zmaleje ciśnienie wewnątrz reaktora.
3) tylko zwiększy się ilość jodu.
Zadanie 46. (2 pkt)
Reakcja tlenku węgla(IV) z wodorem w fazie gazowej przebiega zgodnie z równaniem:
H2 (g) + CO2 (g) ⇄ CO (g) + H2O (g)
Do zamkniętego reaktora o objętości 2 dm3, w którym utrzymywano stałą temperaturę, wprowadzono 6 moli H2 i 4 mole CO2. Stan równowagi ustalił się, gdy powstało po 2 mole produktów.
Oblicz stężenia wodoru i tlenku węgla(IV) po ustaleniu się stanu równowagi oraz stężeniową stałą równowagi tej reakcji w temperaturze, która panowała w reaktorze.
Zadanie 47. (1 pkt)
Stężeniowa stała równowagi reakcji przebiegającej zgodnie z równaniem:
H2 (g) + CO2 (g) ⇄ CO (g) + H2O (g) ΔHor = 41,17 kJ ⋅ mol-1
w temperaturze 800 K wynosi 0,24.
Do zamkniętego reaktora o stałej objętości wprowadzono 2 mole CO2 i 2 mole H2.
W reaktorze, w którym utrzymywano temperaturę 800 K, ustalił się stan równowagi opisanej
reakcji.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997, s. 144.
Napisz wyrażenie na stałą równowagi opisanej reakcji.
Zadanie 48. (2 pkt)
Stężeniowa stała równowagi reakcji przebiegającej zgodnie z równaniem:
H2 (g) + CO2 (g) ⇄ CO (g) + H2O (g) ΔHor = 41,17 kJ ⋅ mol-1
w temperaturze 800 K wynosi 0,24.
Do zamkniętego reaktora o stałej objętości wprowadzono 2 mole CO2 i 2 mole H2.
W reaktorze, w którym utrzymywano temperaturę 800 K, ustalił się stan równowagi opisanej
reakcji.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997, s. 144.
Oblicz, jaki procent początkowej liczby cząsteczek CO2 i H2 uległ przekształceniu w CO i H2O.
Zadanie 49. (1 pkt)
Stężeniowa stała równowagi reakcji przebiegającej zgodnie z równaniem:
H2 (g) + CO2 (g) ⇄ CO (g) + H2O (g) ΔHor = 41,17 kJ ⋅ mol-1
w temperaturze 800 K wynosi 0,24.
Do zamkniętego reaktora o stałej objętości wprowadzono 2 mole CO2 i 2 mole H2.
W reaktorze, w którym utrzymywano temperaturę 800 K, ustalił się stan równowagi opisanej
reakcji.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997, s. 144.
Zaznacz wykres, który ilustruje zmiany liczby moli CO2 w reaktorze od momentu zapoczątkowania reakcji do osiągnięcia przez układ stanu równowagi.
Zadanie 50. (1 pkt)
Stężeniowa stała równowagi reakcji przebiegającej zgodnie z równaniem:
H2 (g) + CO2 (g) ⇄ CO (g) + H2O (g) ΔHor = 41,17 kJ ⋅ mol-1
w temperaturze 800 K wynosi 0,24.
Do zamkniętego reaktora o stałej objętości wprowadzono 2 mole CO2 i 2 mole H2.
W reaktorze, w którym utrzymywano temperaturę 800 K, ustalił się stan równowagi opisanej
reakcji.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997, s. 144.
Określ, czy zmniejszenie o połowę objętości zamkniętego reaktora, do którego wprowadzono 2 mole CO2 i 2 mole H2, spowoduje w temperaturze 800 K wzrost wydajności tworzenia CO i H2O w wyniku tej reakcji. Odpowiedź uzasadnij.
Zadanie 51. (1 pkt)
Stężeniowa stała równowagi reakcji przebiegającej zgodnie z równaniem:
H2 (g) + CO2 (g) ⇄ CO (g) + H2O (g) ΔHor = 41,17 kJ ⋅ mol-1
w temperaturze 800 K wynosi 0,24.
Do zamkniętego reaktora o stałej objętości wprowadzono 2 mole CO2 i 2 mole H2.
W reaktorze, w którym utrzymywano temperaturę 800 K, ustalił się stan równowagi opisanej
reakcji.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997, s. 144.
Określ, czy w temperaturze 400 K stężeniowa stała równowagi opisanej reakcji jest większa, czy mniejsza od 0,24. Odpowiedź uzasadnij.
Zadanie 52. (1 pkt)
Stężeniowa stała równowagi reakcji przebiegającej zgodnie z równaniem:
H2 (g) + CO2 (g) ⇄ CO (g) + H2O (g) ΔHor = 41,17 kJ ⋅ mol-1
w temperaturze 800 K wynosi 0,24.
Do zamkniętego reaktora o stałej objętości wprowadzono 2 mole CO2 i 2 mole H2.
W reaktorze, w którym utrzymywano temperaturę 800 K, ustalił się stan równowagi opisanej
reakcji.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997, s. 144.
Do reaktora, w którym ustalił się stan równowagi opisanej reakcji w temperaturze 400 K, wprowadzono stały bezwodny chlorek wapnia. Związek ten jest substancją silnie higroskopijną. Temperatura topnienia chlorku wapnia wynosi 1048 K.
Oceń, czy wprowadzenie chlorku wapnia do reaktora wpłynęło na wydajność tworzenia CO i H2O w opisanej reakcji. Odpowiedź uzasadnij.
Zadanie 53. (1 pkt)
Dysocjacja kwasu ortoarsenowego(V) w roztworach wodnych przebiega trójstopniowo.
| Etap | Równanie reakcji | Stała dysocjacji |
|---|---|---|
| I | H3AsO4 + H2O ⇄ H2AsO–4 + H3O+ | Ka1 = 5,6 · 10–3 |
| II | H2AsO–4 + H2O ⇄ HAsO2–4 + H3O+ | Ka2 = 1,7 · 10–7 |
| III | HAsO2–4 + H2O ⇄ AsO3–4 + H3O+ | Ka3 = 3,0 · 10–12 |
Podane wartości stałych dysocjacji odnoszą się do temperatury 25°C.
Na podstawie: F. Cotton, G. Wilkinson, P. Gaus, Chemia nieorganiczna, Warszawa 2002.
Napisz wzór jonu, którego stężenie w roztworze wodnym kwasu ortoarsenowego(V) jest największe i wzór jonu, którego stężenie w tym roztworze jest najmniejsze.
Zadanie 54. (1 pkt)
Dysocjacja kwasu ortoarsenowego(V) w roztworach wodnych przebiega trójstopniowo.
| Etap | Równanie reakcji | Stała dysocjacji |
|---|---|---|
| I | H3AsO4 + H2O ⇄ H2AsO–4 + H3O+ | Ka1 = 5,6 · 10–3 |
| II | H2AsO–4 + H2O ⇄ HAsO2–4 + H3O+ | Ka2 = 1,7 · 10–7 |
| III | HAsO2–4 + H2O ⇄ AsO3–4 + H3O+ | Ka3 = 3,0 · 10–12 |
Podane wartości stałych dysocjacji odnoszą się do temperatury 25°C.
Na podstawie: F. Cotton, G. Wilkinson, P. Gaus, Chemia nieorganiczna, Warszawa 2002.
Wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeżeli jest fałszywe.
| Zadanie | P/F | |
|---|---|---|
| 1. | W etapie II anion diwodoroortoarsenianowy(V) pełni rolę zasady Brønsteda, ponieważ przyłącza proton pochodzący z cząsteczki wody. | |
| 2. | W etapie III kation hydroniowy pełni rolę zasady Brønsteda, ponieważ przyłącza proton pochodzący z anionu monowodoroortoarsenianowego(V). | |
| 3. | W etapie III anion monowodoroortoarsenianowy(V) pełni rolę kwasu Brønsteda, ponieważ jest donorem protonu dla cząsteczki wody. |
Zadanie 55. (1 pkt)
W dwóch probówkach znajdowało się po 8 cm3 wodnego azotanu(V) srebra o stężeniu 0,1 mol · dm−3. Do probówki I dodano taką objętość wodnego roztworu chlorku sodu, która zawierała 29,25 mg NaCl, a do probówki II dodano 3 cm3 wodnego roztworu chlorku glinu o stężeniu 0,2 mol · dm−3. Przebieg doświadczenia zilustrowano poniższym schematem.
W obu probówkach zaszła reakcja chemiczna, którą można przedstawić za pomocą równania:
Ag+ + Cl− → AgCl↓
Napisz w formie cząsteczkowej równania reakcji zachodzących w probówkach I i II.
Zadanie 56. (2 pkt)
W dwóch probówkach znajdowało się po 8 cm3 wodnego azotanu(V) srebra o stężeniu 0,1 mol · dm−3. Do probówki I dodano taką objętość wodnego roztworu chlorku sodu, która zawierała 29,25 mg NaCl, a do probówki II dodano 3 cm3 wodnego roztworu chlorku glinu o stężeniu 0,2 mol · dm−3. Przebieg doświadczenia zilustrowano poniższym schematem.
W obu probówkach zaszła reakcja chemiczna, którą można przedstawić za pomocą równania:
Ag+ + Cl− → AgCl↓
| a) | Wykonaj odpowiednie obliczenia i oceń, czy w obu probówkach nastąpiło całkowite strącenie jonów Ag+ w postaci osadu. |
| b) | Oblicz masę osadu AgCl wydzielonego w probówce I. |
Zadanie 57. (1 pkt)
Iloczyn rozpuszczalności KSO trudno rozpuszczalnej soli to iloczyn stężeń (podniesionych do odpowiednich potęg) jonów tworzących tę sól w stanie równowagi w nasyconym roztworze tej soli. Dla soli typu AB, której dysocjacja przebiega zgodnie z równaniem:
AB ⇄ A2+ + B2−
iloczyn rozpuszczalności KSO = [A2+] · [B2−]. Jeżeli w roztworze będą obecne jony A2+ oraz B2− i wartość iloczynu ich stężeń będzie mniejsza od wartości iloczynu rozpuszczalności soli AB, to osad tej soli nie wytrąci się. Strącenie osadu nastąpi wtedy, gdy zostanie przekroczona wartość iloczynu rozpuszczalności.
Iloczyn rozpuszczalności KSO siarczanu(VI) baru w temperaturze T wynosi:
KSO = [Ba2+]·[SO2−4] = 1,08 · 10−10
Uzupełnij poniższe zdanie. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie tak, aby zdanie było prawdziwe.
W temperaturze T (może/nie może) istnieć roztwór, w którym iloczyn stężeń kationów baru i anionów siarczanowych(VI) jest równy 1,08 · 10–7, ponieważ wartość ta jest (mniejsza/ większa) od wartości iloczynu rozpuszczalności siarczanu(VI) baru w temperaturze T.
Zadanie 58. (1 pkt)
W trzech nieoznakowanych zlewkach umieszczono osobno jednakowe objętości wody, kwasu solnego oraz wodnego roztworu wodorotlenku sodu. Wiadomo ponadto, że stężenia użytego kwasu oraz wodnego roztworu wodorotlenku były jednakowe i równe 0,01 mol · dm–3.
Oceń, czy za pomocą fenoloftaleiny (zakres pH zmiany barwy: 8,2–10) jako wskaźnika pH oraz możliwości mieszania ze sobą zawartości poszczególnych naczyń, możliwe jest jednoznaczne ustalenie zawartości zlewek. Jeśli uznasz, że jest to możliwe, opisz sposób wykonania takiego doświadczenia oraz podaj obserwacje, które pozwolą na identyfikację zawartości naczyń. Jeśli natomiast uznasz, że takiej możliwości nie ma, przytocz odpowiednie argumenty.
Zadanie 59. (2 pkt)
Po zmieszaniu 200 cm3 kwasu solnego o pH = 1 i 100 cm3 zasady sodowej o stężeniu molowym równym 0,1 mol · dm–3 przebiegła reakcja opisana równaniem:
HCl + NaOH → NaCl + H2O
Objętość powstałego roztworu była sumą objętości roztworów wyjściowych.
Oblicz wartość pH otrzymanego roztworu. Nie zaokrąglaj obliczonych wyników pośrednich. Wynik końcowy podaj z dokładnością do drugiego miejsca po przecinku.
Zadanie 60. (2 pkt)
Przygotowano roztwory wodne o stężeniu molowym równym 0,1 mol · dm−3 następujących substancji: NaOH, HCl, Ba(OH)2, H2SO4, a następnie przeprowadzono 2 reakcje zobojętniania zgodnie z równaniami:
I NaOH + HCl → NaCl + H2O
II Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Podczas dodawania porcjami kwasu solnego do roztworu wodorotlenku sodu (reakcja I) i roztworu kwasu siarkowego(VI) do roztworu wodorotlenku baru (reakcja II) mierzono przewodnictwo elektryczne roztworu. Moment, w którym przewodnictwo elektryczne roztworu jest najmniejsze, to punkt zobojętnienia.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2008, s. 178.
| a) | Napisz w formie jonowej równania przeprowadzonych reakcji. |
| b) | Dokończ zdanie, zaznaczając wniosek A lub B i jego uzasadnienie 1. lub 2. |
Porównując stężenia molowe jonów w momencie zobojętnienia obu reakcji, można stwierdzić, że w roztworze otrzymanym w reakcji I łączna liczba moli wszystkich obecnych w roztworze jonów jest
| A. | większa niż w roztworze otrzymanym w reakcji II, | ponieważ powstająca sól jest | 1. | rozpuszczalna w wodzie. |
| B. | mniejsza niż w roztworze otrzymanym w reakcji II, | 2. | nierozpuszczalna w wodzie. |
Zadanie 61. (2 pkt)
W czterech zlewkach przygotowano w temperaturze 293 K po 100 g roztworów czterech soli o stężeniu 10% masowych. Następnie do każdej zlewki dosypano po 10 g tych samych soli, utrzymując temperaturę 293 K – zgodnie z poniższym rysunkiem.
Rozpuszczalność tych soli w wodzie w temperaturze 293 K podano w poniższej tabeli.
| Substancja | BaCl2 | KCl | Na2SO4 | NaNO3 |
| Rozpuszczalność, g w 100 g wody | 35,74 | 34,03 | 19,23 | 87,27 |
| a) | Dla zlewek I, II i III wykonaj obliczenia i podaj numery tych zlewek, w których otrzymano roztwory nienasycone. |
| b) | Oblicz stężenie (wyrażone w procentach masowych) roztworu, który otrzymano w zlewce oznaczonej numerem IV. |
Zadanie 62. (1 pkt)
Do 100 cm3 wodnego roztworu CaCl2 o stężeniu 0,1 mol · dm−3 dodano 100 cm3 wodnego roztworu NaCl o stężeniu 0,1 mol · dm−3, a następnie 100 cm3 wodnego roztworu AgNO3 o stężeniu 0,1 mol · dm−3.
Podaj wzory jonów, które pozostaną w końcowym roztworze i oblicz ich stężenie molowe. Przyjmij, że objętość roztworu końcowego jest sumą objętości roztworów zmieszanych.
Zadanie 63. (2 pkt)
Do probówek z wodą wprowadzono sześć różnych substancji zgodnie z poniższym rysunkiem:
Następnie zawartość każdej probówki energicznie wymieszano i zanurzono w niej uniwersalny papierek wskaźnikowy.
| a) | Dokończ poniższe zdania, wpisując numery odpowiednich probówek. |
- Uniwersalny papierek wskaźnikowy zabarwił się na niebiesko po zanurzeniu w roztworach znajdujących się w probówkach .
- Uniwersalny papierek wskaźnikowy nie zmienił zabarwienia po zanurzeniu w roztworach znajdujących się w probówkach: .
- Reakcja hydrolizy zaszła w roztworach znajdujących się w probówkach: .
Papierek uniwersalny zanurzony w roztworze znajdującym się w probówce III zabarwił się na różowo.
| b) | Napisz w formie jonowej skróconej równanie reakcji, której efektem była zmiana zabarwienia papierka uniwersalnego po zanurzeniu w roztworze znajdującym się w probówce III. |
Zadanie 64. (2 pkt)
Zmieszano 200,00 cm3 technicznego kwasu solnego o stężeniu 30,00% (wyrażonym
w procentach masowych) i 200,00 cm3 wody destylowanej.
Na wykresie przedstawiono zależność gęstości kwasu solnego od jego stężenia procentowego.
| a) | Oblicz stężenie procentowe (w procentach masowych) otrzymanego kwasu solnego. Przyjmij, że gęstość wody wynosi 1,00 g · cm–3. |
| b) | Oblicz stężenie molowe otrzymanego kwasu solnego. Przyjmij, że objętość tego roztworu jest sumą objętości kwasu solnego technicznego i wody. |
Zadanie 65. (1 pkt)
Kolorymetria jest metodą stosowaną w analizie chemicznej. Dzięki niej można określić stężenie barwnego roztworu badanej substancji. Metoda ta wykorzystuje zjawisko pochłaniania przez barwny roztwór promieniowania elektromagnetycznego o określonej długości fali z zakresu światła widzialnego. Im większe jest stężenie badanej substancji w roztworze, w tym większym stopniu roztwór ten pochłania promieniowanie, a więc osłabia natężenie promieniowania przepuszczanego przez roztwór. Osłabienie to można zmierzyć, a jego miarą jest wielkość zwana absorbancją. Jeżeli serię pomiarów absorbancji roztworów badanej substancji w danym rozpuszczalniku przeprowadza się w tych samych warunkach, umieszczając próbki roztworów w identycznych naczynkach, wartości absorbancji zależą tylko od stężenia tych roztworów.
Jednym z zastosowań metody kolorymetrycznej jest oznaczanie stężenia jonów żelaza(III), które z jonami tiocyjanianowymi SCN– tworzą jony kompleksowe [Fe(SCN)]2+. Jony te obecne w roztworze wodnym nadają mu intensywne krwistoczerwone zabarwienie, umożliwiające wykrycie nawet śladowych ilości żelaza.
W celu wyznaczenia zawartości żelaza w postaci jonów żelaza(III) w badanym roztworze przeprowadzono opisane poniżej doświadczenie.
Wykonano pomiar absorbancji A trzech wodnych roztworów o znanym stężeniu jonów [Fe(SCN)]2+, umieszczając je w identycznych naczynkach. Wyniki pomiarów zestawiono w tabeli.
| Stężenie jonów [Fe(SCN)]2+, mol · dm–3 | Absorbancja A |
| 0,25·10–4 | 0,24 |
| 0,65·10–4 | 0,62 |
| 1,05·10–4 | 1,01 |
Próbkę 10,00 cm3 badanego roztworu umieszczono w kolbie miarowej o pojemności 50,00 cm3 i do kolby dodano w nadmiarze bezbarwny wodny roztwór tiocyjanianu potasu KSCN tak, aby powstał kompleks [Fe(SCN)]2+. Zawartość kolby dopełniono do kreski wodą destylowaną i dokładnie wymieszano. Następnie pobrano z niej próbkę i zmierzono jej absorbancję w takich samych warunkach, w jakich wykonano wcześniejszy pomiar absorbancji roztworów o znanym stężeniu. Zmierzona absorbancja A próbki badanego roztworu wyniosła 0,44.
A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010, s. 963.
Napisz w formie jonowej skróconej równanie reakcji powstawania jonów [Fe(SCN)]2+ w wyniku dodania roztworu tiocyjanianu potasu do roztworu badanego.
Zadanie 66. (3 pkt)
Kolorymetria jest metodą stosowaną w analizie chemicznej. Dzięki niej można określić stężenie barwnego roztworu badanej substancji. Metoda ta wykorzystuje zjawisko pochłaniania przez barwny roztwór promieniowania elektromagnetycznego o określonej długości fali z zakresu światła widzialnego. Im większe jest stężenie badanej substancji w roztworze, w tym większym stopniu roztwór ten pochłania promieniowanie, a więc osłabia natężenie promieniowania przepuszczanego przez roztwór. Osłabienie to można zmierzyć, a jego miarą jest wielkość zwana absorbancją. Jeżeli serię pomiarów absorbancji roztworów badanej substancji w danym rozpuszczalniku przeprowadza się w tych samych warunkach, umieszczając próbki roztworów w identycznych naczynkach, wartości absorbancji zależą tylko od stężenia tych roztworów.
Jednym z zastosowań metody kolorymetrycznej jest oznaczanie stężenia jonów żelaza(III), które z jonami tiocyjanianowymi SCN– tworzą jony kompleksowe [Fe(SCN)]2+. Jony te obecne w roztworze wodnym nadają mu intensywne krwistoczerwone zabarwienie, umożliwiające wykrycie nawet śladowych ilości żelaza.
W celu wyznaczenia zawartości żelaza w postaci jonów żelaza(III) w badanym roztworze przeprowadzono opisane poniżej doświadczenie.
Wykonano pomiar absorbancji A trzech wodnych roztworów o znanym stężeniu jonów [Fe(SCN)]2+, umieszczając je w identycznych naczynkach. Wyniki pomiarów zestawiono w tabeli.
| Stężenie jonów [Fe(SCN)]2+, mol · dm–3 | Absorbancja A |
| 0,25·10–4 | 0,24 |
| 0,65·10–4 | 0,62 |
| 1,05·10–4 | 1,01 |
Próbkę 10,00 cm3 badanego roztworu umieszczono w kolbie miarowej o pojemności 50,00 cm3 i do kolby dodano w nadmiarze bezbarwny wodny roztwór tiocyjanianu potasu KSCN tak, aby powstał kompleks [Fe(SCN)]2+. Zawartość kolby dopełniono do kreski wodą destylowaną i dokładnie wymieszano. Następnie pobrano z niej próbkę i zmierzono jej absorbancję w takich samych warunkach, w jakich wykonano wcześniejszy pomiar absorbancji roztworów o znanym stężeniu. Zmierzona absorbancja A próbki badanego roztworu wyniosła 0,44.
A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010, s. 963.
| a) | Narysuj wykres zależności absorbancji A roztworów o znanym stężeniu i oszacuj wartość stężenia jonów [Fe(SCN)]2+ w badanym roztworze. |
| b) | Oblicz, ile mikrogramów (μg) żelaza w postaci jonów żelaza(III) zawierała początkowa próbka badanego roztworu o objętości 10 cm3. |
Zadanie 67. (1 pkt)
Zmieszano dwa roztwory wodne wodorotlenku potasu (roztwór A i roztwór B) i otrzymano roztwór C. Roztwór A o gęstości d = 1,1818 g · cm−3 otrzymano przez rozpuszczenie 40 g stałego KOH w 160 g wody. Roztwór B o gęstości 1,2210 g · cm−3 i stężeniu procentowym KOH 24% masowych miał objętość 500 cm3.
Oblicz stężenie procentowe (w procentach masowych) roztworu C. Wynik podaj w zaokrągleniu do jedności.
Zadanie 68. (1 pkt)
Zmieszano dwa roztwory wodne wodorotlenku potasu (roztwór A i roztwór B) i otrzymano roztwór C. Roztwór A o gęstości d = 1,1818 g · cm−3 otrzymano przez rozpuszczenie 40 g stałego KOH w 160 g wody. Roztwór B o gęstości 1,2210 g · cm−3 i stężeniu procentowym KOH 24% masowych miał objętość 500 cm3.
Oblicz przybliżone stężenie molowe roztworu C. Wynik zaokrąglij do dwóch miejsc po przecinku. Przyjmij, że objętość roztworu C jest sumą objętości roztworów A i B.
Zadanie 69. (1 pkt)
Zmieszano dwa roztwory wodne wodorotlenku potasu (roztwór A i roztwór B) i otrzymano roztwór C. Roztwór A o gęstości d = 1,1818 g · cm−3 otrzymano przez rozpuszczenie 40 g stałego KOH w 160 g wody. Roztwór B o gęstości 1,2210 g · cm−3 i stężeniu procentowym KOH 24% masowych miał objętość 500 cm3.
Oblicz masę wody, jaką należy dodać do powstałego roztworu C, aby jego stężenie w procentach masowych osiągnęło wartość 10%. Wynik podaj w gramach i zaokrąglij do jedności.
Zadanie 70. (1 pkt)
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Zbadano odczyn roztworu w każdej probówce przy użyciu uniwersalnego papierka wskaźnikowego.
Uzupełnij tabelę, wpisując barwę uniwersalnego papierka wskaźnikowego po zanurzeniu w roztworze otrzymanym w każdej probówce oraz odczyn otrzymanego roztworu.
| Numer probówki | Barwa uniwersalnego papierka wskaźnikowego | Odczyn roztworu |
|---|---|---|
| I | ||
| II | ||
| III | ||
| IV |
Zadanie 71. (1 pkt)
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Zbadano odczyn roztworu w każdej probówce przy użyciu uniwersalnego papierka wskaźnikowego.
Napisz w formie jonowej skróconej równania reakcji chemicznych, które zaszły w probówkach I, II, III, IV lub zaznacz, że reakcja nie zaszła.
| Numer probówki | Równanie reakcji chemicznej w formie jonowej skróconej |
|---|---|
| I | |
| II | |
| III | |
| IV |
Zadanie 72. (1 pkt)
Fluorek wapnia CaF2 występuje w przyrodzie jako minerał fluoryt. Czysty fluorek wapnia jest substancją trudno rozpuszczalną w wodzie i można go łatwo wytrącić w postaci drobnokrystalicznego osadu. Proces rozpuszczania trudno rozpuszczalnej substancji jonowej możemy przedstawić równaniem:
AxBy (stały) ⇄ xAy+ (roztwór) + yBx– (roztwór)
Stała równowagi opisująca ten proces wyraża się równaniem:
Kc = CxAy+(roztw.) ⋅ CyBx–(roztw.)
jest nazywana iloczynem rozpuszczalności substancji AxBy i oznaczana symbolem KSO(AxBy). Jeżeli w roztworze iloczyn stężeń jonów, na które dysocjuje dana substancja, w potęgach odpowiadających współczynnikom stechiometrycznym z równania dysocjacji jonowej tej substancji przekracza wartość iloczynu rozpuszczalności, to w roztworze takim obserwujemy wytrącanie się osadu trudno rozpuszczalnej soli. Iloczyn rozpuszczalności fluorku wapnia w wodzie wynosi KSO(CaF2) = 3,16 ⋅ 10–11.
W zlewce o pojemności 500,00 cm3 zmieszano 130,00 cm3 roztworu chlorku wapnia o stężeniu 0,00500 mol · dm–3 i 70 cm3 roztworu fluorku sodu o stężeniu 0,00400 mol · dm–3. Objętość powstałego roztworu była sumą objętości roztworów wyjściowych.
Napisz w postaci jonowej skróconej równanie reakcji, która przebiegła po zmieszaniu roztworu chlorku wapnia i roztworu fluorku sodu.
Zadanie 73. (1 pkt)
Fluorek wapnia CaF2 występuje w przyrodzie jako minerał fluoryt. Czysty fluorek wapnia jest substancją trudno rozpuszczalną w wodzie i można go łatwo wytrącić w postaci drobnokrystalicznego osadu. Proces rozpuszczania trudno rozpuszczalnej substancji jonowej możemy przedstawić równaniem:
AxBy (stały) ⇄ xAy+ (roztwór) + yBx– (roztwór)
Stała równowagi opisująca ten proces wyraża się równaniem:
Kc = cxAy+(roztw.) ⋅ cByBx–(roztw.)
jest nazywana iloczynem rozpuszczalności substancji AxBy i oznaczana symbolem KSO(AxBy). Jeżeli w roztworze iloczyn stężeń jonów, na które dysocjuje dana substancja, w potęgach odpowiadających współczynnikom stechiometrycznym z równania dysocjacji jonowej tej substancji przekracza wartość iloczynu rozpuszczalności, to w roztworze takim obserwujemy wytrącanie się osadu trudno rozpuszczalnej soli. Iloczyn rozpuszczalności fluorku wapnia w wodzie wynosi KSO(CaF2) = 3,16 ⋅ 10–11.
W zlewce o pojemności 500,00 cm3 zmieszano 130,00 cm3 roztworu chlorku wapnia o stężeniu 0,00500 mol · dm–3 i 70 cm3 roztworu fluorku sodu o stężeniu 0,00400 mol · dm–3. Objętość powstałego roztworu była sumą objętości roztworów wyjściowych.
Wykaż, przeprowadzając odpowiednie obliczenia, że w zlewce, w której zmieszano roztwory obu soli wytrącił się drobnokrystaliczny osad.
Zadanie 74. (2 pkt)
Do probówki z wodnym roztworem dichromianu(VI) potasu dodano wodny roztwór kwasu siarkowego(VI) i wodny roztwór siarczanu(IV) potasu. Doświadczenie zilustrowano rysunkiem:
Reakcja przebiegła zgodnie ze schematem:
Cr2O2−7 + SO2−3 + H+ → Cr3+ + SO2−4 + H2O
| a) | Napisz w formie jonowej, z uwzględnieniem oddanych lub pobranych elektronów (zapis jonowo-elektronowy), równania procesów utleniania i redukcji oraz uzupełnij współczynniki stechiometryczne w schemacie równania reakcji w formie jonowej. |
| b) | Napisz równanie opisanej reakcji w formie cząsteczkowej. |
Zadanie 75. (2 pkt)
Do probówki z wodnym roztworem dichromianu(VI) potasu dodano wodny roztwór kwasu siarkowego(VI) i wodny roztwór siarczanu(IV) potasu. Doświadczenie zilustrowano rysunkiem:
Reakcja przebiegła zgodnie ze schematem:
Cr2O2−7 + SO2−3 + H+ → Cr3+ + SO2−4 + H2O
Oblicz, ile centymetrów sześciennych roztworu dichromianu(VI) potasu o stężeniu 0,5 mol · dm–3 znajdowało się w probówce, jeżeli zawarty w nim dichromian(VI) potasu utlenił siarczan(IV) potasu obecny w 4 cm3 dodanego roztworu o stężeniu 0,4 mol · dm–3. Stosunek molowy reduktora do utleniacza w opisanej reakcji wynosi 3 : 1.
Zadanie 76. (2 pkt)
Poniżej przedstawiono równania czterech reakcji utleniania i redukcji.
I CaH2 + 2H2O → Ca(OH)2 + 2H2
II 2Na + 2H2O → 2NaOH + H2
III 3H2 + N2 → 2NH3
IV Zn + 2HCl → ZnCl2 + H2
| a) | Spośród reakcji zilustrowanych powyższymi równaniami wybierz te, w których wyniku formalny stopień utlenienia wodoru zwiększa się. Napisz numery, którymi oznaczono równania tych reakcji. |
| b) | Uzupełnij poniższe zdania. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie tak, aby zdania były prawdziwe. |
- Substancją pełniącą funkcję reduktora w reakcji I jest (CaH2 / H2O), a substancją pełniącą funkcję utleniacza w reakcji II jest (Na / H2O).
- Jeden mol azotu N2 w reakcji III (pobiera/oddaje) liczbę moli elektronów równą (trzy/sześć).
- W reakcji IV jeden mol cynku oddaje (1 mol / 2 mole / 4 mole) elektronów, ulega więc procesowi (redukcji/utlenienia).
- W reakcji IV atom cynku oddaje elektrony walencyjne należące do podpowłoki (4s / 3d).
Zadanie 77. (2 pkt)
Poniżej podano schematy dwóch reakcji utleniania i redukcji.
I MnO−4 + S2− + H+ → Mn2+ S + H2O
II I− + SO2−4 + H+ → I2 + H2S + H2O
| a) | Uzupełnij tabelę, wpisując wzory jonów pełniących funkcję utleniacza i wzory jonów pełniących funkcję reduktora w reakcjach zilustrowanych podanymi schematami. |
| Reakcja I | Reakcja II | ||
| utleniacz | reduktor | utleniacz | reduktor |
| b) | Oblicz stosunek molowy reduktora do utleniacza w reakcji II. |
Zadanie 78. (2 pkt)
Poniżej podano schematy dwóch reakcji utleniania i redukcji.
I MnO−4 + S2− + H+ → Mn2+ S + H2O
II I− + SO2−4 + H+ → I2 + H2S + H2O
| a) | Napisz w formie jonowej z uwzględnieniem liczby oddanych lub pobranych elektronów (zapis jonowo-elektronowy) równania procesu redukcji i procesu utleniania zachodzących podczas przemiany przedstawionej schematem I. |
| b) | Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie. |
MnO−4 + S2− + H+ → Mn2+ S + H2O
Zadanie 79. (1 pkt)
Oczyszczoną blaszkę wykonaną z pewnego metalu zważono, a następnie zanurzono w wodnym roztworze Cu(NO3)2. Zauważono, że powierzchnia blaszki znajdująca się w roztworze pokryła się różowym nalotem o metalicznym połysku. Po pewnym czasie blaszkę wyjęto z roztworu, osuszono i zważono. Stwierdzono, że masa blaszki po wyjęciu z roztworu była mniejsza od jej masy początkowej. Roztwór w zlewce pozostał klarowny i nie zaobserwowano w nim żadnego osadu.
Uzupełnij schemat wykonania doświadczenia, wpisując nazwę lub symbol metalu, z którego była wykonana blaszka. Metal wybierz spośród podanych poniżej.
Nazwa metalu: glin, nikiel, ołów, srebro.
Schemat wykonania doświadczenia:
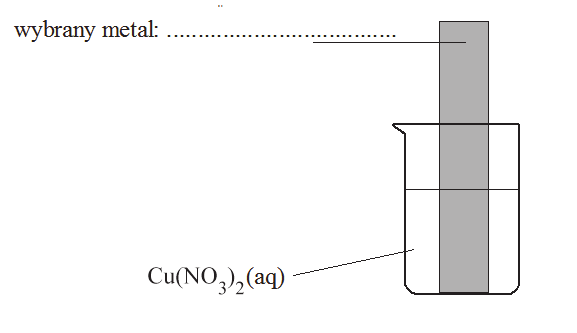
Zadanie 80. (1 pkt)
Oczyszczoną blaszkę wykonaną z pewnego metalu zważono, a następnie zanurzono w wodnym roztworze Cu(NO3)2. Zauważono, że powierzchnia blaszki znajdująca się w roztworze pokryła się różowym nalotem o metalicznym połysku. Po pewnym czasie blaszkę wyjęto z roztworu, osuszono i zważono. Stwierdzono, że masa blaszki po wyjęciu z roztworu była mniejsza od jej masy początkowej. Roztwór w zlewce pozostał klarowny i nie zaobserwowano w nim żadnego osadu.
Blaszka wykonana była z jednego z wymienionych metali: glin, nikiel, ołów, srebro.
Napisz w formie jonowej skróconej równanie reakcji, która zachodziła w czasie doświadczenia.
Zadanie 81. (1 pkt)
Oczyszczoną blaszkę wykonaną z pewnego metalu zważono, a następnie zanurzono w wodnym roztworze Cu(NO3)2. Zauważono, że powierzchnia blaszki znajdująca się w roztworze pokryła się różowym nalotem o metalicznym połysku. Po pewnym czasie blaszkę wyjęto z roztworu, osuszono i zważono. Stwierdzono, że masa blaszki po wyjęciu z roztworu była mniejsza od jej masy początkowej. Roztwór w zlewce pozostał klarowny i nie zaobserwowano w nim żadnego osadu.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie tak, aby zdania były prawdziwe.
W reakcji, która zachodziła podczas opisanego doświadczenia, wybrany metal ulegał (redukcji/utlenieniu), pełnił więc funkcję (reduktora/utleniacza). Oznacza to, że był (dawcą/biorcą) elektronów.
Zadanie 82. (1 pkt)
Związki arsenu wchodzą w skład preparatów stosowanych do zwalczania chwastów. Jednak związki te są niebezpieczne dla zwierząt, dlatego ważna jest kontrola ich występowania w środowisku naturalnym. Aby sprawdzić, jaką ilość związków arsenu zawiera badany materiał organiczny, pobrane próbki spala się, co umożliwia przemianę obecnych w próbce związków arsenu w tlenek arsenu(V). Tak otrzymaną suchą pozostałość poddaje się działaniu rozcieńczonego kwasu solnego, dzięki czemu tlenek arsenu(V) w reakcji z wodą przekształca się w rozpuszczalny w wodzie kwas ortoarsenowy(V) H3AsO4. Następnie należy zredukować otrzymany kwas ortoarsenowy(V) do kwasu ortoarsenowego(III) za pomocą chlorku cyny(II) w obecności katalizatora. Po dodaniu metalicznego cynku do roztworu zawierającego kwas ortofosforowy(III) arsen oddziela się od reszty składników w postaci AsH3, który jest gazem.
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, t. 1, Warszawa 2006, s. 12–14.
Napisz w formie cząsteczkowej równanie reakcji tlenku arsenu(V) z wodą.
Zadanie 83. (2 pkt)
Związki arsenu wchodzą w skład preparatów stosowanych do zwalczania chwastów. Jednak związki te są niebezpieczne dla zwierząt, dlatego ważna jest kontrola ich występowania w środowisku naturalnym. Aby sprawdzić, jaką ilość związków arsenu zawiera badany materiał organiczny, pobrane próbki spala się, co umożliwia przemianę obecnych w próbce związków arsenu w tlenek arsenu(V). Tak otrzymaną suchą pozostałość poddaje się działaniu rozcieńczonego kwasu solnego, dzięki czemu tlenek arsenu(V) w reakcji z wodą przekształca się w rozpuszczalny w wodzie kwas ortoarsenowy(V) H3AsO4. Następnie należy zredukować otrzymany kwas ortoarsenowy(V) do kwasu ortoarsenowego(III) za pomocą chlorku cyny(II) w obecności katalizatora. Po dodaniu metalicznego cynku do roztworu zawierającego kwas ortofosforowy(III) arsen oddziela się od reszty składników w postaci AsH3, który jest gazem.
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, t. 1, Warszawa 2006, s. 12–14.
Redukcja kwasu ortoarsenowego(V) chlorkiem cyny(II) przebiega zgodnie ze schematem:
H3AsO4 + Sn2+ + H+ katalizator H3AsO3 + Sn4+ + H2O
| a) | Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie procesu redukcji i równanie |
| b) | Dobierz współczynniki w równaniu reakcji kwasu ortoarsenowego(V) z chlorkiem cyny(II). |
H3AsO4 + Sn2+ + H+ katalizator H3AsO3 + Sn4+ + H2O
Zadanie 84. (2 pkt)
Związki arsenu wchodzą w skład preparatów stosowanych do zwalczania chwastów. Jednak związki te są niebezpieczne dla zwierząt, dlatego ważna jest kontrola ich występowania w środowisku naturalnym. Aby sprawdzić, jaką ilość związków arsenu zawiera badany materiał organiczny, pobrane próbki spala się, co umożliwia przemianę obecnych w próbce związków arsenu w tlenek arsenu(V). Tak otrzymaną suchą pozostałość poddaje się działaniu rozcieńczonego kwasu solnego, dzięki czemu tlenek arsenu(V) w reakcji z wodą przekształca się w rozpuszczalny w wodzie kwas ortoarsenowy(V) H3AsO4. Następnie należy zredukować otrzymany kwas ortoarsenowy(V) do kwasu ortoarsenowego(III) za pomocą chlorku cyny(II) w obecności katalizatora. Po dodaniu metalicznego cynku do roztworu zawierającego kwas ortofosforowy(III) arsen oddziela się od reszty składników w postaci AsH3, który jest gazem.
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, t. 1, Warszawa 2006, s. 12–14.
Reakcja kwasu ortoarsenowego(III) z metalicznym cynkiem w obecności kwasu solnego jest reakcją utleniania-redukcji i przebiega zgodnie z poniższym równaniem:
H3AsO3 + 3Zn + 6HCl → AsH3 + 3ZnCl2 + 3H2O
| a) | Oceń, jaką funkcję (reduktora czy utleniacza) pełni w opisanej reakcji cynk i napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie procesu, któremu metal ten ulega. |
| b) | Określ, jaka liczba moli elektronów ulega wymienianie podczas tworzenia jednego mola AsH3. |
Zadanie 85. (1 pkt)
Arsenowodór AsH3 jest toksycznym bezbarwnym gazem o nieprzyjemnym zapachu. Gazowy arsenowodór reaguje z dietyloditiokarbaminianem srebra zgodnie z równaniem
AsH3 + 6Ag+ + 3[(C2H5)2N − CS2]− → As[(C2H5)2N − CS2]3 + 6Ag + 3H+
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, t. 1, Warszawa 2006, s. 15.
Oblicz masę molową (w zaokrągleniu do jedności) związku arsenu, który powstaje w opisanej reakcji.
Zadanie 86. (1 pkt)
Arsenowodór AsH3 jest toksycznym bezbarwnym gazem o nieprzyjemnym zapachu. Gazowy arsenowodór reaguje z dietyloditiokarbaminianem srebra zgodnie z równaniem
AsH3 + 6Ag+ + 3[(C2H5)2N − CS2]− → As[(C2H5)2N − CS2]3 + 6Ag + 3H+
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, t. 1, Warszawa 2006, s. 15.
Oceń, czy opisana reakcja jest reakcją utleniania i redukcji. Odpowiedź uzasadnij.
Zadanie 87. (3 pkt)
Przeprowadzono dwa doświadczenia A i B, których celem było porównanie charakteru chemicznego tlenków chromu na II i III stopniu utlenienia: CrO i Cr2O3. W probówce oznaczonej numerem I w doświadczeniu A i doświadczeniu B znajdował się ten sam tlenek chromu, podobnie w probówce oznaczonej numerem II w obu doświadczeniach umieszczono drugi (taki sam w doświadczeniu A i B) tlenek chromu. W doświadczeniu A stwierdzono objawy reakcji tylko w probówce II, w doświadczeniu B – w obu probówkach zaobserwowano objawy reakcji.
| a) | Uzupełnij rysunek, wpisując odpowiednie wzory tlenków chromu znajdujących się w probówce I i w probówce II w obu doświadczeniach. |
| b) | Uzupełnij poniższe zdania. Wybierz i podkreśl właściwe określenie lub określenia w każdym nawiasie tak, aby zdania były prawdziwe. |
- Tlenek chromu(II) wykazuje właściwości (kwasowe/zasadowe/amfoteryczne), reaguje z (kwasami/zasadami).
- Tlenek chromu (III) wykazuje właściwości (kwasowe/zasadowe/amfoteryczne), reaguje z (kwasami/zasadami).
| c) | Napisz w formie jonowej skróconej równania reakcji zachodzących w probówkach oznaczonych numerem II w doświadczeniu A oraz doświadczeniu B, wiedząc, że produktem jednej z nich jest związek kompleksowy o liczbie koordynacyjnej równej 4. |
Zadanie 88. (3 pkt)
Na 10 g stopu Monela zawierającego 67% niklu, 32% miedzi i 1% manganu (w procentach
masowych) podziałano kwasem solnym o stężeniu 0,5 mol · dm−3.
Podczas tego procesu przebiegały reakcje opisane równaniami:
Ni + 2HCl → NiCl2 + H2
Mn + 2HCl → MnCl2 + H2
Na podstawie: K.H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007, s. 570.
| a) | Oblicz objętość kwasu solnego potrzebną do całkowitego roztworzenia niklu i manganu w 10 g stopu Monela, jeżeli reakcja przebiega z wydajnością równą 100%. |
| b) | Uzupełnij poniższe zdania. Wybierz i podkreśl właściwe określenie w każdym nawiasie tak, aby zdania były prawdziwe. |
- Miedź w szeregu elektrochemicznym metali znajduje się (przed/za) wodorem i (wypiera wodór/nie wypiera wodoru) z rozcieńczonego kwas siarkowego(VI).
- Miedź nie reaguje z kwasem solnym, ponieważ kwas ten (należy/nie należy) do kwasów utleniających.
Zadanie 89. (2 pkt)
Glin tworzy związki nazywane ałunami glinowymi. Są to podwójne siarczany dwóch metali, spośród których jeden występuje w ałunie na I stopniu utlenienia, a drugi na III stopniu utlenienia. Ogólny wzór ałunu jest następujący:
IM2SO4 · IIIM2(SO4)3 · 24H2O.
Skład ałunu można również przedstawić w postaci wzoru uproszczonego:
IMIIIM(SO4)2 · 12H2O.
Metalami przyjmującymi w ałunach stopień utlenienia równy I mogą być np. potas lub sód, a metalami przyjmującymi stopień utlenienia równy III – glin, żelazo lub chrom.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2012, s. 818.
Najbardziej znanym przedstawicielem ałunów jest ałun glinowo-potasowy.
| a) | Przedstaw wzór ałunu glinowo-potasowego w postaci wzoru ogólnego i w postaci wzoru uproszczonego. |
Sole podwójne istnieją tylko w stanie stałym. Podczas rozpuszczania w wodzie ulegają dysocjacji jonowej.
| b) | Napisz wzory jonów powstałych w procesie dysocjacji ałunu glinowo-potasowego. |
Zadanie 90. (2 pkt)
Badając aktywność metali, przeprowadzono doświadczenie zilustrowane rysunkiem:
| a) | Dokończ zdania, wpisując numery wybranych probówek. |
- Niebieski roztwór CuSO4 odbarwiał się w probówkach .
- Spośród metali, które wprowadzono do roztworu CuSO4, najsilniejsze właściwości redukujące wykazuje metal wprowadzony do probówki .
Próbkę pewnego metalu X wprowadzono do wodnego roztworu CuSO4. Zaszła reakcja zgodnie z równaniem:
X + CuSO4 → XSO4 + Cu
Roztworzeniu 27,9 g metalu X towarzyszyło wydzielenie 15 g miedzi.
| b) | Oblicz masę molową metalu X. Wynik podaj w zaokrągleniu do jedności. |
Zadanie 91. (2 pkt)
Przeprowadzono doświadczenie zilustrowane schematem:
| a) | Napisz w formie jonowej skróconej równanie reakcji, która zaszła podczas doświadczenia. |
| b) | Podaj, jakie jest stężenie molowe jonów H+ i jonów OH– po zakończeniu doświadczenia, jeżeli w reakcji wzięły udział stechiometryczne ilości reagentów. |
Zadanie 92. (2 pkt)
Przeprowadzono doświadczenie zilustrowane schematem:
Do zobojętnienia roztworu zawierającego 3 g mieszaniny KOH i NaOH zużyto 30 cm3 kwasu solnego.
Oblicz, ile procent masowych KOH i NaOH zawierała mieszanina.
Zadanie 93. (1 pkt)
Żółty roztwór chromianu(VI) potasu po zakwaszeniu zmienia barwę na pomarańczową wskutek tworzenia się jonów dichromianowych(VI) Cr2O2−7. Po wprowadzeniu jonów H3O+ powstają w pierwszej chwili jony HCrO−4, ulegające następnie kondensacji z utworzeniem jonów dichromianowych(VI).
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 893.
Przeprowadzono dwa doświadczenia.
Doświadczenie 1.
Do probówki z wodnym roztworem chromianu(VI) potasu dodawano wodny roztwór kwasu
siarkowego(VI) aż do zmiany zabarwienia roztworu na pomarańczową (etap I, w wyniku
którego otrzymano substancję X). Następnie do tej samej probówki dodawano wodny roztwór
wodorotlenku potasu, aż do uzyskania pierwotnej barwy roztworu (etap II).
Doświadczenie 2.
Do probówki z wodnym roztworem dichromianu(VI) potasu dodawano wodny roztwór
wodorotlenku potasu aż do zmiany zabarwienia roztworu na żółtą (etap I, w wyniku którego
otrzymano substancję Z). Następnie do tej samej probówki dodawano wodny roztwór kwasu
siarkowego(VI), aż do uzyskania pierwotnej barwy roztworu (etap II).
Doświadczenia zilustrowano schematami.
Zaznacz odpowiedź, w której podano poprawne wzory substancji X i Z.
| X | Z | |
| A | Cr2(SO4)3 | Cr(OH)3 |
| B | Cr2(SO4)3 | K2CrO4 |
| C | K2Cr2O7 | K2CrO4 |
| D | K2Cr2O7 | Cr(OH)3 |
Zadanie 94. (3 pkt)
Żółty roztwór chromianu(VI) potasu po zakwaszeniu zmienia barwę na pomarańczową wskutek tworzenia się jonów dichromianowych(VI) Cr2O2−7. Po wprowadzeniu jonów H3O+ powstają w pierwszej chwili jony HCrO−4, ulegające następnie kondensacji z utworzeniem jonów dichromianowych(VI).
Przeprowadzono dwa doświadczenia.
Doświadczenie 1.
Do probówki z wodnym roztworem chromianu(VI) potasu dodawano wodny roztwór kwasu
siarkowego(VI) aż do zmiany zabarwienia roztworu na pomarańczową (etap I, w wyniku
którego otrzymano substancję X). Następnie do tej samej probówki dodawano wodny roztwór
wodorotlenku potasu, aż do uzyskania pierwotnej barwy roztworu (etap II).
Doświadczenie 2.
Do probówki z wodnym roztworem dichromianu(VI) potasu dodawano wodny roztwór
wodorotlenku potasu aż do zmiany zabarwienia roztworu na żółtą (etap I, w wyniku którego
otrzymano substancję Z). Następnie do tej samej probówki dodawano wodny roztwór kwasu
siarkowego(VI), aż do uzyskania pierwotnej barwy roztworu (etap II).
Doświadczenia zilustrowano schematami.
| a) | Napisz, w odpowiedniej kolejności, w formie jonowej skróconej równania dwóch reakcji zachodzących podczas I etapu doświadczenia 1., w których wyniku powstał roztwór substancji X. |
| b) | Napisz w formie jonowej skróconej równania reakcji zachodzących podczas I i II etapu doświadczenia 2. |
| c) | Sformułuj wniosek dotyczący trwałości chromianów(VI) i dichromianów(VI) w zależności od środowiska reakcji. |
Zadanie 95. (2 pkt)
W tabeli zestawiono właściwości fizyczne borowców.
| Nazwa pierwiastka | Ogólna konfiguracja elektronów walencyjnych w stanie podstawowym | Rozpowszechnienie w skorupie ziemskiej, % |
Gęstość, g · cm–3 |
Temperatura topnienia, K |
|---|---|---|---|---|
| bor | ns2np1 | 1,0 ⋅ 10−4 | 2,34 | 2570,00 |
| glin | 8,23 | 2,70 | 933,47 | |
| gal | 1,9 ⋅ 10−4 | 5,91 | 302,91 | |
| ind | 4,5 ⋅ 10−5 | 7,31 | 429,75 | |
| tal | 8,5 ⋅ 10−5 | 11,85 | 577,00 |
Większość pierwiastków 13. grupy układu okresowego stanowi mieszaninę 2 trwałych izotopów, np. tal występuje w przyrodzie w postaci 2 izotopów o masach równych 202,97 u i 204,97 u. Bor jest pierwiastkiem niemetalicznym, podczas gdy pozostałe pierwiastki tej grupy są metalami. Glin i tal mają typowe sieci metaliczne o najgęstszym ułożeniu atomów, gal i ind tworzą sieci rzadko spotykane u metali. Te różnice w strukturze powodują różnice w twardości i temperaturach topnienia. Glin jest kowalny i ciągliwy; gal jest twardy i kruchy, natomiast ind należy do najbardziej miękkich pierwiastków – daje się kroić nożem, podobnie jak tal. Elementarny bor wykazuje bardzo wysoką temperaturę topnienia, co jest spowodowane występowaniem w jego sieci przestrzennej silnych wiązań kowalencyjnych. Bor można otrzymać w reakcji redukcji tlenku boru metalicznym magnezem użytym w nadmiarze. Otrzymany tą metodą preparat zawiera 98% boru, natomiast 2% stanowią zanieczyszczenia takie, jak tlenek magnezu i nadmiar użytego do reakcji magnezu. Czysty krystaliczny bor można otrzymać między innymi przez rozkład termiczny jodku boru. Krystaliczny bor ma barwę czarnoszarą, wykazuje dużą twardość i jest złym przewodnikiem elektryczności; charakteryzuje się małą aktywnością chemiczną – nie działa na niego wrzący kwas solny ani kwas fluorowodorowy.
J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Napisz, stosując zapis pełny (uwzględniający rozmieszczenie elektronów na podpowłokach), konfigurację elektronową atomu galu w stanie podstawowym oraz określ przynależność tego pierwiastka do bloku energetycznego (konfiguracyjnego).
Zadanie 96. (1 pkt)
W tabeli zestawiono właściwości fizyczne borowców.
| Nazwa pierwiastka | Ogólna konfiguracja elektronów walencyjnych w stanie podstawowym | Rozpowszechnienie w skorupie ziemskiej, % |
Gęstość, g · cm–3 |
Temperatura topnienia, K |
|---|---|---|---|---|
| bor | ns2np1 | 1,0 ⋅ 10−4 | 2,34 | 2570,00 |
| glin | 8,23 | 2,70 | 933,47 | |
| gal | 1,9 ⋅ 10−4 | 5,91 | 302,91 | |
| ind | 4,5 ⋅ 10−5 | 7,31 | 429,75 | |
| tal | 8,5 ⋅ 10−5 | 11,85 | 577,00 |
Większość pierwiastków 13. grupy układu okresowego stanowi mieszaninę 2 trwałych izotopów, np. tal występuje w przyrodzie w postaci 2 izotopów o masach równych 202,97 u i 204,97 u. Bor jest pierwiastkiem niemetalicznym, podczas gdy pozostałe pierwiastki tej grupy są metalami. Glin i tal mają typowe sieci metaliczne o najgęstszym ułożeniu atomów, gal i ind tworzą sieci rzadko spotykane u metali. Te różnice w strukturze powodują różnice w twardości i temperaturach topnienia. Glin jest kowalny i ciągliwy; gal jest twardy i kruchy, natomiast ind należy do najbardziej miękkich pierwiastków – daje się kroić nożem, podobnie jak tal. Elementarny bor wykazuje bardzo wysoką temperaturę topnienia, co jest spowodowane występowaniem w jego sieci przestrzennej silnych wiązań kowalencyjnych. Bor można otrzymać w reakcji redukcji tlenku boru metalicznym magnezem użytym w nadmiarze. Otrzymany tą metodą preparat zawiera 98% boru, natomiast 2% stanowią zanieczyszczenia takie, jak tlenek magnezu i nadmiar użytego do reakcji magnezu. Czysty krystaliczny bor można otrzymać między innymi przez rozkład termiczny jodku boru. Krystaliczny bor ma barwę czarnoszarą, wykazuje dużą twardość i jest złym przewodnikiem elektryczności; charakteryzuje się małą aktywnością chemiczną – nie działa na niego wrzący kwas solny ani kwas fluorowodorowy.
J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Uzupełnij poniższe zdania. Wpisz fragment konfiguracji elektronowej atomu talu w stanie podstawowym, który odnosi się do elektronów walencyjnych, a także wybierz i podkreśl symbol typu podpowłoki oraz wartość głównej i pobocznej liczby kwantowej spośród podanych w nawiasach.
Fragment konfiguracji elektronowej atomu talu w stanie podstawowym, który odnosi się do
elektronów walencyjnych można zapisać w postaci .
Jedyny niesparowany elektron atomu talu w stanie podstawowym należy do podpowłoki typu
(s/p/d). Główna liczba kwantowa n opisująca stan tego elektronu wynosi (4/5/6), a poboczna
liczba kwantowa l jest równa (0/1/2/3).
Zadanie 97. (1 pkt)
W tabeli zestawiono właściwości fizyczne borowców.
| Nazwa pierwiastka | Ogólna konfiguracja elektronów walencyjnych w stanie podstawowym | Rozpowszechnienie w skorupie ziemskiej, % |
Gęstość, g · cm–3 |
Temperatura topnienia, K |
|---|---|---|---|---|
| bor | ns2np1 | 1,0 ⋅ 10−4 | 2,34 | 2570,00 |
| glin | 8,23 | 2,70 | 933,47 | |
| gal | 1,9 ⋅ 10−4 | 5,91 | 302,91 | |
| ind | 4,5 ⋅ 10−5 | 7,31 | 429,75 | |
| tal | 8,5 ⋅ 10−5 | 11,85 | 577,00 |
Większość pierwiastków 13. grupy układu okresowego stanowi mieszaninę 2 trwałych izotopów, np. tal występuje w przyrodzie w postaci 2 izotopów o masach równych 202,97 u i 204,97 u. Bor jest pierwiastkiem niemetalicznym, podczas gdy pozostałe pierwiastki tej grupy są metalami. Glin i tal mają typowe sieci metaliczne o najgęstszym ułożeniu atomów, gal i ind tworzą sieci rzadko spotykane u metali. Te różnice w strukturze powodują różnice w twardości i temperaturach topnienia. Glin jest kowalny i ciągliwy; gal jest twardy i kruchy, natomiast ind należy do najbardziej miękkich pierwiastków – daje się kroić nożem, podobnie jak tal. Elementarny bor wykazuje bardzo wysoką temperaturę topnienia, co jest spowodowane występowaniem w jego sieci przestrzennej silnych wiązań kowalencyjnych. Bor można otrzymać w reakcji redukcji tlenku boru metalicznym magnezem użytym w nadmiarze. Otrzymany tą metodą preparat zawiera 98% boru, natomiast 2% stanowią zanieczyszczenia takie, jak tlenek magnezu i nadmiar użytego do reakcji magnezu. Czysty krystaliczny bor można otrzymać między innymi przez rozkład termiczny jodku boru. Krystaliczny bor ma barwę czarnoszarą, wykazuje dużą twardość i jest złym przewodnikiem elektryczności; charakteryzuje się małą aktywnością chemiczną – nie działa na niego wrzący kwas solny ani kwas fluorowodorowy.
J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Z układu okresowego pierwiastków odczytaj z dokładnością do drugiego miejsca po przecinku średnią masę atomową talu i oblicz, jaki procent atomów talu występujących w przyrodzie stanowią atomy o masach atomowych podanych w informacji.
Zadanie 98. (1 pkt)
W tabeli zestawiono właściwości fizyczne borowców.
| Nazwa pierwiastka | Ogólna konfiguracja elektronów walencyjnych w stanie podstawowym | Rozpowszechnienie w skorupie ziemskiej, % |
Gęstość, g · cm–3 |
Temperatura topnienia, K |
|---|---|---|---|---|
| bor | ns2np1 | 1,0 ⋅ 10−4 | 2,34 | 2570,00 |
| glin | 8,23 | 2,70 | 933,47 | |
| gal | 1,9 ⋅ 10−4 | 5,91 | 302,91 | |
| ind | 4,5 ⋅ 10−5 | 7,31 | 429,75 | |
| tal | 8,5 ⋅ 10−5 | 11,85 | 577,00 |
Większość pierwiastków 13. grupy układu okresowego stanowi mieszaninę 2 trwałych izotopów, np. tal występuje w przyrodzie w postaci 2 izotopów o masach równych 202,97 u i 204,97 u. Bor jest pierwiastkiem niemetalicznym, podczas gdy pozostałe pierwiastki tej grupy są metalami. Glin i tal mają typowe sieci metaliczne o najgęstszym ułożeniu atomów, gal i ind tworzą sieci rzadko spotykane u metali. Te różnice w strukturze powodują różnice w twardości i temperaturach topnienia. Glin jest kowalny i ciągliwy; gal jest twardy i kruchy, natomiast ind należy do najbardziej miękkich pierwiastków – daje się kroić nożem, podobnie jak tal. Elementarny bor wykazuje bardzo wysoką temperaturę topnienia, co jest spowodowane występowaniem w jego sieci przestrzennej silnych wiązań kowalencyjnych. Bor można otrzymać w reakcji redukcji tlenku boru metalicznym magnezem użytym w nadmiarze. Otrzymany tą metodą preparat zawiera 98% boru, natomiast 2% stanowią zanieczyszczenia takie, jak tlenek magnezu i nadmiar użytego do reakcji magnezu. Czysty krystaliczny bor można otrzymać między innymi przez rozkład termiczny jodku boru. Krystaliczny bor ma barwę czarnoszarą, wykazuje dużą twardość i jest złym przewodnikiem elektryczności; charakteryzuje się małą aktywnością chemiczną – nie działa na niego wrzący kwas solny ani kwas fluorowodorowy.
J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Korzystając z informacji, napisz w formie cząsteczkowej dwa równania reakcji, w wyniku których można otrzymać bor.
Zadanie 99. (2 pkt)
W tabeli zestawiono właściwości fizyczne borowców.
| Nazwa pierwiastka | Ogólna konfiguracja elektronów walencyjnych w stanie podstawowym | Rozpowszechnienie w skorupie ziemskiej, % |
Gęstość, g · cm–3 |
Temperatura topnienia, K |
|---|---|---|---|---|
| bor | ns2np1 | 1,0 ⋅ 10−4 | 2,34 | 2570,00 |
| glin | 8,23 | 2,70 | 933,47 | |
| gal | 1,9 ⋅ 10−4 | 5,91 | 302,91 | |
| ind | 4,5 ⋅ 10−5 | 7,31 | 429,75 | |
| tal | 8,5 ⋅ 10−5 | 11,85 | 577,00 |
Większość pierwiastków 13. grupy układu okresowego stanowi mieszaninę 2 trwałych izotopów, np. tal występuje w przyrodzie w postaci 2 izotopów o masach równych 202,97 u i 204,97 u. Bor jest pierwiastkiem niemetalicznym, podczas gdy pozostałe pierwiastki tej grupy są metalami. Glin i tal mają typowe sieci metaliczne o najgęstszym ułożeniu atomów, gal i ind tworzą sieci rzadko spotykane u metali. Te różnice w strukturze powodują różnice w twardości i temperaturach topnienia. Glin jest kowalny i ciągliwy; gal jest twardy i kruchy, natomiast ind należy do najbardziej miękkich pierwiastków – daje się kroić nożem, podobnie jak tal. Elementarny bor wykazuje bardzo wysoką temperaturę topnienia, co jest spowodowane występowaniem w jego sieci przestrzennej silnych wiązań kowalencyjnych. Bor można otrzymać w reakcji redukcji tlenku boru metalicznym magnezem użytym w nadmiarze. Otrzymany tą metodą preparat zawiera 98% boru, natomiast 2% stanowią zanieczyszczenia takie, jak tlenek magnezu i nadmiar użytego do reakcji magnezu. Czysty krystaliczny bor można otrzymać między innymi przez rozkład termiczny jodku boru. Krystaliczny bor ma barwę czarnoszarą, wykazuje dużą twardość i jest złym przewodnikiem elektryczności; charakteryzuje się małą aktywnością chemiczną – nie działa na niego wrzący kwas solny ani kwas fluorowodorowy.
J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Otrzymana w reakcji tlenku boru z magnezem mieszanina zawiera bor wraz z zanieczyszczeniami.
Zaprojektuj doświadczenie, którego przebieg pozwoli na usunięcie zanieczyszczeń
z otrzymanej mieszaniny.
W tym celu:
| a) | podkreśl nazwę odczynnika, który dodany do rozdrobnionej mieszaniny przereaguje z zanieczyszczeniami, umożliwiając ich usunięcie. Odczynnik wybierz spośród podanych poniżej. |
Odczynniki: wodny roztwór wodorotlenku sodu, kwas solny, wodny roztwór chlorku sodu.
| b) | zapisz w formie cząsteczkowej równania reakcji, jakie przebiegną podczas tego doświadczenia. |
Zadanie 100. (1 pkt)
W tabeli zestawiono właściwości fizyczne borowców.
| Nazwa pierwiastka | Ogólna konfiguracja elektronów walencyjnych w stanie podstawowym | Rozpowszechnienie w skorupie ziemskiej, % |
Gęstość, g · cm–3 |
Temperatura topnienia, K |
|---|---|---|---|---|
| bor | ns2np1 | 1,0 ⋅ 10−4 | 2,34 | 2570,00 |
| glin | 8,23 | 2,70 | 933,47 | |
| gal | 1,9 ⋅ 10−4 | 5,91 | 302,91 | |
| ind | 4,5 ⋅ 10−5 | 7,31 | 429,75 | |
| tal | 8,5 ⋅ 10−5 | 11,85 | 577,00 |
Większość pierwiastków 13. grupy układu okresowego stanowi mieszaninę 2 trwałych izotopów, np. tal występuje w przyrodzie w postaci 2 izotopów o masach równych 202,97 u i 204,97 u. Bor jest pierwiastkiem niemetalicznym, podczas gdy pozostałe pierwiastki tej grupy są metalami. Glin i tal mają typowe sieci metaliczne o najgęstszym ułożeniu atomów, gal i ind tworzą sieci rzadko spotykane u metali. Te różnice w strukturze powodują różnice w twardości i temperaturach topnienia. Glin jest kowalny i ciągliwy; gal jest twardy i kruchy, natomiast ind należy do najbardziej miękkich pierwiastków – daje się kroić nożem, podobnie jak tal. Elementarny bor wykazuje bardzo wysoką temperaturę topnienia, co jest spowodowane występowaniem w jego sieci przestrzennej silnych wiązań kowalencyjnych. Bor można otrzymać w reakcji redukcji tlenku boru metalicznym magnezem użytym w nadmiarze. Otrzymany tą metodą preparat zawiera 98% boru, natomiast 2% stanowią zanieczyszczenia takie, jak tlenek magnezu i nadmiar użytego do reakcji magnezu. Czysty krystaliczny bor można otrzymać między innymi przez rozkład termiczny jodku boru. Krystaliczny bor ma barwę czarnoszarą, wykazuje dużą twardość i jest złym przewodnikiem elektryczności; charakteryzuje się małą aktywnością chemiczną – nie działa na niego wrzący kwas solny ani kwas fluorowodorowy.
J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeśli jest fałszywe.
| Zadanie | P/F | |
|---|---|---|
| 1. | Spośród pierwiastków 13. grupy układu okresowego, które opisano w informacji wprowadzającej, najbardziej rozpowszechnionym w skorupie ziemskiej jest glin, a najmniej rozpowszechnionym ind. | |
| 2. | Wraz ze wzrostem liczby atomowej borowców, opisanych w informacji wprowadzającej, wzrasta ich gęstość i maleje temperatura topnienia. | |
| 3. | Wszystkie, opisane w informacji wprowadzającej, pierwiastki 13. grupy układu okresowego to typowe metale, kowalne i ciągliwe. |
Zadanie 101. (1 pkt)
Żelazo jest pierwiastkiem chemicznym, którego atomy występują w przyrodzie w postaci 4 trwałych odmian izotopowych. Najbardziej rozpowszechnioną odmianę stanowią nuklidy o liczbie masowej 56.
Silnie rozdrobnione żelazo zapala się samorzutnie w powietrzu. Produktem utleniania żelaza w wysokich temperaturach jest magnetyt, Fe3O4. Powstaje on także w czasie spalania żelaza w czystym tlenie (reakcja 1.). Oprócz tlenku Fe3O4 żelazo tworzy jeszcze 2 inne tlenki: FeO i Fe2O3. W podwyższonych temperaturach żelazo reaguje również z parą wodną według równania:
3Fe + 4H2O → Fe3O4 + 4H2
Roztwarzając czyste żelazo w kwasie solnym, uzyskuje się wodny roztwór chlorku żelaza(II) (reakcja 2.), natomiast działając gazowym chlorem na żelazo w podwyższonej temperaturze, uzyskuje się chlorek żelaza(III) (reakcja 3.). Pary chlorku żelaza(III) kondensują, tworząc ciemnobrunatne kryształy dobrze rozpuszczalne w wodzie.
Żelazo ma zdolność zastępowania mniej aktywnych metali w ich roztworach. Przebiega wtedy reakcja opisana schematem:
MeI + Me2+II → Me2+I + MeII
Powyższa przemiana zachodzi także podczas doświadczenia zilustrowanego rysunkiem:
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 917–934; M. Sienko, R. Plane, Chemia, podstawy i zastosowania, Warszawa 1996, s. 542–550; J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Dla atomów nuklidu żelaza, opisanego w informacji wprowadzającej określ ładunek jądra, liczbę protonów, liczbę elektronów i liczbę neutronów.
Zadanie 102. (1 pkt)
Żelazo jest pierwiastkiem chemicznym, którego atomy występują w przyrodzie w postaci 4 trwałych odmian izotopowych. Najbardziej rozpowszechnioną odmianę stanowią nuklidy o liczbie masowej 56.
Silnie rozdrobnione żelazo zapala się samorzutnie w powietrzu. Produktem utleniania żelaza w wysokich temperaturach jest magnetyt, Fe3O4. Powstaje on także w czasie spalania żelaza w czystym tlenie (reakcja 1.). Oprócz tlenku Fe3O4 żelazo tworzy jeszcze 2 inne tlenki: FeO i Fe2O3. W podwyższonych temperaturach żelazo reaguje również z parą wodną według równania:
3Fe + 4H2O → Fe3O4 + 4H2
Roztwarzając czyste żelazo w kwasie solnym, uzyskuje się wodny roztwór chlorku żelaza(II) (reakcja 2.), natomiast działając gazowym chlorem na żelazo w podwyższonej temperaturze, uzyskuje się chlorek żelaza(III) (reakcja 3.). Pary chlorku żelaza(III) kondensują, tworząc ciemnobrunatne kryształy dobrze rozpuszczalne w wodzie.
Żelazo ma zdolność zastępowania mniej aktywnych metali w ich roztworach. Przebiega wtedy reakcja opisana schematem:
MeI + Me2+II → Me2+I + MeII
Powyższa przemiana zachodzi także podczas doświadczenia zilustrowanego rysunkiem:
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 917–934; M. Sienko, R. Plane, Chemia, podstawy i zastosowania, Warszawa 1996, s. 542–550; J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
W wyniku całkowitej redukcji wodorem 58 g pewnego tlenku żelaza otrzymano żelazo i 18 g wody.
Wykonując odpowiednie obliczenia, ustal, czy redukowanym tlenkiem mógł być magnetyt.
Zadanie 103. (2 pkt)
Żelazo jest pierwiastkiem chemicznym, którego atomy występują w przyrodzie w postaci 4 trwałych odmian izotopowych. Najbardziej rozpowszechnioną odmianę stanowią nuklidy o liczbie masowej 56.
Silnie rozdrobnione żelazo zapala się samorzutnie w powietrzu. Produktem utleniania żelaza w wysokich temperaturach jest magnetyt, Fe3O4. Powstaje on także w czasie spalania żelaza w czystym tlenie (reakcja 1.). Oprócz tlenku Fe3O4 żelazo tworzy jeszcze 2 inne tlenki: FeO i Fe2O3. W podwyższonych temperaturach żelazo reaguje również z parą wodną według równania:
3Fe + 4H2O → Fe3O4 + 4H2
Roztwarzając czyste żelazo w kwasie solnym, uzyskuje się wodny roztwór chlorku żelaza(II) (reakcja 2.), natomiast działając gazowym chlorem na żelazo w podwyższonej temperaturze, uzyskuje się chlorek żelaza(III) (reakcja 3.). Pary chlorku żelaza(III) kondensują, tworząc ciemnobrunatne kryształy dobrze rozpuszczalne w wodzie.
Żelazo ma zdolność zastępowania mniej aktywnych metali w ich roztworach. Przebiega wtedy reakcja opisana schematem:
MeI + Me2+II → Me2+I + MeII
Powyższa przemiana zachodzi także podczas doświadczenia zilustrowanego rysunkiem:
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 917–934; M. Sienko, R. Plane, Chemia, podstawy i zastosowania, Warszawa 1996, s. 542–550; J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Na 4,2 g żelaza podziałano nadmiarem pary wodnej i zainicjowano reakcję, która przebiegła z wydajnością równą 85%.
Oblicz, jaką objętość w warunkach normalnych zajmie wodór, który wydzielił się podczas opisanej przemiany.
Zadanie 104. (1 pkt)
Żelazo jest pierwiastkiem chemicznym, którego atomy występują w przyrodzie w postaci 4 trwałych odmian izotopowych. Najbardziej rozpowszechnioną odmianę stanowią nuklidy o liczbie masowej 56.
Silnie rozdrobnione żelazo zapala się samorzutnie w powietrzu. Produktem utleniania żelaza w wysokich temperaturach jest magnetyt, Fe3O4. Powstaje on także w czasie spalania żelaza w czystym tlenie (reakcja 1.). Oprócz tlenku Fe3O4 żelazo tworzy jeszcze 2 inne tlenki: FeO i Fe2O3. W podwyższonych temperaturach żelazo reaguje również z parą wodną według równania:
3Fe + 4H2O → Fe3O4 + 4H2
Roztwarzając czyste żelazo w kwasie solnym, uzyskuje się wodny roztwór chlorku żelaza(II) (reakcja 2.), natomiast działając gazowym chlorem na żelazo w podwyższonej temperaturze, uzyskuje się chlorek żelaza(III) (reakcja 3.). Pary chlorku żelaza(III) kondensują, tworząc ciemnobrunatne kryształy dobrze rozpuszczalne w wodzie.
Żelazo ma zdolność zastępowania mniej aktywnych metali w ich roztworach. Przebiega wtedy reakcja opisana schematem:
MeI + Me2+II → Me2+I + MeII
Powyższa przemiana zachodzi także podczas doświadczenia zilustrowanego rysunkiem:
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 917–934; M. Sienko, R. Plane, Chemia, podstawy i zastosowania, Warszawa 1996, s. 542–550; J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Napisz w formie cząsteczkowej równania reakcji 1., 2. i 3., które opisano w informacji wprowadzającej do zadań.
Zadanie 105. (2 pkt)
Żelazo jest pierwiastkiem chemicznym, którego atomy występują w przyrodzie w postaci 4 trwałych odmian izotopowych. Najbardziej rozpowszechnioną odmianę stanowią nuklidy o liczbie masowej 56.
Silnie rozdrobnione żelazo zapala się samorzutnie w powietrzu. Produktem utleniania żelaza w wysokich temperaturach jest magnetyt, Fe3O4. Powstaje on także w czasie spalania żelaza w czystym tlenie (reakcja 1.). Oprócz tlenku Fe3O4 żelazo tworzy jeszcze 2 inne tlenki: FeO i Fe2O3. W podwyższonych temperaturach żelazo reaguje również z parą wodną według równania:
3Fe + 4H2O → Fe3O4 + 4H2
Roztwarzając czyste żelazo w kwasie solnym, uzyskuje się wodny roztwór chlorku żelaza(II) (reakcja 2.), natomiast działając gazowym chlorem na żelazo w podwyższonej temperaturze, uzyskuje się chlorek żelaza(III) (reakcja 3.). Pary chlorku żelaza(III) kondensują, tworząc ciemnobrunatne kryształy dobrze rozpuszczalne w wodzie.
Żelazo ma zdolność zastępowania mniej aktywnych metali w ich roztworach. Przebiega wtedy reakcja opisana schematem:
MeI + Me2+II → Me2+I + MeII
Powyższa przemiana zachodzi także podczas doświadczenia zilustrowanego rysunkiem:
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 917–934; M. Sienko, R. Plane, Chemia, podstawy i zastosowania, Warszawa 1996, s. 542–550; J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Substancję, którą otrzymano w wyniku reakcji 3., rozpuszczono w wodzie i zbadano odczyn wodnego roztworu tej substancji.
| a) | Określ odczyn wodnego roztworu opisanej substancji i potwierdź go odpowiednim równaniem reakcji zapisanym w formie jonowej skróconej. |
| b) | Napisz wzory związków chemicznych i jonów obecnych w wodnym roztworze tej substancji. |
Zadanie 106. (2 pkt)
Żelazo jest pierwiastkiem chemicznym, którego atomy występują w przyrodzie w postaci 4 trwałych odmian izotopowych. Najbardziej rozpowszechnioną odmianę stanowią nuklidy o liczbie masowej 56.
Silnie rozdrobnione żelazo zapala się samorzutnie w powietrzu. Produktem utleniania żelaza w wysokich temperaturach jest magnetyt, Fe3O4. Powstaje on także w czasie spalania żelaza w czystym tlenie (reakcja 1.). Oprócz tlenku Fe3O4 żelazo tworzy jeszcze 2 inne tlenki: FeO i Fe2O3. W podwyższonych temperaturach żelazo reaguje również z parą wodną według równania:
3Fe + 4H2O → Fe3O4 + 4H2
Roztwarzając czyste żelazo w kwasie solnym, uzyskuje się wodny roztwór chlorku żelaza(II) (reakcja 2.), natomiast działając gazowym chlorem na żelazo w podwyższonej temperaturze, uzyskuje się chlorek żelaza(III) (reakcja 3.). Pary chlorku żelaza(III) kondensują, tworząc ciemnobrunatne kryształy dobrze rozpuszczalne w wodzie.
Żelazo ma zdolność zastępowania mniej aktywnych metali w ich roztworach. Przebiega wtedy reakcja opisana schematem:
MeI + Me2+II → Me2+I + MeII
Powyższa przemiana zachodzi także podczas doświadczenia zilustrowanego rysunkiem:
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 917–934; M. Sienko, R. Plane, Chemia, podstawy i zastosowania, Warszawa 1996, s. 542–550; J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Substancję, którą otrzymano w reakcji 3., rozpuszczono w wodzie i otrzymany roztwór wykorzystano jako odczynnik wyjściowy do przeprowadzenia doświadczenia, w którego wyniku otrzyma się najpierw wodorotlenek, a następnie odpowiedni tlenek żelaza.
Zaprojektuj doświadczenie, w którego wyniku otrzymasz najpierw wodorotlenek, a następnie odpowiedni tlenek żelaza.
| a) | Opisz sposób wykonania poszczególnych etapów doświadczenia. Uwzględnij w nim wzory lub nazwy użytych odczynników. |
| b) | Napisz w formie cząsteczkowej równania reakcji, które przebiegną podczas wykonywanego doświadczenia. Zaznacz warunki prowadzenia procesu, jeśli dana przemiana tego wymaga. |
Zadanie 107. (1 pkt)
Żelazo jest pierwiastkiem chemicznym, którego atomy występują w przyrodzie w postaci 4 trwałych odmian izotopowych. Najbardziej rozpowszechnioną odmianę stanowią nuklidy o liczbie masowej 56.
Silnie rozdrobnione żelazo zapala się samorzutnie w powietrzu. Produktem utleniania żelaza w wysokich temperaturach jest magnetyt, Fe3O4. Powstaje on także w czasie spalania żelaza w czystym tlenie (reakcja 1.). Oprócz tlenku Fe3O4 żelazo tworzy jeszcze 2 inne tlenki: FeO i Fe2O3. W podwyższonych temperaturach żelazo reaguje również z parą wodną według równania:
3Fe + 4H2O → Fe3O4 + 4H2
Roztwarzając czyste żelazo w kwasie solnym, uzyskuje się wodny roztwór chlorku żelaza(II) (reakcja 2.), natomiast działając gazowym chlorem na żelazo w podwyższonej temperaturze, uzyskuje się chlorek żelaza(III) (reakcja 3.). Pary chlorku żelaza(III) kondensują, tworząc ciemnobrunatne kryształy dobrze rozpuszczalne w wodzie.
Żelazo ma zdolność zastępowania mniej aktywnych metali w ich roztworach. Przebiega wtedy reakcja opisana schematem:
MeI + Me2+II → Me2+I + MeII
Powyższa przemiana zachodzi także podczas doświadczenia zilustrowanego rysunkiem:
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 917–934; M. Sienko, R. Plane, Chemia, podstawy i zastosowania, Warszawa 1996, s. 542–550; J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Skorzystaj z opisu doświadczenia, a następnie wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeśli jest fałszywe.
| Zadanie | P/F | |
|---|---|---|
| 1. | Podczas doświadczenia przebiegła reakcja chemiczna opisana równaniem: Fe + Cu2+ → Fe2+ + Cu |
|
| 2. | Podczas przebiegu doświadczenia płytka pokryła się czerwonobrunatnym nalotem, a roztwór zmienił barwę z niebieskiej na zielonkawą. | |
| 3. | Gdyby po zakończeniu doświadczenia płytkę wyjęto z roztworu, a następnie wysuszono i zważono, to okazałoby się, że jej masa zmniejszyła się. |
Zadanie 108. (3 pkt)
Wykonano doświadczenie, którego przebieg przedstawiono na poniższym schemacie. Celem doświadczenia było zbadanie właściwości chemicznych Al2O3. Do probówek ze stałym Al2O3 dodano w nadmiarze stężony NaOH (aq) i HCl (aq).
| a) | Napisz, jakie możliwe do zaobserwowania zmiany towarzyszyły reakcjom zachodzącym w obu probówkach. |
| b) | Zapisz w formie jonowej skróconej równania reakcji, które zaszły w obu probówkach, wiedząc, że produktem jednej z nich jest jon tetrahydroksoglinianowy. |
| c) | Na podstawie wyników przeprowadzonego doświadczenia określ charakter chemiczny Al2O3. |
Zadanie 109. (1 pkt)
Do probówek, w których znajdują się próbki metali o tej samej masie, dodano jednakowe objętości wodnego roztworu kwasu siarkowego(VI) o stężeniu 0,5 mol · dm–3. Doświadczenie prowadzono do całkowitego roztworzenia metali. Przebieg doświadczenia ilustruje rysunek.
Wybierz i podaj numer probówki, w której objętość wodoru wydzielonego po całkowitym roztworzeniu metalu była największa. Uzasadnij swój wybór.
Zadanie 110. (1 pkt)
Do probówek, w których znajdują się próbki metali o tej samej masie, dodano jednakowe objętości wodnego roztworu kwasu siarkowego(VI) o stężeniu 0,5 mol · dm–3. Doświadczenie prowadzono do całkowitego roztworzenia metali. Przebieg doświadczenia ilustruje rysunek.
Uszereguj metale użyte w doświadczeniu według malejących właściwości redukujących, wpisując ich nazwy. Skorzystaj z szeregu elektrochemicznego metali.
Zadanie 111. (1 pkt)
Chrom jest pierwiastkiem zajmującym pod względem rozpowszechnienia w skorupie ziemskiej 20. miejsce pomiędzy wszystkimi pierwiastkami. Najważniejszymi minerałami i znanymi rudami chromu są chromit FeCr2O4 oraz krokoit PbCrO4. W sieci krystalograficznej chromitu wyodrębniono jony Fe2+ i Cr2O2–4. Chrom otrzymuje się na skalę przemysłową, poddając redukcji rudę chromitową. Reakcja ta zachodzi zgodnie z równaniem:
FeCr2O4 + 4C → 2Cr + Fe + 4CO
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2002, s. 882–883.
Oblicz stopień utlenienia chromu w jonie Cr2O2–4.
Zadanie 112. (2 pkt)
Chrom jest pierwiastkiem zajmującym pod względem rozpowszechnienia w skorupie ziemskiej 20. miejsce pomiędzy wszystkimi pierwiastkami. Najważniejszymi minerałami i znanymi rudami chromu są chromit FeCr2O4 oraz krokoit PbCrO4. W sieci krystalograficznej chromitu wyodrębniono jony Fe2+ i Cr2O2–4. Chrom otrzymuje się na skalę przemysłową, poddając redukcji rudę chromitową. Reakcja ta zachodzi zgodnie z równaniem:
FeCr2O4 + 4C → 2Cr + Fe + 4CO
Huta otrzymała transport 280 t rudy chromitowej, której 20% masy stanowiły zanieczyszczenia. W procesie technologicznym otrzymywania chromu jako reduktor zastosowano czysty koks, zużywając 48 t tego surowca.
Oblicz masę chromu, który otrzymano w opisanym procesie technologicznym przy wydajności równej 75%. Wynik podaj w tonach w zaokrągleniu do jedności.
Zadanie 113. (1 pkt)
Dany jest ciąg przemian chemicznych:
Fe3O4 ←H2O, T = 470 K Fe HCl(aq) FeCl2 (aq) KOH (aq) X H2O2 Y T Z
Napisz w formie cząsteczkowej równanie reakcji żelaza z kwasem solnym i równanie reakcji żelaza z parą wodną, wiedząc, że w przypadku obu przemian produkt gazowy jest taki sam.
Zadanie 114. (1 pkt)
Dany jest ciąg przemian chemicznych:
Fe3O4 ←H2O, T = 470 K Fe HCl(aq) FeCl2 (aq) KOH (aq) X H2O2 Y T Z
Napisz w postaci jonowej skróconej równanie reakcji, podczas której otrzymano związek X.
Zadanie 115. (1 pkt)
Dany jest ciąg przemian chemicznych:
Fe3O4 ←H2O, T = 470 K Fe HCl(aq) FeCl2 (aq) KOH (aq) X H2O2 Y T Z
Podczas dodawania roztworu nadtlenku wodoru o stężeniu 30% masowych do związku X zaobserwowano w warunkach doświadczenia zmianę barwy osadu na czerwonobrunatną.
Wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeżeli jest fałszywe.
| 1. | W opisanej reakcji nadtlenek wodoru pełni rolę reduktora, w trakcie doświadczenia obserwujemy wydzielanie się pęcherzyków bezbarwnego gazu. | P | F |
| 2. | W opisanej reakcji nadtlenek wodoru pełni rolę utleniacza, w trakcie doświadczenia obserwujemy wydzielanie się pęcherzyków bezbarwnego gazu. | P | F |
| 3. | W opisanej reakcji nadtlenek wodoru pełni rolę utleniacza, w trakcie doświadczenia nie obserwujemy wydzielania się pęcherzyków gazu. | P | F |
Zadanie 116. (1 pkt)
Dany jest ciąg przemian chemicznych:
Fe3O4 ←H2O, T = 470 K Fe HCl(aq) FeCl2 (aq) KOH (aq) X H2O2 Y T Z
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas przemiany związku X w związek Y.
Zadanie 117. (2 pkt)
Dany jest ciąg przemian chemicznych:
Fe3O4 ←H2O, T = 470 K Fe HCl(aq) FeCl2 (aq) KOH (aq) X H2O2 Y T Z
117.1 (0-1)
Określ charakter chemiczny związku Z.
117.2 (0-1)
Spośród poniższego zestawu odczynników wybierz dwa, które pozwolą jednoznacznie potwierdzić w sposób eksperymentalny przewidywany charakter chemiczny związku Z.
Zestaw odczynników: kwas solny o stężeniu 36,5% masowych, woda destylowana, alkoholowy roztwór fenoloftaleiny, wodny roztwór oranżu metylowego, wodny roztwór siarczanu(IV) sodu, stężony gorący wodny roztwór wodorotlenku potasu.
Zadanie 118. (2 pkt)
Na zajęciach koła chemicznego uczniowie mieli zaplanować i wykonać doświadczenie, podczas którego otrzymaliby wodorotlenek sodu.
Sformułowali cel doświadczenia: Otrzymywanie wodorotlenku sodu NaOH w reakcji tlenku sodu Na2O z wodą. Następnie przystąpili do przeprowadzenia doświadczenia, wykonując kolejne czynności i notując spostrzeżenia:
1) do kolby stożkowej wprowadzili gazowy tlen z butli,
2) wyjęli ze słoika sód i po osuszeniu go z ciekłej parafiny umieścili małe ziarno tego metalu
na łyżce do spalań,
3) zapalili sód w płomieniu palnika gazowego i płonący wprowadzili do kolby stożkowej,
4) kiedy płomień zgasł, strącili z łyżki na dno kolby jasnożółty proszek i wyjęli łyżkę
do spalań z kolby,
5) po chwili dolali do kolby stożkowej wodę i zamieszali, obserwując rozpuszczanie się
jasnożółtego proszku, czemu towarzyszyło wyraźne spienienie zawartości kolby,
6) kropla fenoloftaleiny dodana do otrzymanego roztworu zabarwiła go na malinowo.
Po przeprowadzeniu doświadczenia uczniowie wyciągnęli następujący wniosek: Sód spalany w tlenie daje tlenek sodu, który rozpuszcza się w wodzie i z nią reaguje, a produktem tej reakcji jest wodorotlenek sodu.
118.1 (0-1)
Analizując przebieg doświadczenia przeprowadzonego przez uczniów, wyjaśnij przyczynę spienienia się zawartości kolby w trakcie rozpuszczania jasnożółtego proszku w wodzie.
118.2 (0-1)
Na podstawie zapisanych poprawnie przez uczniów obserwacji sformułuj właściwy wniosek wynikający z doświadczenia.
Zadanie 119. (1 pkt)
Na zajęciach koła chemicznego uczniowie mieli zaplanować i wykonać doświadczenie, podczas którego otrzymaliby wodorotlenek sodu.
Sformułowali cel doświadczenia: Otrzymywanie wodorotlenku sodu NaOH w reakcji tlenku sodu Na2O z wodą. Następnie przystąpili do przeprowadzenia doświadczenia, wykonując kolejne czynności i notując spostrzeżenia:
1) do kolby stożkowej wprowadzili gazowy tlen z butli,
2) wyjęli ze słoika sód i po osuszeniu go z ciekłej parafiny umieścili małe ziarno tego metalu
na łyżce do spalań,
3) zapalili sód w płomieniu palnika gazowego i płonący wprowadzili do kolby stożkowej,
4) kiedy płomień zgasł, strącili z łyżki na dno kolby jasnożółty proszek i wyjęli łyżkę
do spalań z kolby,
5) po chwili dolali do kolby stożkowej wodę i zamieszali, obserwując rozpuszczanie się
jasnożółtego proszku, czemu towarzyszyło wyraźne spienienie zawartości kolby,
6) kropla fenoloftaleiny dodana do otrzymanego roztworu zabarwiła go na malinowo.
Po przeprowadzeniu doświadczenia uczniowie wyciągnęli następujący wniosek: Sód spalany w tlenie daje tlenek sodu, który rozpuszcza się w wodzie i z nią reaguje, a produktem tej reakcji jest wodorotlenek sodu.
Napisz w formie cząsteczkowej równanie reakcji spalania sodu w tlenie.
Zadanie 120. (3 pkt)
Przeprowadzono doświadczenie zilustrowane schematem:
Napisz, co zaobserwowano podczas przebiegu tego doświadczenia.
120.1 (0-1)
Napisz, co zaobserwowano podczas przebiegu tego doświadczenia.
120.2 (0-1)
Napisz w formie cząsteczkowej i w odpowiedniej kolejności dwa równania reakcji, które zachodzą podczas tego doświadczenia.
120.3 (0-1)
Napisz wzory wszystkich jonów, które mogą być obecne w roztworze po zakończeniu doświadczenia.
Zadanie 121. (2 pkt)
Proces utleniania siarczku arsenu(III) stężonym kwasem azotowym(V) przedstawia schemat:
As2S3 + NO−3 + H2O → AsO3−4 + SO2−4 + H+ + NO
121.1 (0-1)
Napisz w formie jonowej z uwzględnieniem pobranych lub oddanych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania.
121.2 (0-1)
Uzupełnij współczynniki stechiometryczne w poniższym schemacie.
As2S3 + NO−3 + H2O → AsO3−4 + SO2−4 + H+ + NO
Zadanie 122. (2 pkt)
Przeprowadzono doświadczenie zilustrowane rysunkiem:
122.1 (0-1)
Napisz w formie cząsteczkowej równanie reakcji zachodzącej w probówce I.
122.2 (0-1)
Napisz, co zaobserwowano podczas doświadczenia w probówce II. Odpowiedź uzasadnij, pisząc w formie jonowej skróconej równanie reakcji, która zaszła w tej probówce.
Zadanie 123. (1 pkt)
Azydek sodu NaN3 jest solą kwasu azotowodorowego HN3. Azydek ten otrzymuje się w reakcji amidku sodu NaNH2, który również jest solą, z tlenkiem azotu(I) w środowisku bezwodnym. Azydek sodu rozkłada się z wydzieleniem azotu zgodnie z równaniem:
2NaN3 → 2Na + 3N2
na skutek intensywnego ogrzewania lub gwałtownego uderzenia, dzięki czemu jest on źródłem azotu w poduszkach powietrznych stosowanych w samochodach. Metaliczny sód, który powstaje w tej reakcji, jest neutralizowany w trakcie procesów współbieżnych do krzemianu sodu. Azot jest jedynym gazowym produktem przemian zachodzących w poduszce powietrznej. Równaniem łączącym ciśnienie gazu p, jego objętość V, liczbę moli gazu n i temperaturę T jest równanie Clapeyrona:
pV = nRT
w którym R jest stałą gazową o wartości 83,1 hPa ⋅ dm3mol ⋅ K
Na podstawie: L. Pajdowski, Chemia ogólna, Warszawa 1999, s. 386.
Oblicz stopień utlenienia atomu azotu w amidku sodu.
Zadanie 124. (2 pkt)
Azydek sodu NaN3 jest solą kwasu azotowodorowego HN3. Azydek ten otrzymuje się w reakcji amidku sodu NaNH2, który również jest solą, z tlenkiem azotu(I) w środowisku bezwodnym. Azydek sodu rozkłada się z wydzieleniem azotu zgodnie z równaniem:
2NaN3 → 2Na + 3N2
na skutek intensywnego ogrzewania lub gwałtownego uderzenia, dzięki czemu jest on źródłem azotu w poduszkach powietrznych stosowanych w samochodach. Metaliczny sód, który powstaje w tej reakcji, jest neutralizowany w trakcie procesów współbieżnych do krzemianu sodu. Azot jest jedynym gazowym produktem przemian zachodzących w poduszce powietrznej. Równaniem łączącym ciśnienie gazu p, jego objętość V, liczbę moli gazu n i temperaturę T jest równanie Clapeyrona:
pV = nRT
w którym R jest stałą gazową o wartości 83,1 hPa ⋅ dm3mol ⋅ K
Na podstawie: L. Pajdowski, Chemia ogólna, Warszawa 1999, s. 386.
Na skutek kolizji bocznej pojazdu został uruchomiony mechanizm bocznej poduszki powietrznej ukrytej w zagłówku siedzenia kierowcy. Znajdujący się w poduszce azydek sodu o masie 13,00 g rozłożył się całkowicie. Objętość poduszki była równa 12,00 dm3. Temperatura panująca w pojeździe wynosiła 22,00°C.
Oblicz ciśnienie panujące w poduszce powietrznej po całkowitym rozkładzie azydku sodu. Wynik wyraź w hektopaskalach w zaokrągleniu do jedności.
Zadanie 125. (1 pkt)
W tlenie amoniak spala się żółtawym płomieniem, dając wodę i azot. Zmiana entalpii zmierzona w warunkach standardowych towarzysząca tej reakcji wynosi Δ H° = −903 kJ ⋅ mol−1. W obecności katalizatora platynowego amoniak spala się do tlenku azotu(II) i wody, a zmiana entalpii towarzysząca tej reakcji wynosi Δ H° = −1260 kJ ⋅ mol−1. Reakcję tę przeprowadza się na skalę przemysłową.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, t. 2, Warszawa 2002, s. 651.
Zapisz w postaci cząsteczkowej równanie reakcji przebiegającej podczas spalania amoniaku w tlenie bez użycia katalizatora platynowego.
Zadanie 126. (1 pkt)
Siarkowodór otrzymywany jest w laboratorium w reakcji kwasu solnego z siarczkiem żelaza(II). Reakcja ta przebiega zgodnie z równaniem:
FeS(s) + 2HCl(aq) → FeCl2 (aq) + H2S(g)
Tak otrzymany gazowy siarkowodór wykorzystuje się w analizie chemicznej do wytrącania osadów trudno rozpuszczalnych siarczków, np. siarczku cynku. Gdy wodny roztwór, w którym znajdują się jony cynku, nasyca się siarkowodorem, zachodzi reakcja opisana równaniem:
Zn2+ + H2S → ZnS ↓ + 2H+
Po zakończeniu reakcji biały osad siarczku cynku odsącza się na sączku z bibuły, przemywa i umieszcza wraz z sączkiem w uprzednio zważonym porcelanowym tyglu. Następnie spala się sączek i praży osad w temperaturze 900°C aż do uzyskania stałej masy. Podczas prażenia osad siarczku cynku przechodzi w tlenek cynku zgodnie z równaniem:
2ZnS + 3O2 → 2ZnO + 2SO2 ↑
Znając masę otrzymanego tlenku cynku, można obliczyć masę cynku, który znajdował się w badanym roztworze.
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Chemiczne metody analizy ilościowej, t. 2, Warszawa 1998, s. 174–175
Przeprowadzono doświadczenie, którego przebieg przedstawiono na poniższym rysunku.
Napisz, jakie zmiany zaobserwowano w czasie doświadczenia w kolbie I i II.
Zadanie 127. (2 pkt)
Siarkowodór otrzymywany jest w laboratorium w reakcji kwasu solnego z siarczkiem żelaza(II). Reakcja ta przebiega zgodnie z równaniem:
FeS(s) + 2HCl(aq) → FeCl2 (aq) + H2S(g)
Tak otrzymany gazowy siarkowodór wykorzystuje się w analizie chemicznej do wytrącania osadów trudno rozpuszczalnych siarczków, np. siarczku cynku. Gdy wodny roztwór, w którym znajdują się jony cynku, nasyca się siarkowodorem, zachodzi reakcja opisana równaniem:
Zn2+ + H2S → ZnS ↓ + 2H+
Po zakończeniu reakcji biały osad siarczku cynku odsącza się na sączku z bibuły, przemywa i umieszcza wraz z sączkiem w uprzednio zważonym porcelanowym tyglu. Następnie spala się sączek i praży osad w temperaturze 900°C aż do uzyskania stałej masy. Podczas prażenia osad siarczku cynku przechodzi w tlenek cynku zgodnie z równaniem:
2ZnS + 3O2 → 2ZnO + 2SO2 ↑
Znając masę otrzymanego tlenku cynku, można obliczyć masę cynku, który znajdował się w badanym roztworze.
Oblicz, ile centymetrów sześciennych siarkowodoru powstanie w warunkach normalnych w reakcji 10 cm3 kwasu solnego o stężeniu 5 mol · dm–3 z nadmiarem siarczku żelaza(II).
Zadanie 128. (1 pkt)
Siarkowodór otrzymywany jest w laboratorium w reakcji kwasu solnego z siarczkiem żelaza(II). Reakcja ta przebiega zgodnie z równaniem:
FeS(s) + 2HCl(aq) → FeCl2 (aq) + H2S(g)
Tak otrzymany gazowy siarkowodór wykorzystuje się w analizie chemicznej do wytrącania osadów trudno rozpuszczalnych siarczków, np. siarczku cynku. Gdy wodny roztwór, w którym znajdują się jony cynku, nasyca się siarkowodorem, zachodzi reakcja opisana równaniem:
Zn2+ + H2S → ZnS ↓ + 2H+
Po zakończeniu reakcji biały osad siarczku cynku odsącza się na sączku z bibuły, przemywa i umieszcza wraz z sączkiem w uprzednio zważonym porcelanowym tyglu. Następnie spala się sączek i praży osad w temperaturze 900°C aż do uzyskania stałej masy. Podczas prażenia osad siarczku cynku przechodzi w tlenek cynku zgodnie z równaniem:
2ZnS + 3O2 → 2ZnO + 2SO2 ↑
Znając masę otrzymanego tlenku cynku, można obliczyć masę cynku, który znajdował się w badanym roztworze.
Aby wyznaczyć stężenie jonów cynku w badanym wodnym roztworze rozpuszczalnej soli cynku, pobrano próbkę tego roztworu o objętości 50 cm3 i umieszczono ją w zlewce. Pobrany roztwór rozcieńczono i ogrzano, a następnie pod wyciągiem nasycano siarkowodorem. Po upływie godziny od zakończenia reakcji wytrącony osad odsączono, przemyto i włożono do tygla, w którym był prażony do stałej masy. Otrzymano 243 mg tlenku cynku.
Oblicz stężenie molowe jonów cynku w badanym roztworze.
Zadanie 129. (2 pkt)
Na związek A (alkin) podziałano wodą w środowisku H2SO4 oraz w obecności jonów Hg2+ (HgSO4) i w wyniku addycji otrzymano związek B. Część związku B uwodorniono w obecności katalizatora niklowego i otrzymano związek C, a drugą część związku B utleniono, ogrzewając go z odczynnikiem Tollensa i otrzymano związek D. W wyniku ogrzania mieszaniny związków C i D w obecności kwasu siarkowego(VI) powstał ester E (octan) o przyjemnym zapachu. Opisane procesy ilustruje poniższy schemat.
129.1 (0-1)
Wpisz do tabeli wzory półstrukturalne (grupowe) związków organicznych oznaczonych na schemacie literami A, B, C, D i E.
| Wzory półstrukturalne związków | ||||
|---|---|---|---|---|
| A | B | C | D | E |
129.2 (0-1)
Stosując wzory półstrukturalne (grupowe) związków organicznych, napisz równanie reakcji oznaczonej na schemacie numerem 1. oraz równanie reakcji oznaczonej na schemacie numerem 2. Zaznacz warunki prowadzenia obu procesów.
Równanie reakcji oznaczonej na schemacie numerem 1.:
Równanie reakcji oznaczonej na schemacie numerem 2.:
Zadanie 130. (2 pkt)
Niektóre odczynniki utleniające powodują rozpad wiązania podwójnego w alkenach. Na przykład manganian(VII) potasu w środowisku obojętnym lub kwaśnym rozszczepia alkeny, dając produkty zawierające grupę karbonylową. Jeżeli przy podwójnym wiązaniu znajduje się atom wodoru, to powstają kwasy karboksylowe, a jeżeli 2 atomy wodoru są obecne przy 1 atomie węgla, tworzy się tlenek węgla(IV).
Poniżej przedstawiono schemat rozszczepienia alkenu:
CH3CH(CH3)CH2CH2CH2CH(CH3)CH=CH2 KMnO4, H3O+ X + Z
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2003, s. 241.
130.1 (0-1)
Uzupełnij schemat opisanej przemiany rozszczepienia tego alkenu. Wpisz do tabeli wzory związków oznaczonych na schemacie literami X i Z. W przypadku związków organicznych zastosuj wzory półstrukturalne (grupowe).
| Wzór związku X | |
| Wzór związku Z |
130.2 (0-1)
Podaj nazwy systematyczne wszystkich reagentów tego procesu.
| Nazwa alkenu | |
| Nazwa związku X | |
| Nazwa związku Z |
Zadanie 131. (1 pkt)
Reakcje eliminacji cząsteczki halogenowodoru (HX) z niesymetrycznego halogenku alkilowego prowadzą do powstania mieszaniny organicznych produktów. Głównym organicznym produktem takiej reakcji jest alken zawierający większą liczbę grup alkilowych przy atomach węgla połączonych wiązaniem podwójnym.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2003, s. 397.
Napisz wzory półstrukturalne (grupowe) i podaj nazwy systematyczne organicznych produktów eliminacji bromowodoru z 2-bromo-2-metylobutanu, biorąc pod uwagę zawartość procentową mieszaniny produktów.
| Produkt stanowiący 70% mieszaniny | |
|---|---|
| Wzór | Nazwa |
| Produkt stanowiący 30% mieszaniny | |
|---|---|
| Wzór | Nazwa |
Zadanie 132. (1 pkt)
Reakcje eliminacji cząsteczki halogenowodoru (HX) z niesymetrycznego halogenku alkilowego prowadzą do powstania mieszaniny organicznych produktów. Głównym organicznym produktem takiej reakcji jest alken zawierający większą liczbę grup alkilowych przy atomach węgla połączonych wiązaniem podwójnym.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2003, s. 397.
Uzupełnij poniższy schemat tak, aby otrzymać wzór izomeru geometrycznego cis węglowodoru, który jest głównym produktem eliminacji HBr z 2-bromobutanu.
Zadanie 133. (1 pkt)
Reakcje eliminacji cząsteczki halogenowodoru (HX) z niesymetrycznego halogenku alkilowego prowadzą do powstania mieszaniny organicznych produktów. Głównym organicznym produktem takiej reakcji jest alken zawierający większą liczbę grup alkilowych przy atomach węgla połączonych wiązaniem podwójnym.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2003, s. 397.
Uzupełnij poniższe zdanie. Podkreśl właściwe określenie w nawiasie oraz uzasadnij swój wybór.
Produkt uboczny reakcji eliminacji HBr z 2-bromobutanu (tworzy izomery/nie tworzy izomerów) cis-trans, ponieważ
Zadanie 134. (1 pkt)
Przeprowadzono ciąg przemian chemicznych, w wyniku których z karbidu zawierającego 20% zanieczyszczeń otrzymano kwas etanowy (octowy). Przemiany te można przedstawić poniższym schematem.
CaC2 I C2H2 II CH3CHO III CH3COOH
Wydajności kolejnych przemian (etapów) były odpowiednio równe:
WI = 85%, WII = 80%, WIII = 95%.
Oblicz całkowitą wydajność opisanego procesu.
Zadanie 135. (2 pkt)
Przeprowadzono ciąg przemian chemicznych, w wyniku których z karbidu zawierającego 20% zanieczyszczeń otrzymano kwas etanowy (octowy). Przemiany te można przedstawić poniższym schematem.
CaC2 I C2H2 II CH3CHO III CH3COOH
Wydajności kolejnych przemian (etapów) były odpowiednio równe:
WI = 85%, WII = 80%, WIII = 95%.
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania reakcji oznaczonych na schemacie numerami I, II i III.
Zadanie 136. (2 pkt)
Przeprowadzono ciąg przemian chemicznych, w wyniku których z karbidu zawierającego 20% zanieczyszczeń otrzymano kwas etanowy (octowy). Przemiany te można przedstawić poniższym schematem.
CaC2 I C2H2 II CH3CHO III CH3COOH
Wydajności kolejnych przemian (etapów) były odpowiednio równe:
WI = 85%, WII = 80%, WIII = 95%.
Oblicz, ile decymetrów sześciennych związku organicznego powstanie w wyniku przemiany I (warunki normalne), jeżeli do reakcji użyto 1 kg zanieczyszczonego karbidu. Pamiętaj, że przemiana ta zachodzi z wydajnością równą 85%.
Zadanie 137. (2 pkt)
Przeprowadzono ciąg przemian chemicznych, w wyniku których z karbidu zawierającego 20% zanieczyszczeń otrzymano kwas etanowy (octowy). Przemiany te można przedstawić poniższym schematem.
CaC2 I C2H2 II CH3CHO III CH3COOH
Wydajności kolejnych przemian (etapów) były odpowiednio równe:
WI = 85%, WII = 80%, WIII = 95%.
Na 1 mol związku organicznego otrzymanego w wyniku przemiany I podziałano wodorem w obecności katalizatora i otrzymano produkt X, który należy do szeregu homologicznego o wzorze ogólnym CnH2n. Następnie związek X poddano reakcji całkowitego spalania.
137.1 (0-1)
Napisz równanie reakcji całkowitego spalania związku X.
137.2 (0-1)
W trakcie opisanej przemiany spaleniu uległo 0,2 dm3 związku X. Objętość związku X została odmierzona w takich warunkach, w których wszystkie reagenty opisanego procesu spalania były gazami.
Ustal, jaką objętość (w opisanych warunkach) zajmował zużyty w procesie spalania tlen oraz produkty reakcji. Uzupełnij poniższą tabelę wartościami tych objętości oraz wzorami sumarycznymi produktów przemiany.
| Wzór gazu | Substrat | Wzory sumaryczne produktów | |
| O2 | |||
| V, dm3 | |||
Zadanie 138. (1 pkt)
Przeprowadzono ciąg przemian chemicznych, w wyniku których z karbidu zawierającego 20% zanieczyszczeń otrzymano kwas etanowy (octowy). Przemiany te można przedstawić poniższym schematem.
CaC2 I C2H2 II CH3CHO III CH3COOH
Wydajności kolejnych przemian (etapów) były odpowiednio równe:
WI = 85%, WII = 80%, WIII = 95%.
Przeanalizuj budowę cząsteczki związku organicznego otrzymanego w wyniku przemiany I, a następnie uzupełnij zdania, podkreślając poprawną liczbę wiązań i poprawny typ hybrydyzacji.
W cząsteczce opisanego związku są (2/3/4) wiązania typu σ i (1/2/3) typu π. Dla wszystkich atomów węgla w cząsteczkach opisanego związku przyjmuje się hybrydyzację typu (sp/sp2/sp3).
Zadanie 139. (2 pkt)
Przeprowadzono ciąg przemian chemicznych, w wyniku których z karbidu zawierającego 20% zanieczyszczeń otrzymano kwas etanowy (octowy). Przemiany te można przedstawić poniższym schematem.
CaC2 I C2H2 II CH3CHO III CH3COOH
Wydajności kolejnych przemian (etapów) były odpowiednio równe:
WI = 85%, WII = 80%, WIII = 95%.
Podaj nazwę systematyczną związku organicznego, który otrzymano w wyniku przemiany II oraz określ formalne stopnie utlenienia wszystkich atomów węgla w cząsteczce tego związku.
Nazwa systematyczna:
Stopnie utlenienia atomów węgla:
Zadanie 140. (1 pkt)
Przeprowadzono ciąg przemian chemicznych, w wyniku których z karbidu zawierającego 20% zanieczyszczeń otrzymano kwas etanowy (octowy). Przemiany te można przedstawić poniższym schematem.
CaC2 I C2H2 II CH3CHO III CH3COOH
Wydajności kolejnych przemian (etapów) były odpowiednio równe:
WI = 85%, WII = 80%, WIII = 95%.
Oceń, czy metanian metylu jest izomerem związku organicznego otrzymanego w wyniku przemiany III. Uzasadnij swoje stanowisko.
Zadanie 141. (3 pkt)
Przeprowadzono reakcję chlorowania 0,1 mola etanu w obecności światła i przy nadmiarze chloru, aż do podstawienia wszystkich atomów wodoru atomami chloru.
141.1 (0-1)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie opisanej reakcji.
141.2 (0-1)
Określ mechanizm (elektrofilowy, rodnikowy, nukleofilowy) opisanej reakcji.
141.3 (0-1)
Określ, jaka liczba cząsteczek chloru wzięła udział w tej reakcji.
Zadanie 142. (3 pkt)
Poniżej podano wzory czterech wybranych węglowodorów.
142.1 (0-1)
Uzupełnij poniższe zdania. Wybierz i podkreśl numery, którymi oznaczono wzory wszystkich związków spełniających warunki zadania.
- Wzór ogólny CnH2n określa skład węglowodorów oznaczonych numerami (I / II / III / IV).
- Izomerami konstytucyjnymi są węglowodory oznaczone numerami (I / II / III / IV).
- W temperaturze pokojowej węglowodory oznaczone numerami (I / II / III / IV) to nierozpuszczalne w wodzie gazy, dla których charakterystyczne są reakcje substytucji rodnikowej.
142.2 (0-1)
Podaj wzór produktu reakcji związku II z wodą w obecności HgSO4 i H2SO4.
142.3 (0-1)
Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeżeli jest fałszywe.
| Zadanie | P/F | |
|---|---|---|
| 1. | Związek IV powstaje w reakcji addycji 2 moli wodoru do 1 mola związku I lub 1 mola wodoru do 1 mola związku II. | |
| 2. | W reakcji związku I z roztworem manganianu(VII) potasu w środowisku obojętnym powstaje związek organiczny, którego cząsteczki zawierają 2 grupy hydroksylowe. | |
| 3. | W reakcji całkowitego spalenia 1 mola każdego z podanych węglowodorów liczba moli powstającej wody jest największa w przypadku spalania związku III. |
Zadanie 143. (2 pkt)
Trzy gazowe związki organiczne: etyn, metan i metyloaminę wprowadzono do trzech zbiorników napełnionych gazowym chlorowodorem – każdy związek do innego zbiornika. Stwierdzono, że w dwóch zbiornikach zaszła reakcja chemiczna.
Wskaż związki organiczne, które w opisanym doświadczeniu wzięły udział w reakcji z chlorowodorem. Podaj ich nazwy i napisz wzory półstrukturalne (grupowe) związków, które powstały w reakcji z chlorowodorem tych związków organicznych.
Zadanie 144. (1 pkt)
Kwasy karboksylowe ulegają redukcji, dając alkohole pierwszorzędowe. Reakcje te wykonuje się przy użyciu reduktora, którym zazwyczaj jest substancja o wzorze LiAlH4.
Napisz wzór półstrukturalny (grupowy) i podaj nazwę systematyczną alkoholu, który powstaje w wyniku redukcji kwasu oktadec-9-enowgo (kwasu oleinowego) o wzorze: CH3(CH2)7CH=CH(CH2)7COOH. Pamiętaj, że w przypadku alkoholi nienasyconych o numeracji atomów węgla w łańcuchu głównym decyduje grupa –OH, która musi być związana z atomem węgla o jak najniższym numerze.
Zadanie 145. (1 pkt)
Do trzech probówek z wodnym roztworem dichromianu(VI) potasu dodano wodny roztwór
kwasu siarkowego(VI). Do tak przygotowanej mieszaniny dodano alkohol – do probówki I –
alkohol X, do probówki II – alkohol Y, a do probówki III – alkohol Z. Każdy z dodanych
do probówek alkoholi ma inną rzędowość. Alkohole X, Y i Z wybrano spośród
następujących: CH3CH2CH2OH, CH3CH(OH)CH3, C2H5OH, CH3C(CH3)(OH)CH3.
Probówki lekko ogrzano. Doświadczenie zilustrowano poniższym schematem.
Zaobserwowano, że roztwór w probówce II zmienił barwę z pomarańczowej na zielononiebieską, a u wylotu tej probówki wyczuwalny był zapach octu. Objawy reakcji stwierdzono też w probówce III. Natomiast w probówce I nie zaobserwowano zmian.
Napisz wzory półstrukturalne (grupowe) alkoholi X, Y i Z.
Zadanie 146. (1 pkt)
Do trzech probówek z wodnym roztworem dichromianu(VI) potasu dodano wodny roztwór
kwasu siarkowego(VI). Do tak przygotowanej mieszaniny dodano alkohol – do probówki I –
alkohol X, do probówki II – alkohol Y, a do probówki III – alkohol Z. Każdy z dodanych
do probówek alkoholi ma inną rzędowość. Alkohole X, Y i Z wybrano spośród
następujących: CH3CH2CH2OH, CH3CH(OH)CH3, C2H5OH, CH3C(CH3)(OH)CH3.
Probówki lekko ogrzano. Doświadczenie zilustrowano poniższym schematem.
Zaobserwowano, że roztwór w probówce II zmienił barwę z pomarańczowej na zielononiebieską, a u wylotu tej probówki wyczuwalny był zapach octu. Objawy reakcji stwierdzono też w probówce III. Natomiast w probówce I nie zaobserwowano zmian.
W probówce II zaszła reakcja utleniania i redukcji.
Określ liczbę elektronów oddawanych przez 1 mol reduktora w reakcji zachodzącej w probówce II.
Zadanie 147. (2 pkt)
Do trzech probówek z wodnym roztworem dichromianu(VI) potasu dodano wodny roztwór
kwasu siarkowego(VI). Do tak przygotowanej mieszaniny dodano alkohol – do probówki I –
alkohol X, do probówki II – alkohol Y, a do probówki III – alkohol Z. Każdy z dodanych
do probówek alkoholi ma inną rzędowość. Alkohole X, Y i Z wybrano spośród
następujących: CH3CH2CH2OH, CH3CH(OH)CH3, C2H5OH, CH3C(CH3)(OH)CH3.
Probówki lekko ogrzano. Doświadczenie zilustrowano poniższym schematem.
Zaobserwowano, że roztwór w probówce II zmienił barwę z pomarańczowej na zielononiebieską, a u wylotu tej probówki wyczuwalny był zapach octu. Objawy reakcji stwierdzono też w probówce III. Natomiast w probówce I nie zaobserwowano zmian.
W probówce III zaszła reakcja utleniania i redukcji, a proces redukcji opisuje równanie:
Cr2O2−7 + 14H+ + 6e− → 2Cr3+ + 7H2O
147.1 (0-1)
Opisz dwie zmiany możliwe do zaobserwowania w czasie doświadczenia przebiegającego w probówce III.
147.2 (0-1)
Napisz w formie jonowej, z uwzględnieniem oddanych lub pobranych elektronów (zapis jonowo-elektronowy), równanie procesu utleniania zachodzącego w probówce III.
Zadanie 148. (1 pkt)
Do trzech probówek z wodnym roztworem dichromianu(VI) potasu dodano wodny roztwór
kwasu siarkowego(VI). Do tak przygotowanej mieszaniny dodano alkohol – do probówki I –
alkohol X, do probówki II – alkohol Y, a do probówki III – alkohol Z. Każdy z dodanych
do probówek alkoholi ma inną rzędowość. Alkohole X, Y i Z wybrano spośród
następujących: CH3CH2CH2OH, CH3CH(OH)CH3, C2H5OH, CH3C(CH3)(OH)CH3.
Probówki lekko ogrzano. Doświadczenie zilustrowano poniższym schematem.
Zaobserwowano, że roztwór w probówce II zmienił barwę z pomarańczowej na zielononiebieską, a u wylotu tej probówki wyczuwalny był zapach octu. Objawy reakcji stwierdzono też w probówce III. Natomiast w probówce I nie zaobserwowano zmian.
Uzupełnij poniższe zdania. Wybierz i podkreśl właściwe określenie w każdym nawiasie tak, aby zdania były prawdziwe.
- Alkohole pierwszorzędowe utleniają się do aldehydów lub do (ketonów / kwasów karboksylowych). W opisanym doświadczeniu alkohol pierwszorzędowy dodano do roztworu znajdującego się w probówce (I / II / III).
- Alkohole drugorzędowe utleniają się do (ketonów/aldehydów). W opisanym doświadczeniu alkohol drugorzędowy dodano do roztworu znajdującego się w probówce (I / II / III).
- Alkohole trzeciorzędowe w normalnych warunkach (reagują / nie reagują) z większością utleniaczy. W opisanym doświadczeniu alkohol trzeciorzędowy dodano do roztworu znajdującego się w probówce (I / II / III).
Zadanie 149. (2 pkt)
Grupa −OH związana z pierścieniem benzenowym należy do podstawników o najsilniejszym działaniu aktywującym pierścień, kieruje podstawienie elektrofilowe w położenie orto i para. Reakcja bromowania fenolu zachodzi bardzo szybko nawet w łagodnych warunkach. Produktem końcowym jest tribromofenol. Produktem pośrednim jest dibromopochodna fenolu.
149.1 (0-1)
Spośród wzorów wybierz i podaj numer związku, który jest produktem pośrednim bromowania fenolu.
149.2 (0-1)
Badając charakter chemiczny fenolu, przeprowadzono reakcje chemiczne opisane
równaniami:
I C6H5OH + NaOH → C6H5ONa + H2O
II 2C6H5ONa + H2O + CO2 → 2C6H5OH + Na2CO3
Podaj dwa wnioski, które można sformułować na podstawie przebiegu powyższych reakcji.
Zadanie 150. (3 pkt)
Propan-2-ol i jego pochodne ulegają przemianom, które ilustruje schemat:
150.1 (0-1)
Podaj wzór półstrukturalny (grupowy) związku organicznego oznaczonego na schemacie numerem III i nazwę systematyczną związku organicznego oznaczonego numerem IV.
150.2 (0-1)
Określ typ reakcji (addycja, eliminacja, substytucja) oznaczonych na schemacie numerami 1. i 5.
150.3 (0-1)
Napisz w formie cząsteczkowej równanie reakcji oznaczonej na schemacie numerem 5. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 151. (2 pkt)
151.1 (0-1)
CH3CH(OH)CH3 + Cr2O2−7 + H+ → CH3COCH3 + Cr3+ + H2O
Napisz w formie jonowej, z uwzględnieniem liczby oddanych lub pobranych elektronów (zapis jonowo-elektronowy), równania procesu redukcji i procesu utleniania zachodzących podczas przemiany przedstawionej powyższym schematem.
151.2 (0-1)
Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
CH3CH(OH)CH3 + Cr2O2−7 + H+ → CH3COCH3 + Cr3+ + H2O
Zadanie 152. (1 pkt)
Poniżej przedstawiono wzory trzech alkoholi:
Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeżeli jest fałszywe.
| Zadanie | P/F | |
|---|---|---|
| 1. | Alkohole o podanych w informacji wzorach są homologami, ponieważ różnią się ułożeniem atomów węgla w łańcuchu węglowym. | |
| 2. | Alkohol, którego wzór oznaczono numerem II, jest alkoholem drugorzędowym. | |
| 3. | Stopień utlenienia atomu węgla połączonego z grupą –OH w cząsteczce związku I wynosi I, w cząsteczce związku II wynosi 0, a w cząsteczce w związku III jest równy –I. |
Zadanie 153. (1 pkt)
Poniżej przedstawiono wzory trzech alkoholi:
Uzupełnij poniższe zdania. Wybierz i podkreśl właściwe określenie w każdym nawiasie tak, aby zdania były prawdziwe.
- Alkohol, którego wzór oznaczono numerem I, powstaje w wyniku hydrolizy w środowisku zasadowym (1-chloro-2-metylopropanu / 2-chloro-2-metylopropanu).
- Alkohol, którego wzór oznaczono numerem II, w reakcji utleniania pod wpływem tlenku miedzi(II) daje (butanal/butanon).
- Alkohol, którego wzór oznaczono oznaczony numerem III, (ulega / nie ulega) reakcji utleniania pod wpływem tlenku miedzi(II).
Zadanie 154. (3 pkt)
Poniżej przedstawiono wzory trzech alkoholi:
Badając właściwości alkoholi o podanych wzorach,
przeprowadzono opisane poniżej doświadczenie.
Do probówek z alkoholami, których wzory oznaczono numerami I, II i III, włożono
rozżarzony drut miedziany pokryty czarnym nalotem tlenku miedzi(II).
154.1 (0-1)
Zapisz, jakie zmiany zaobserwowano w probówkach zawierających badane alkohole.
154.2 (0-1)
Napisz nazwy systematyczne produktów organicznych powstałych w reakcji tlenku miedzi(II) z alkoholami, których wzory oznaczono numerami I i II.
154.3 (0-1)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji przebiegającej w opisanym doświadczeniu z udziałem alkoholu, którego wzór oznaczono numerem II.
Zadanie 155. (2 pkt)
Badając właściwości związków organicznych, wykonano dwa doświadczenia: A i B.
Do wodnych roztworów związków organicznych wprowadzono świeżo wytrącony
wodorotlenek miedzi(II): w temperaturze pokojowej (doświadczenie A) i w podwyższonej
temperaturze (doświadczenie B), co ilustrują poniższe schematy:
Doświadczenie A
Doświadczenie B
155.1 (0-1)
Podaj numery probówek, w których w doświadczeniu A zaobserwowano zanik niebieskiego osadu i powstanie klarownego szafirowego roztworu. Uzasadnij swój wybór.
155.2 (0-1)
Podaj numery probówek, w których w doświadczeniu B zaobserwowano wytrącanie się ceglastego osadu. Uzasadnij swój wybór.
Zadanie 156. (2 pkt)
Trzy probówki napełniono wodą a następnie wprowadzono do nich wybrane trzy gazowe związki organiczne – każdy do innej probówki. Przebieg doświadczenia przedstawiono na schemacie:
156.1 (0-1)
Oceń, który z użytych w doświadczeniu gazów praktycznie nie rozpuści się w wodzie. Swoje przypuszczenie uzasadnij, odwołując się do właściwości cząsteczki tego gazu.
156.2 (0-1)
Podaj numer probówki, w której powstanie roztwór o pH większym od 7, i napisz równanie reakcji potwierdzającej taki wybór.
Zadanie 157. (4 pkt)
Przeprowadzono dwa doświadczenia, których celem było porównanie właściwości wodnych roztworów dwóch związków organicznych: metanalu i glukozy. Reakcje w doświadczeniu A prowadzono w podwyższonej temperaturze, a w doświadczeniu B reakcje przebiegały w temperaturze pokojowej. Doświadczenia przedstawiono za pomocą schematów:
157.1 (0-1)
Opisz możliwe do zaobserwowania zmiany potwierdzające obecność roztworu glukozy w probówce I i roztworu metanalu w probówce II w doświadczeniu A.
157.2 (0-1)
Opisz możliwe do zaobserwowania zmiany potwierdzające obecność roztworu glukozy w probówce I i roztworu metanalu w probówce II w doświadczeniu B.
157.3 (0-1)
Na podstawie przebiegu przeprowadzonych doświadczeń sformułuj dwa wnioski dotyczące właściwości badanych związków.
157.4 (0-1)
Wyjaśnij, pisząc odpowiednie równanie reakcji, dlaczego w doświadczeniu A można zaobserwować opisane w części a) zadania zmiany zachodzące w probówce II.
Zadanie 158. (2 pkt)
Poniżej przedstawiono ciąg przemian prowadzących do powstania kwasu karboksylowego. Związek oznaczony literą X jest chloropochodną węglowodoru.
Uzupełnij tabelę, wpisując wzory półstrukturalne (grupowe) związków organicznych oznaczonych na schemacie literami X, Y i Z.
| Związek X | Związek Y | Związek Z |
|---|---|---|
Zadanie 159. (1 pkt)
Poniżej przedstawiono ciąg przemian prowadzących do powstania kwasu karboksylowego. Związek oznaczony literą X jest chloropochodną węglowodoru.
Posługując się wzorami półstrukturalnymi (grupowymi) związków organicznych, napisz równanie reakcji chemicznej oznaczonej na schemacie numerem III oraz określ typ reakcji (addycja, eliminacja, substytucja) oznaczonej na schemacie numerem I.
Zadanie 160. (2 pkt)
W celu rozróżnienia wodnych roztworów kwasu metanowego (mrówkowego) i kwasu
etanowego (octowego) do probówek z roztworami tych kwasów dodano kilka kropli wodnego
roztworu kwasu siarkowego(VI) i wprowadzono odczynnik X wybrany spośród
następujących: wodny roztwór wodorotlenku sodu, wodny roztwór manganianu(VII) potasu,
wodny roztwór dichromianu(VI) potasu.
Przebieg doświadczenia ilustruje poniższy schemat.
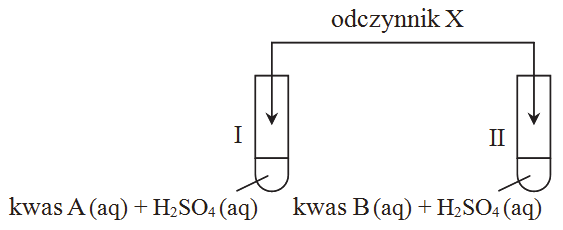
Zaobserwowano, że w probówkach I i II roztwory zabarwiły się na fioletowo. Pod wpływem ogrzewania otrzymany w probówce II roztwór odbarwił się, a mieszanina pieniła się. Stwierdzono, że wydzielał się gaz. Podczas ogrzewania roztworu otrzymanego w probówce I nie zaobserwowano zmian.
160.1 (0-1)
Podaj nazwę lub wzór użytego odczynnika.
160.2 (0-1)
Podaj nazwę kwasu A, którego roztwór znajdował się w probówce I i nazwę kwasu B, którego roztwór znajdował się w probówce II.
Zadanie 161. (2 pkt)
W celu rozróżnienia wodnych roztworów kwasu metanowego (mrówkowego) i kwasu
etanowego (octowego) do probówek z roztworami tych kwasów dodano kilka kropli wodnego
roztworu kwasu siarkowego(VI) i wprowadzono odczynnik X wybrany spośród
następujących: wodny roztwór wodorotlenku sodu, wodny roztwór manganianu(VII) potasu,
wodny roztwór dichromianu(VI) potasu.
Przebieg doświadczenia ilustruje poniższy schemat.

Zaobserwowano, że w probówkach I i II roztwory zabarwiły się na fioletowo. Pod wpływem ogrzewania otrzymany w probówce II roztwór odbarwił się, a mieszanina pieniła się. Stwierdzono, że wydzielał się gaz. Podczas ogrzewania roztworu otrzymanego w probówce I nie zaobserwowano zmian.
161.1 (0-1)
Podaj nazwę procesu, któremu ulega kwas B podczas opisanego doświadczenia oraz określ, jaką funkcję pełni ten kwas w zachodzącej reakcji.
161.2 (0-1)
Napisz wzory drobin powstałych w wyniku przemiany, której uległ kwas B i odczynnik X.
Zadanie 162. (2 pkt)
W celu zbadania właściwości kwasu metanowego przeprowadzono doświadczenie zilustrowane schematem:
Stwierdzono, że w probówce II wydzielił się bezbarwny gaz. Objawy reakcji zaobserwowano również w probówkach I i III.
162.1 (0-1)
Napisz, co zaobserwowano podczas przebiegu tego doświadczenia w probówkach I i III.
162.2 (0-1)
Napisz w formie cząsteczkowej, stosując wzory półstrukturalne (grupowe) związków organicznych, równania reakcji zachodzących podczas tego doświadczenia w probówkach II i III.
Zadanie 163. (1 pkt)
W celu zbadania właściwości kwasu metanowego przeprowadzono doświadczenie zilustrowane schematem:
Stwierdzono, że w probówce II wydzielił się bezbarwny gaz. Objawy reakcji zaobserwowano również w probówkach I i III.
Oceń, czy wykonanie w probówce I podobnej próby, w której zamiast kwasu metanowego użyjemy kwasu etanowego, doprowadzi do tego samego efektu. Swoją odpowiedź uzasadnij.
Zadanie 164. (1 pkt)
W celu zbadania właściwości kwasu metanowego przeprowadzono doświadczenie zilustrowane schematem:
Stwierdzono, że w probówce II wydzielił się bezbarwny gaz. Objawy reakcji zaobserwowano również w probówkach I i III.
Gaz, który wydzielił się w probówce II spalono, a produkt spalania (substancję X) poddano identyfikacji.
Dokończ zdanie. Wybierz i zaznacz nazwę odczynnika A lub B oraz spostrzeżenia 1. albo 2.
W celu identyfikacji substancji X wprowadzono ją do
| A. | wody wapiennej | i zaobserwowano | 1. | zmianę barwy roztworu. |
| B. | wody destylowanej | 2. | zmętnienie roztworu. |
Zadanie 165. (1 pkt)
W pracowni chemicznej znajduje się roztwór kwasu octowego o stężeniu 10% masowych. Zaprojektuj sposób postępowania, który pozwoli z tego roztworu otrzymać roztwór kwasu octowego o stężeniu 6% masowych. Dysponujesz: zlewką, w której znajduje się 200 g roztworu kwasu octowego o stężeniu 10% masowych, zlewką, w której znajduje się 500 g wody destylowanej, pustą zlewką o pojemności 0,5 dm3, szklaną bagietką oraz wagą laboratoryjną.
Zapisz odpowiednie obliczenia, które należy wykonać, aby otrzymać roztwór kwasu octowego o stężeniu 6% masowych z roztworu tego kwasu o stężeniu 10% masowych.
Zadanie 166. (1 pkt)
W pracowni chemicznej znajduje się roztwór kwasu octowego o stężeniu 10% masowych. Zaprojektuj sposób postępowania, który pozwoli z tego roztworu otrzymać roztwór kwasu octowego o stężeniu 6% masowych. Dysponujesz: zlewką, w której znajduje się 200 g roztworu kwasu octowego o stężeniu 10% masowych, zlewką, w której znajduje się 500 g wody destylowanej, pustą zlewką o pojemności 0,5 dm3, szklaną bagietką oraz wagą laboratoryjną.
Podaj (w odpowiedniej kolejności) opis wszystkich czynności wykonanych podczas doświadczenia, którego celem było otrzymanie roztworu kwasu octowego o stężeniu 6% masowych.
Zadanie 167. (2 pkt)
W pracowni chemicznej znajduje się roztwór kwasu octowego o stężeniu 10% masowych. Zaprojektuj sposób postępowania, który pozwoli z tego roztworu otrzymać roztwór kwasu octowego o stężeniu 6% masowych. Dysponujesz: zlewką, w której znajduje się 200 g roztworu kwasu octowego o stężeniu 10% masowych, zlewką, w której znajduje się 500 g wody destylowanej, pustą zlewką o pojemności 0,5 dm3, szklaną bagietką oraz wagą laboratoryjną.
Oblicz stężenie molowe roztworu kwasu octowego (o stężeniu 10,00% masowych) znajdującego się w zlewce, jeżeli gęstość tego roztworu wynosi 1,0121 g · cm–3 oraz stężenie molowe roztworu kwasu octowego (o stężeniu 6,00% masowych) otrzymanego po rozcieńczeniu, jeżeli jego gęstość wynosi 1,0066 g · cm–3.
Źródło: J. Sawicka i inni, Tablice Chemiczne, Gdańsk 2004, s. 224.
Zadanie 168. (3 pkt)
Pewien ester o wzorze sumarycznym C6H12O2 otrzymuje się w reakcji kwasu karboksylowego X z alkoholem Y w obecności kwasu siarkowego(VI). Alkohol Y jest alkoholem drugorzędowym, który utleniany dichromianem(VI) potasu w środowisku kwasowym daje propanon.
168.1 (0-1)
Napisz wzór półstrukturalny (grupowy) opisanego estru.
168.2 (0-1)
Kwasy karboksylowe ulegają dekarboksylacji, której przebieg można przedstawić ogólnym równaniem: R–COOH → R–H + CO2.
Posługując się wzorami półstrukturalnymi (grupowymi) związków organicznych, napisz równanie reakcji dekarboksylacji kwasu karboksylowego oznaczonego w informacji literą X.
168.3 (0-1)
W roztworze wodnym pewnego kwasu R–COOH o stężeniu cm = 0,2 mol · dm−3 stopień dysocjacji tego kwasu wynosi 2%.
Oblicz stałą dysocjacji kwasu.
Zadanie 169. (1 pkt)
Poniżej przedstawiono wzór pewnego związku organicznego.
Zaznacz odpowiedź poprawnie określającą nazwę grupy związków organicznych, do której zalicza się związek chemiczny o przedstawionym wzorze.
- Wyższe kwasy karboksylowe.
- Estry kwasów karboksylowych i alkoholi pierwszorzędowych.
- Estry kwasów karboksylowych i alkoholi drugorzędowych.
- Sole kwasów karboksylowych.
Zadanie 170. (1 pkt)
Poniżej przedstawiono wzór pewnego związku organicznego.
Zaznacz odpowiedź przedstawiającą poprawne nazwy systematyczne kwasu i alkoholu, z których powstał związek organiczny o podanym wzorze.
- kwas 2-metylopropanowy, propan-2-ol
- kwas 2-metylobutanowy, propan-1-ol
- kwas izopropanowy, propan-1-ol
- kwas izobutanowy, propan-2-ol
Zadanie 171. (1 pkt)
Poniżej przedstawiono wzór pewnego związku organicznego.
Na związek organiczny, którego wzór przedstawiono w informacji wstępnej, podziałano wodnym roztworem NaOH. W wyniku reakcji otrzymano 2 nowe związki organiczne oznaczone umownie literami A i B.
Uzupełnij tabelę, wpisując wzory półstrukturalne otrzymanych związków organicznych A i B oraz nazwę wiązania, które uległo rozpadowi w czasie opisanej reakcji chemicznej.
| Wzór półstrukturalny związku A | |
| Wzór półstrukturalny związku B | |
| Nazwa wiązania |
Zadanie 172. (2 pkt)
W celu zbadania właściwości związków organicznych o podanych poniżej wzorach, sporządzono wodne roztwory tych substancji o jednakowym stężeniu i zmierzono pH otrzymanych roztworów.
172.1 (0-1)
Uzupełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeżeli jest fałszywe.
| Zadanie | P/F | |
|---|---|---|
| 1. | Stężenie jonów wodorotlenkowych w roztworze wodnym substancji I jest większe niż w roztworze substancji II. | |
| 2. | Produktem redukcji substancji III jest substancja I. | |
| 3. | Substancja IV w roztworze wodnym ulega dysocjacji kwasowej i dysocjacji zasadowej. |
Związek, którego wzór oznaczono numerem III, poddano działaniu mieszaniny nitrującej i otrzymano jako główny produkt inny związek: jego cząsteczki zawierają 2 grupy funkcyjne. Grupa nitrowa jest podstawnikiem drugiego rodzaju i następny podstawnik kieruje w reakcji substytucji elektrofilowej w położenie meta.
172.2 (0-1)
Napisz wzór powstałego głównego produktu opisanej reakcji i podaj jego nazwę.
Zadanie 173. (2 pkt)
Jedna z metod otrzymywania aminokwasów z kwasów karboksylowych polega na przeprowadzeniu reakcji odpowiedniego kwasu karboksylowego z chlorem w obecności katalizatora (reakcja 1.), a następnie reakcji otrzymanego kwasu chlorokarboksylowego z nadmiarem amoniaku, co prowadzi do powstania aminokwasu (reakcja 2.).
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2008, s. 139.
173.1 (0-1)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania reakcji otrzymywania kwasu 2-aminopropanowego opisaną metodą.
173.2 (0-1)
Wymienione w informacji związki organiczne: aminokwas oraz kwas karboksylowy i kwas chlorokarboksylowy, z których opisaną metoda można aminokwas ten otrzymać, uszereguj zgodnie ze wzrostem wartości pH ich wodnych roztworów.
Zadanie 174. (2 pkt)
W wyniku polikondensacji mocznika z pewnym aldehydem powstaje tworzywo sztuczne, mające zastosowanie między innymi do wyrobu płyt laminowanych, produkcji blatów kuchennych, wytwarzania wykładzin mebli. Tworzywo należy do aminoplastów i ma wzór:
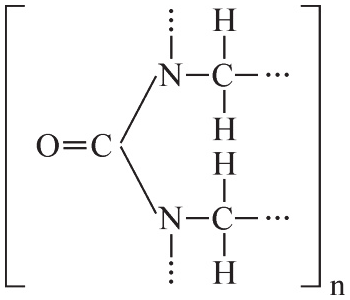
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2008, s. 128.
174.1 (0-1)
Napisz wzór strukturalny mocznika oraz aldehydu, który w reakcji polikondensacji z mocznikiem tworzy opisane tworzywo.
174.2 (0-1)
Wodny roztwór mocznika ogrzewano z dodatkiem stężonego kwasu siarkowego(VI). Zaobserwowano wydzielanie się pęcherzyków bezbarwnego gazu.
Napisz równanie opisanej reakcji.
Zadanie 175. (3 pkt)
Aminokwas treonina ulega w roztworze wodnym przemianom zgodnie z przedstawionym schematem:
175.1 (0-1)
Zaznacz poprawne dokończenie zdania.
O kierunku przemian zgodnie z podanym schematem decyduje
- stężenie treoniny w roztworze.
- pH roztworu.
- obecność katalizatora w roztworze.
- obecność wody jako rozpuszczalnika.
175.2 (0-2)
Napisz wzór soli, jaką tworzy treonina w wyniku działania na nią wodnego roztworu wodorotlenku sodu i określ, jakie właściwości (kwasowe czy zasadowe) aminokwas ten wykazuje w opisanej reakcji.
Wzór soli:
Właściwości treoniny:
Zadanie 176. (4 pkt)
Aminokwas alanina w roztworze wodnym o zasadowym odczynie ulega reakcji zgodnie z zapisem:
176.1 (0-1)
Wypełnij tabelę, wpisując wzory kwasów i zasad Brønsteda, które w tej reakcji tworzą sprzężone pary.
| Sprzężona para | |
| kwas | zasada |
| |
|
| |
|
Punkt izoelektryczny aminokwasów to takie pH roztworu, przy którym aminokwas występuje w postaci soli wewnętrznej.
176.2 (0-1)
Podaj wzór jonu, w którego postaci alanina występuje w roztworach wodnych o pH > 7 i wzór jonu, w którego postaci aminokwas ten występuje w roztworach wodnych o pH < 5.
176.3 (0-1)
Napisz równanie reakcji tworzenia dipeptydu o nazwie glicyloalanina Gly-Ala.
176.4 (0-1)
Dokończ zdanie, zaznaczając wniosek A lub B i jego uzasadnienie 1. lub 2.
Badając właściwości alaniny, stwierdzono, że alanina
| A. | jest | związkiem optycznie czynnym, | 1. | ponieważ w jej cząsteczce występuje asymetryczny atom węgla. |
| B. | nie jest | 2. | ponieważ w jej cząsteczce nie występuje asymetryczny atom węgla. |
Zadanie 177. (2 pkt)
Do probówek zawierających wodny roztwór białka kurzego dodano stężony roztwór kwasu azotowego(V) do probówki I i roztwór azotanu(V) ołowiu(II) do probówki II. Zaobserwowano zmiany w obu probówkach świadczące o przebiegu reakcji chemicznych.
177.1 (0-1)
Opisz zaobserwowane zmiany, które świadczą o tym, że w obu probówkach zaszła reakcja chemiczna.
177.2 (0-1)
Napisz nazwy dwóch aminokwasów dających w reakcji ze stężonym HNO3 taki sam efekt, jaki zaobserwowano w probówce I.
Zadanie 178. (1 pkt)
Uczniowie przeprowadzili dwuetapowe doświadczenie. I etap doświadczenia zilustrowali schematem:
Po ochłodzeniu zneutralizowali nadmiar kwasu wodorotlenkiem sodu i przeprowadzili II etap doświadczenia, według schematu:
Podczas II etapu doświadczenia zaobserwowali powstanie ceglastoczerwonego osadu.
Stosując wzory sumaryczne związków, napisz uproszczone równanie reakcji zachodzącej podczas I etapu doświadczenia. Zaznacz warunki prowadzenia procesu.
Zadanie 179. (2 pkt)
Uczniowie przeprowadzili dwuetapowe doświadczenie. I etap doświadczenia zilustrowali schematem:
Po ochłodzeniu zneutralizowali nadmiar kwasu wodorotlenkiem sodu i przeprowadzili II etap doświadczenia, według schematu:
Podczas II etapu doświadczenia zaobserwowali powstanie ceglastoczerwonego osadu.
Uczniowie przedstawili cel doświadczenia i na podstawie przyjętych założeń oraz obserwacji sformułowali wniosek.
| Cel doświadczenia | Wniosek | |
|---|---|---|
| Uczeń 1. | Sprawdzenie, czy skrobia ma właściwości redukujące. | Skrobia ma właściwości redukujące. |
| Uczeń 2. | Sprawdzenie, czy produktem hydrolizy skrobi jest glukoza. | Produktem hydrolizy skrobi jest glukoza. |
Przedstawione przez uczniów cele doświadczenia i wnioski są błędne.
179.1 (0-1)
Wyjaśnij, dlaczego podane przez uczniów cele doświadczenia oraz sformułowane na podstawie obserwacji i przyjętych celów wnioski są błędne.
179.2 (0-1)
Podaj poprawny cel opisanego doświadczenia i na podstawie przyjętych założeń oraz obserwacji sformułuj wniosek wynikający z tego doświadczenia.
Zadanie 180. (2 pkt)
Na rysunku przedstawiono wzory dwóch wybranych disacharydów:
180.1 (0-1)
Uzupełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeżeli jest fałszywe.
| Zdanie | P/F | |
|---|---|---|
| 1. | Przedstawiony powyżej disacharyd I składa się z reszty α-D-glukopiranozy i reszty β-D-glukopiranozy, a disacharyd II z dwóch reszt α-D-glukopiranozy. | |
| 2. | W reakcji z zawiesin Cu(OH)2 obu disacharydów w temperaturze pokojowej niebieski osad znika i powstaje klarowny szafirowy roztwór. | |
| 3. | Reszty monosacharydowe w cząsteczkach obu disacharydów połączone są wiązaniem O-glikozydowym. |
180.2 (0-1)
Uzupełnij poniższe zdania. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie tak, aby zdania były prawdziwe.
- Przedstawiony na rysunku disacharyd I (ma właściwości redukujące/nie ma właściwości redukujących), a disacharyd II (ma właściwości redukujące/nie ma właściwości redukujących).
- Związek oznaczony numerem II (jest/nie jest) optycznie czynny.
- W procesie hydrolizy disacharydu oznaczonego numerem I powstaje równomolowa mieszanina (galaktozy i glukozy/glukozy i fruktozy).
Zadanie 181. (2 pkt)
Zaprojektuj doświadczenie, którego przebieg pozwoli na identyfikację skrobi znajdującej się w wodnej zawiesinie mąki ziemniaczanej.
181.1 (0-1)
Uzupełnij schemat doświadczenia, wpisuj c nazw odczynnika wybranego spośród następujących:
wodny roztwór KMnO4 z zasadą sodową, woda bromowa Br2 (aq), I2 w wodnym roztworze KI.
181.2 (0-1)
Napisz, jaka możliwa do zaobserwowania zmiana potwierdzi obecności skrobi w mące ziemniaczanej.
Zadanie 182. (1 pkt)
Uzupełnij poniższe zdania. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie tak, aby zdania były prawdziwe.
- Cząsteczki skrobi składają się z reszt glukozy połączonych wiązaniami (α-glikozydowymi/β-glikozydowymi).
- Liczba reszt glukozy w cząsteczkach skrobi jest (większa/mniejsza) od liczby reszt glukozy w cząsteczkach celulozy.
- Skrobia jest cukrem zapasowym (roślinnym/zwierzęcym).