Chemia - Zbiór zadań problemowych CKE, Poziom rozszerzony (Formuła 2023) - Zadanie 1.
O atomie pierwiastka X wiadomo, że:
- 20 spośród wszystkich elektronów w atomie opisanych jest liczbą kwantową 𝑙 = 2
- elektrony walencyjne atomu X w stanie podstawowym opisane są dwiema różnymi wartościami pobocznej liczby kwantowej (𝑙 = 0 i 𝑙 = 1), przy czym liczba elektronów walencyjnych opisanych poboczną liczbą kwantową 𝑙 = 1 jest większa, niż liczba elektronów walencyjnych opisanych poboczną liczbą kwantową 𝑙 = 0
- tylko jeden z elektronów walencyjnych jest niesparowany.
Pierwiastek X reaguje z chlorem, w wyniku czego powstaje związek, w którym procentowa masowa zawartość chloru wynosi 45,6%.
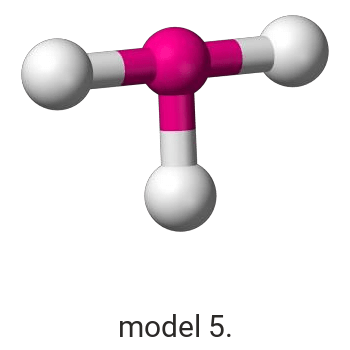
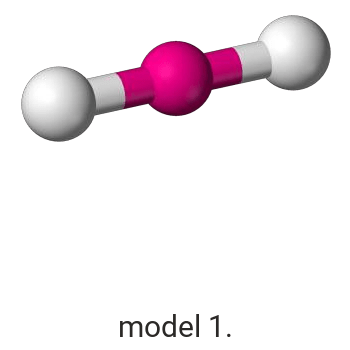
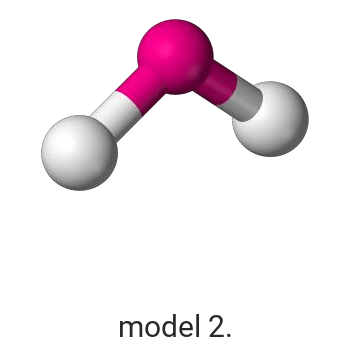
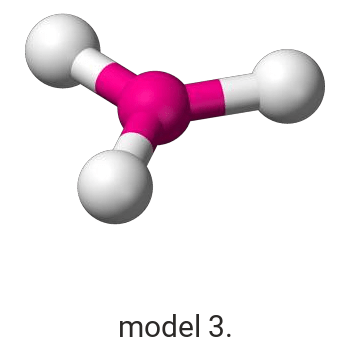
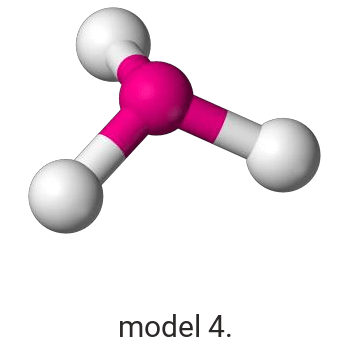
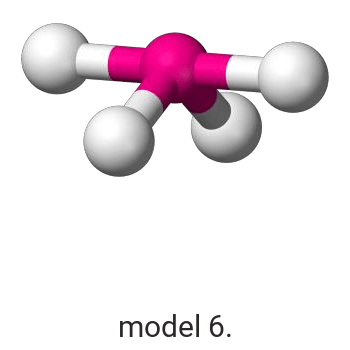
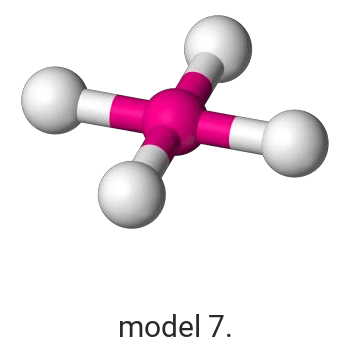
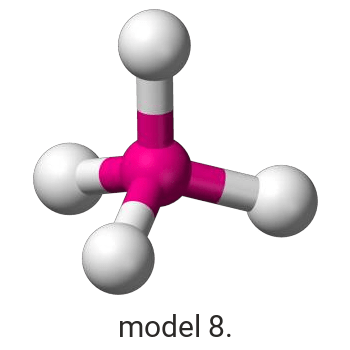
Wykonaj odpowiednie obliczenia i wskaż model, który przedstawia budowę przestrzenną cząsteczki związku pierwiastka X z chlorem.
Model:
Rozwiązanie
Zasady oceniania
4 pkt – rozwiązanie zawierające poprawnie zastosowaną metodę prowadzącą do określenia budowy przestrzennej opisanej cząsteczki.
3 pkt – poprawna identyfikacja pierwiastka X, poprawne wyznaczenie wzoru sumarycznego związku pierwiastka X z chlorem, poprawne narysowanie wzoru elektronowego, ale jego błędna interpretacja.
ALBO
– poprawne narysowanie wzoru elektronowego, ale nieprawidłowe określenie budowy przestrzennej opisanej cząsteczki.
2 pkt – poprawna identyfikacja pierwiastka X, poprawne wyznaczenie wzoru sumarycznego związku pierwiastka X z chlorem.
ALBO
– poprawna identyfikacja pierwiastka X, poprawne wyznaczenie wzoru sumarycznego związku pierwiastka X z chlorem, poprawne narysowanie wzoru elektronowego, ale jego błędna interpretacja oraz nieprawidłowe określenie budowy przestrzennej opisanej cząsteczki.
1 pkt – poprawna identyfikacja pierwiastka X.
ALBO
– poprawna identyfikacja pierwiastka X, ale błędne wyznaczenie wzoru sumarycznego związku pierwiastka X z chlorem.
0 pkt – rozwiązanie całkowicie błędne albo brak rozwiązania.
Przykładowe rozwiązanie
Z pierwszej informacji w zadaniu wnioskujemy, że pierwiastek X leży w grupie 12 lub w bloku
p, w piątym okresie układu okresowego: 20 elektronów opisanych poboczną liczbą kwantową
𝑙 = 2 sugeruje całkowite zapełnienie orbitali 3d (10 e–) oraz 4d (10 e–). Pierwiastkiem X mogą więc być: Cd, In, Sn, Sb, Te, I, Xe.
Z drugiej informacji wnioskujemy, że elektrony walencyjne atomu X zajmują podpowłokę s (𝑙 = 0) i p (𝑙 = 1), tak więc pierwiastek ten musi leżeć w bloku p układu okresowego. Skoro liczba elektronów zajmujących podpowłokę p jest większa od liczby elektronów zajmujących podpowłokę s (jest większa od 2), to pierwiastkiem X może być Sb, Te, I, Xe.
Trzecia informacja pozwala na jednoznaczną identyfikację pierwiastka X: tylko atom jodu ma jeden niesparowany elektron:
Wzór ogólny związku pierwiastka X z chlorem możemy zapisać jako: ICl𝑛
%Cl = 𝑛 ∙ 35,5126,9 + 𝑛 ∙ 35,5 = 0,456
n = 3
Uwzględniając fakt, że atom chloru ma 7 elektronów walencyjnych, możemy narysować wzór elektronowy cząsteczki ICl3:
Liczba przestrzenna = 𝐿σ+ 𝐿wolne pary e– = 3 + 2 = 5
Model poprawnie przedstawiający budowę przestrzenną cząsteczki ICl3: