Chemia - Matura Czerwiec 2023, Poziom rozszerzony (Formuła 2023) - Zadanie 14.
Poniżej przedstawiono informacje pozwalające porównać moc trzech substancji, które wykazują kwasowy charakter chemiczny w roztworach wodnych (𝑇 = 25 °C, 𝑝 = 1000 hPa):
| Substancja (H2X) | p𝐾𝑎1 | p𝐾𝑎2 |
|---|---|---|
| benzeno-1,2-diol, C6H4(OH)2 | 9,34 | 12,6 |
| kwas butanodiowy, HOOC–(CH2)2–COOH | 4,21 | 5,64 |
| tlenek siarki(IV), SO2 (aq, nas.), [H2SO3] | 1,85 | 7,20 |
Próbkę wodnego roztworu każdej z substancji (analitu) o objętości 10,0 cm3 i stężeniu molowym 0,020 mol ∙ dm–3, umieszczano w kolbie i miareczkowano roztworem titranta: NaOH (aq) o stężeniu molowym 0,020 mol ∙ dm–3. Krzywe miareczkowania oznaczone literami A, B i C przedstawiono na wykresie.
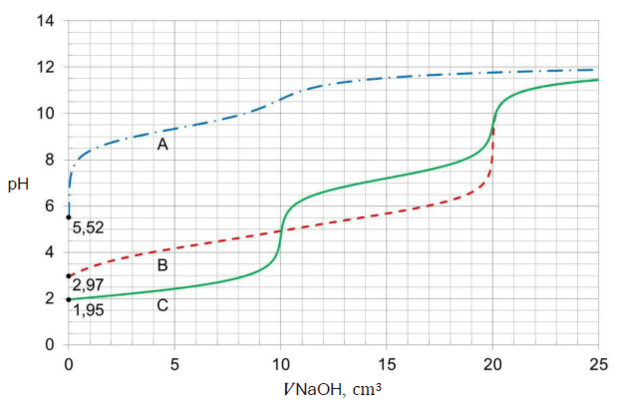
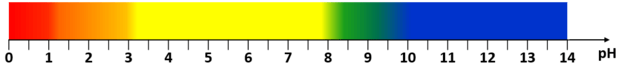
Punkt równoważnikowy (PR) to punkt na krzywej miareczkowania odpowiadający takiej ilości titranta, która jest równoważna stechiometrycznej ilości analitu. W pobliżu PR podczas miareczkowania zachodzą wyraźne zmiany wartości pH, zwane skokiem miareczkowania. Schemat przedstawia zmiany barwy wskaźnika kwasowo-zasadowego – błękitu tymolowego – w roztworach o różnej wartości pH (zakresy zmiany barwy: 1,2– 2,8 oraz 8,0– 9,6):
Oceń, prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Krzywa C obrazuje zmiany pH podczas miareczkowania najmocniejszego kwasu, a krzywa A – zmiany pH podczas miareczkowania kwasu pośredniej mocy spośród wymienionych. | P | F |
| 2. | W przebiegu krzywej B jest widoczny jeden skok miareczkowania, a pH w punkcie równoważnikowym miareczkowania okazuje się większe od 7. | P | F |
Rozwiązanie
Zasady oceniania
1 pkt – poprawne zaznaczenie dwóch odpowiedzi.
0 pkt – odpowiedź niespełniająca powyższego kryterium albo brak odpowiedzi.
Rozwiązanie
1. F; 2. P
