Biologia - Matura Maj 2017, Poziom rozszerzony (Formuła 2015) - Zadanie 1.
Na schemacie przedstawiono fragment cząsteczki białka o strukturze III-rzędowej oraz warunkujące tę strukturę różne oddziaływania występujące pomiędzy łańcuchami bocznymi aminokwasów: wiązania chemiczne oparte na przyciąganiu elektrostatycznym (1), wiązania kowalencyjne (2), interakcje hydrofobowe (3) i oddziaływania jonowe (4).
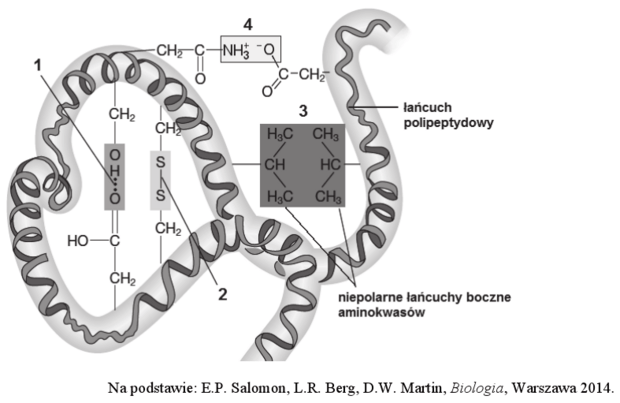
1.1. (0–1)
Podaj nazwy wiązań chemicznych stabilizujących III-rzędową strukturę białka, oznaczonych na schemacie numerami 1. i 2.
1.2. (0–1)
Na przykładzie enzymów białkowych wyjaśnij, w jaki sposób struktura przestrzenna białka warunkuje jego funkcję katalityczną. W odpowiedzi uwzględnij mechanizm działania enzymów.
Rozwiązanie
1.1. (0–1)
Schemat punktowania
1 p. – za podanie dwóch właściwych nazw wiązań chemicznych.
0 p. – za każdą inną odpowiedź lub za brak odpowiedzi.
Rozwiązanie
- (wiązanie) wodorowe
- mostek disiarczkowy / dwusiarczkowy / disulfidowy lub (wiązanie) disiarczkowe / disulfidowe
Uwaga:
Odpowiedź do uznania: 1. mostek wodorowy.
Nie uznaje się odpowiedzi: 2. wiązanie kowalencyjne / kowalencyjne niespolaryzowane / mostek siarczkowy / siarkowe / siarczkowe / tiolowe / sulfonowe.
1.2. (0–1)
Schemat punktowania
1 p. – za poprawne wyjaśnienie uwzględniające (1) odpowiednią konformację łańcucha lub
centrum aktywne, (2) dopasowanie przestrzenne enzymu i substratu (specyficzność
substratową enzymu), (3) obniżenie energii aktywacji reakcji lub zachodzenie
określonej reakcji (specyficzność reakcji).
0 p. – za odpowiedź, która nie spełnia powyższych wymagań, lub za brak odpowiedzi.
Przykładowe rozwiązania
- Do utworzonego centrum aktywnego enzymu „pasują” określone substraty i zachodzi konkretna reakcja.
- Odpowiednia struktura przestrzenna enzymu warunkuje specyficzność kompleksu enzym-substrat (E-S), co zapewnia powstanie konkretnego produktu.
- Dzięki odpowiedniemu sfałdowaniu łańcucha polipeptydowego enzymy przyłączają w centrum aktywnym substraty na zasadzie dopasowania przestrzennego, dzięki czemu obniżona zostaje energia aktywacji reakcji.
- W centrum aktywnym enzymu występują określone łańcuchy boczne aminokwasów z różnych odcinków peptydu, co warunkuje przyłączenie odpowiednich substratów i zachodzenie konkretnej reakcji, np. hydrolizy.
Uwaga:
Nie uznaje się odpowiedzi odnoszących się wyłącznie do dopasowania przestrzennego enzymu i substratu bez określenia, jakie ma to znaczenie dla mechanizmu działania enzymu, lub tłumaczących katalizę jedynie przyspieszaniem reakcji (tautologia).
