Chemia - Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 35.
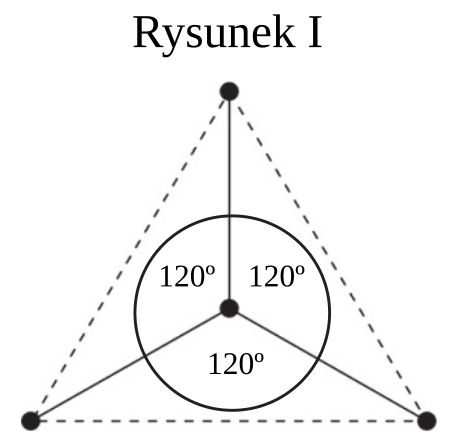
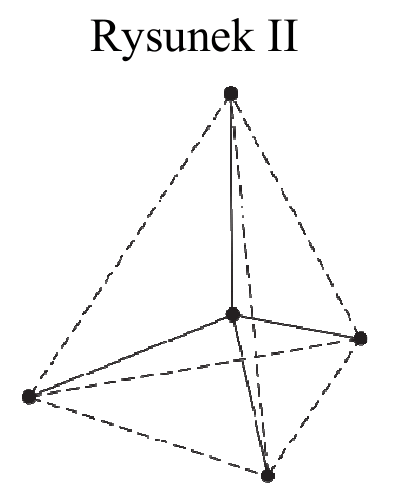
Na rysunkach przedstawiono przestrzenne rozmieszczenie wiązań chemicznych tworzonych przez orbitale zhybrydyzowane atomów węgla w cząsteczkach dwóch węglowodorów. Punktami schematycznie oznaczono położenie środków atomów połączonych tymi wiązaniami, linią ciągłą – osie wiązań, a linią przerywaną – kontury figury geometrycznej, w której narożach znajdują się atomy otaczające atom centralny. Hybrydyzacja polegająca na wymieszaniu 1 orbitalu s oraz 3 orbitali p daje hybrydyzację tetraedryczną ze względu na skierowanie orbitali zhybrydyzowanych ku narożom tetraedru. Wymieszanie 1 orbitalu s oraz 2 orbitali p daje hybrydyzację trygonalną. Wiązania utworzone za pomocą tych orbitali leżą w tej samej płaszczyźnie, a kąty pomiędzy nimi wynoszą 120°.
| a) | Spośród odczynników wymienionych poniżej wybierz wszystkie te, które pozwolą na odróżnienie węglowodoru o strukturze przestrzennej przedstawionej na rysunku I od węglowodoru o strukturze przedstawionej na rysunku II. |
Br2 (aq), KMnO4 (aq), świeżo wytrącony Cu(OH)2, KOH (aq) i roztwór fenoloftaleiny
| b) | Napisz, jakie zmiany możliwe do zaobserwowania podczas reakcji każdego wybranego odczynnika z węglowodorami o strukturach przedstawionych na rysunkach I i II, pozwalają na odróżnienie tych węglowodorów. |
| c) | Uzasadnij swój wybór odczynników, pisząc odpowiednie równania reakcji. |
Rozwiązanie
Wybrane odczynniki: Br2 (aq), KMnO4 (aq).
Przykłady poprawnych odpowiedzi
Opis możliwych do zaobserwowania zmian:
- dla Br2 (aq): w przypadku etenu: odbarwienie wody bromowej lub zanik pomarańczowego (lub brunatnego) zabarwienia; w przypadku metanu: brak objawów reakcji,
- dla KMnO4 (aq): w przypadku etenu: wytrącanie się brązowego osadu lub zanik fioletowego zabarwienia roztworu lub odbarwienie roztworu; w przypadku metanu: brak objawów reakcji.
CH2=CH2 + Br2 → CH2Br–CH2Br
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2(OH)–CH2(OH) + 2MnO2 + 2KOH
Wskazówki
Rozwiązując to zadanie, wykorzystaj informacje z poprzedniego rozwiązania. Znając typ hybrydyzacji atomów węgla w prostych cząsteczkach węglowodorów i odpowiadającą im strukturę, można zidentyfikować te związki. Rysunek I przedstawia strukturę przestrzenną etenu, rysunek II – metanu. W cząsteczce etenu występuje wiązanie π, jest on więc bardziej reaktywny niż metan, w którego cząsteczkach obecne są tylko pojedyncze wiązania σ. Wykrywaniu wiązania π w cząsteczce węglowodoru nienasyconego służy reakcja z wodą bromową lub z wodnym roztworem manganianu(VII) potasu. Należy przypomnieć, że związek nienasycony bierze udział w reakcjach addycji dzięki obecności wiązania π w jego cząsteczkach. W reakcji z wodą bromową atomy bromu zostają przyłączone do atomów węgla po rozerwaniu wiązania π i woda bromowa odbarwia się. Woda bromowa Br2 (aq) ma barwę brunatnopomarańczową (w zależności od stężenia bromu barwa ta jest jaśniejsza lub ciemniejsza). Roztwór KMnO4 o zabarwieniu fioletowym ma właściwości utleniające i utlenia eten do alkoholu dihydroksylowego, a sam redukuje się do MnO2, obserwujemy powstawanie brunatnego osadu. Na podstawie obserwacji można napisać odpowiednie równania reakcji, pamiętając o dobraniu współczynników stechiometrycznych.