Chemia - Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 79.
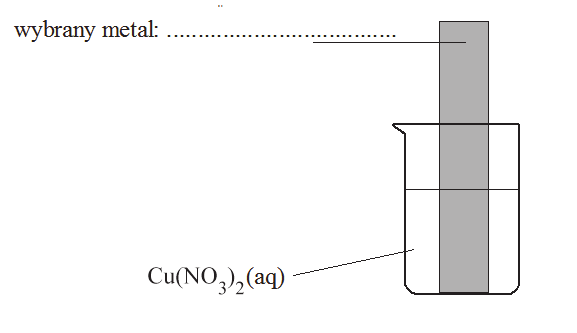
Oczyszczoną blaszkę wykonaną z pewnego metalu zważono, a następnie zanurzono w wodnym roztworze Cu(NO3)2. Zauważono, że powierzchnia blaszki znajdująca się w roztworze pokryła się różowym nalotem o metalicznym połysku. Po pewnym czasie blaszkę wyjęto z roztworu, osuszono i zważono. Stwierdzono, że masa blaszki po wyjęciu z roztworu była mniejsza od jej masy początkowej. Roztwór w zlewce pozostał klarowny i nie zaobserwowano w nim żadnego osadu.
Uzupełnij schemat wykonania doświadczenia, wpisując nazwę lub symbol metalu, z którego była wykonana blaszka. Metal wybierz spośród podanych poniżej.
Nazwa metalu: glin, nikiel, ołów, srebro.
Schemat wykonania doświadczenia:
Rozwiązanie
ołów
Wskazówki
W opisanym doświadczeniu zachodzi reakcja metalu z jonami innego metalu (Cu2+)
obecnymi w roztworze. Aby wybrać metal, który spełnia warunki zadania, trzeba sprawdzić,
który z wymienionych metali reaguje z roztworem soli miedzi(II) oraz – jeżeli reaguje –
w jakim stosunku masowym reakcja ta zachodzi. Zdolność reagowania z jonami Cu2+,
a dokładniej ich redukcji, mają te metale, które w szeregu napięciowym znajdują się przed
miedzią. Spośród metali wymienionych w zadaniu warunek ten spełniają glin, nikiel i ołów.
Do stwierdzenia, który z nich został użyty w opisanym doświadczeniu, potrzebne jest
określenie stosunku masowego wynikającego z równania reakcji zachodzącej w czasie
doświadczenia. Masa substancji jest równa iloczynowi liczby moli i masy molowej tej
substancji, a więc masa wydzielonej miedzi mCu = nCu · MCu, a masa roztworzonego metalu
mMe = nMe · MMe. Masy molowe miedzi, glinu, niklu i ołowiu odczytujemy z układu
okresowego pierwiastków chemicznych (wystarczy zaokrąglenie ich wartości do liczb
całkowitych):
MCu = 64 g · mol–1, MAl = 27 g · mol–1, MNi = 59 g · mol–1, MPb = 207 g · mol–1.
W napisaniu równania reakcji znów pomocny będzie szereg napięciowy metali, ponieważ podane są w nim wzory kationów metali, które w reakcji powstają: widać, że zarówno nikiel, jak i ołów tworzą jony dwudodatnie (Ni2+, Pb2+), a glin – jony trójdodatnie (Al3+), z czego wynika, że reakcja jonów miedzi(II) z niklem i ołowiem przebiega według schematu:
Cu2+ + Me → Cu + Me2+, a więc nCu2+nMe = 11,
czyli nCu2+nMe = nCu2+ ⋅ MCunMe ⋅ MMe = MCuMMe
Reakcja jonów miedzi(II) z glinem przebiega zgodnie z równaniem:
3Cu2+ + 2Al → 3Cu + 2Al3+, z którego wynika, że nCu2+nAl = 23 nAl, dlatego
mCu2+mAl = nCu2+ ⋅ MCunAl ⋅ MAl = 32 nAl ⋅ MCunAl ⋅ MAl = 3MCu2MAl = 3 ⋅ 64 g ⋅ mol−12 ⋅ 27 g ⋅ mol−1 ≈ 3,6 ,
co oznacza, że masa wydzielonej miedzi jest ok. 3,6 razy większa od masy roztworzonego glinu. Ponieważ w czasie doświadczenia stwierdzono, że masa blaszki po wyjęciu z roztworu była mniejsza od jej masy początkowej, oznacza to, że masa wydzielonej miedzi była mniejsza od masy metalu, który się roztworzył, zatem na pewno nie mógł to być glin. Pozostaje więc sprawdzenie stosunku masowego dla reakcji z niklem i ołowiem:
dla niklu mCu2+mNi = MCuMNi = 64 g ⋅ mol−159 g ⋅ mol−1 ≈ 1,1 ,
czyli masa roztworzonego niklu jest nieznacznie mniejsza od masy wydzielonej miedzi;
dla ołowiu mCu2+mPb = MCuMPb = 64 g ⋅ mol−1207 g ⋅ mol−1 ≈ 0,3 ,
czyli masa roztworzonego ołowiu jest znacznie większa od masy wydzielonej miedzi. Metalem tym był więc ołów.
