Chemia - Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 142.
Poniżej podano wzory czterech wybranych węglowodorów.
142.1 (0-1)
Uzupełnij poniższe zdania. Wybierz i podkreśl numery, którymi oznaczono wzory wszystkich związków spełniających warunki zadania.
- Wzór ogólny CnH2n określa skład węglowodorów oznaczonych numerami (I / II / III / IV).
- Izomerami konstytucyjnymi są węglowodory oznaczone numerami (I / II / III / IV).
- W temperaturze pokojowej węglowodory oznaczone numerami (I / II / III / IV) to nierozpuszczalne w wodzie gazy, dla których charakterystyczne są reakcje substytucji rodnikowej.
142.2 (0-1)
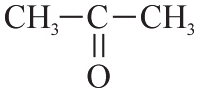
Podaj wzór produktu reakcji związku II z wodą w obecności HgSO4 i H2SO4.
142.3 (0-1)
Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F – jeżeli jest fałszywe.
| Zadanie | P/F | |
|---|---|---|
| 1. | Związek IV powstaje w reakcji addycji 2 moli wodoru do 1 mola związku I lub 1 mola wodoru do 1 mola związku II. | |
| 2. | W reakcji związku I z roztworem manganianu(VII) potasu w środowisku obojętnym powstaje związek organiczny, którego cząsteczki zawierają 2 grupy hydroksylowe. | |
| 3. | W reakcji całkowitego spalenia 1 mola każdego z podanych węglowodorów liczba moli powstającej wody jest największa w przypadku spalania związku III. |
Wskazówki
142.1 (0-1)
W informacji podano wzory półstrukturalne związków organicznych zaliczanych do alkanów, cykloalkanów, alkenów i alkinów. Na tej podstawie można wyprowadzić wzór sumaryczny każdego węglowodoru, a potem wzór ogólny grupy związków.
| alkan | cykloalkan | alken | alkin |
| C3H8 | C3H6 | C3H6 | C3H4 |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 |
Z podanego zestawienia wynika, że wzór CnH2n mają cykloalkany i alkeny, do których należą związki oznaczone numerami I i III, są to propen i cyklopropan. Związki te są izomerami konstytucyjnymi, bo mając ten sam wzór sumaryczny, różnią się budową. Reakcjami charakterystycznymi dla związków organicznych nasyconych są reakcje substytucji, dla związków nienasyconych charakterystyczne są reakcje addycji.
142.2 (0-1)
Związek II czyli propyn ulega reakcjom addycji (przyłączania). Reakcja addycji zachodzi kosztem wiązania potrójnego, końcowy produkt jest związkiem nasyconym. Przyłączenie cząsteczek wody do cząsteczek propynu w obecności soli rtęci i kwasu siarkowego(VI) prowadzi do otrzymania ketonu, w tym wypadku do propanonu o wzorze CH3COCH3.
142.3 (0-1)
Wiedząc, do jakiej grupy węglowodorów należą poszczególne związki i jakie reakcje są dla nich charakterystyczne, można stwierdzić, czy podane zdania są prawdą, czy fałszem. Addycja wodoru do węglowodorów nienasyconych prowadzi do powstania alkanu. Cząsteczka propenu ma 1 wiązanie podwójne i może przyłączyć tylko 1 cząsteczkę wodoru. Cząsteczka propynu ma wiązanie potrójne, może więc przyłączyć 2 cząsteczki wodoru, a przyłączając tylko 1, przekształci się w propen, a nie propan. Propen ulega utlenieniu, dając alkohol dihydroksylowy. Całkowite spalanie węglowodorów prowadzi do otrzymania tlenku węgla(IV) i wody. Najwięcej cząsteczek wody powstanie ze spalenia węglowodoru, którego cząsteczka zawiera największą liczbę atomów wodoru, a więc propanu, a nie cyklopropanu. Przebieg reakcji spalania ilustrują poniższe równania:
C3H8 + 5O2 → 3CO2 + 4H2O
C3H6 + 4,5O2 → 3CO2 + 3H2O
C3H4 + 4O2 → 3CO2 + 2H2O