Test diagnostyczny (matura próbna) Grudzień 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 3. (2 pkt)
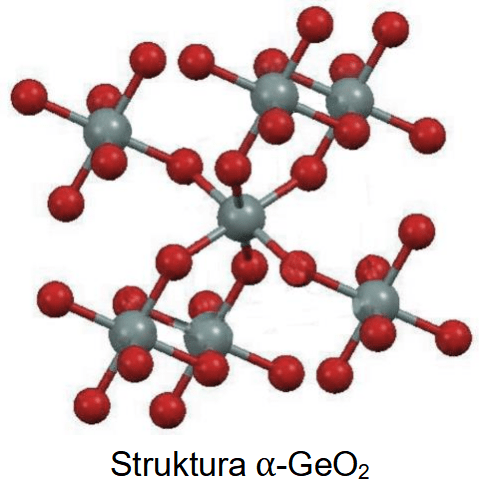
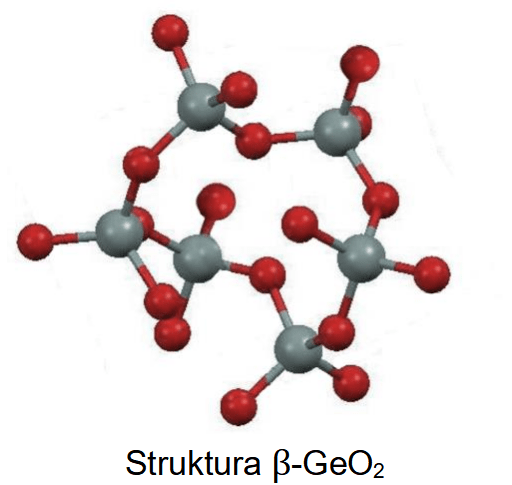
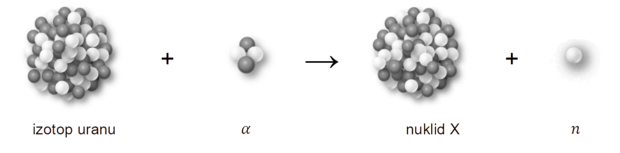
Atomy tlenu i atomy fluoru tworzą aniony o konfiguracji tego samego gazu szlachetnego. W tabeli przedstawiono modele atomu tlenu i atomu fluoru oraz ich prostych jonów. Dana barwa modelu odnosi się do konkretnego pierwiastka.
Uzupełnij tabelę. Napisz symbol atomu lub wzór jonu, który odpowiada każdemu z przedstawionych modeli.