Chemia - Matura Maj 2024, Poziom rozszerzony (Formuła 2023)
Zadanie 1. (6 pkt)
Pierwiastki A i X leżą w sąsiednich okresach. Wiadomo, że:
- elektrony w atomie A w stanie podstawowym są rozmieszczone w pięciu podpowłokach
- w atomie X w stanie podstawowym wszystkie elektrony biorące udział w tworzeniu wiązań są niesparowane i rozmieszczone na powłokach opisanych różnymi wartościami głównej liczby kwantowej 𝑛.
Cząsteczka tlenku pierwiastka A na najwyższym stopniu utlenienia składa się z czternastu atomów, a jej wzór rzeczywisty nie jest wzorem elementarnym. Ten tlenek w reakcji z wodą – przebiegającej bez zmiany stopni utlenienia – tworzy trójprotonowy kwas tlenowy. Liczba atomów wchodzących w skład cząsteczki wodorku pierwiastka A jest równa liczbie atomów wchodzących w skład cząsteczki tlenku pierwiastka X na najwyższym stopniu utlenienia.
1.1. (0–2)
Uzupełnij tabelę. Napisz symbole pierwiastków A i X – oraz dla każdego z nich – najwyższy stopień utlenienia w związkach chemicznych i liczbę elektronów niesparowanych w atomie w stanie podstawowym.
| Symbol pierwiastka | Najwyższy stopień utlenienia w związkach chemicznych | Liczba elektronów niesparowanych w atomie | |
|---|---|---|---|
| Pierwiastek A | |||
| Pierwiastek X |
1.2. (0–1)
Uzupełnij poniższy schemat, tak aby przedstawiał graficzny (klatkowy) zapis konfiguracji elektronowej kationu X3+ w stanie podstawowym. W zapisie uwzględnij numery powłok i symbole podpowłok.
1.3. (0–3)
Uzupełnij tabelę i napisz równania reakcji:
- w formie cząsteczkowej – tlenku pierwiastka A na najwyższym stopniu utlenienia z wodą (reakcja 1.)
- w formie jonowej – tlenku pierwiastka X na najwyższym stopniu utlenienia z wodorotlenkiem potasu (reakcja 2.).
Użyj symboli A i X.
| Wzór sumaryczny wodorku pierwiastka A | Wzór sumaryczny tlenku pierwiastka A na najwyższym stopniu utlenienia | Wzór sumaryczny tlenku pierwiastka X na najwyższym stopniu utlenienia |
|---|---|---|
Równanie reakcji 1.:
Równanie reakcji 2.:
Zadanie 2. (2 pkt)
Znanych jest kilkadziesiąt izotopów galu, które powstają w różnych reakcjach jądrowych, ale tylko nieliczne z nich są trwałe. Promieniotwórcze izotopy galu zwykle ulegają rozpadowi 𝛽–, jeżeli mają nadmiar neutronów, lub innym przemianom – przy niedomiarze neutronów.
2.1. (0–1)
Izotop galu o liczbie masowej równej 72 ulega rozpadowi 𝛽–.
Uzupełnij poniższy schemat. Wpisz symbol pierwiastka, którego izotop powstaje w wyniku opisanej przemiany, oraz liczbę masową tego izotopu.
2.2. (0–1)
Izotop 67Ga otrzymuje się w wyniku bombardowania izotopu cynku 68Zn pewnymi cząstkami. W reakcji jednego jądra 68Zn z jedną taką cząstką powstają dwa neutrony i jedno jądro 67Ga.
Napisz równanie opisanej przemiany, której ulega jądro izotopu 68Zn. Uzupełnij wszystkie pola w poniższym schemacie.
Zadanie 3. (1 pkt)
Energia sieciowa związków jonowych to ilość energii potrzebna do rozłożenia jednego mola krystalicznej substancji na jony leżące nieskończenie daleko od siebie. Jej wartość zależy od rozmiarów jonów i ich ładunków. Wraz ze wzrostem energii sieciowej rosną wartości temperatury topnienia substancji krystalicznych.
W tabeli przedstawiono wartości energii sieciowej halogenków wybranych litowców.
| Substancja | Energia sieciowa, kJ ∙ mol−1 | Substancja | Energia sieciowa, kJ ∙ mol−1 |
|---|---|---|---|
| LiF | 1033 | NaF | 915 |
| LiCl | 𝑥 | NaCl | 778 |
| LiBr | 798 | NaBr | 𝑦 |
| LiI | 740 | NaI | 692 |
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Energia sieciowa 𝑥 chlorku litu wynosi około (640 / 740 / 840) kJ ∙ mol−1, a energia sieciowa 𝑦 bromku sodu wynosi około (640 / 740 / 840) kJ ∙ mol−1. Temperatura topnienia chlorku sodu jest równa 801 °C, a temperatura topnienia jodku sodu jest równa (662 / 882) °C.
Zadanie 4. (1 pkt)
Energia sieciowa związków jonowych to ilość energii potrzebna do rozłożenia jednego mola krystalicznej substancji na jony leżące nieskończenie daleko od siebie. Jej wartość zależy od rozmiarów jonów i ich ładunków. Wraz ze wzrostem energii sieciowej rosną wartości temperatury topnienia substancji krystalicznych.
W tabeli przedstawiono wartości energii sieciowej halogenków wybranych litowców.
| Substancja | Energia sieciowa, kJ ∙ mol−1 | Substancja | Energia sieciowa, kJ ∙ mol−1 |
|---|---|---|---|
| LiF | 1033 | NaF | 915 |
| LiCl | 𝑥 | NaCl | 778 |
| LiBr | 798 | NaBr | 𝑦 |
| LiI | 740 | NaI | 692 |
W poniższej tabeli przedstawiono wartości energii sieciowej dwóch związków oraz promieni tworzących je jonów.
| Wzór związku | Energia sieciowa, kJ ∙ mol−1 | Promień kationu, pm | Promień anionu, pm |
|---|---|---|---|
| MgO | 3934 | 76 | 140 |
| LiF | 1033 | 72 | 133 |
Wyjaśnij, dlaczego – mimo zbliżonych rozmiarów jonów – energia sieciowa tlenku magnezu różni się znacznie od energii sieciowej fluorku litu.
Zadanie 5. (1 pkt)
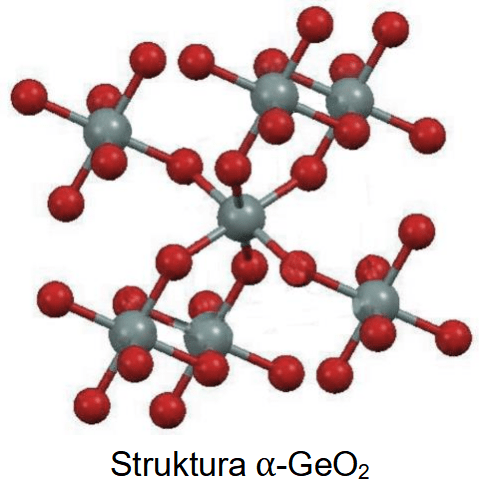
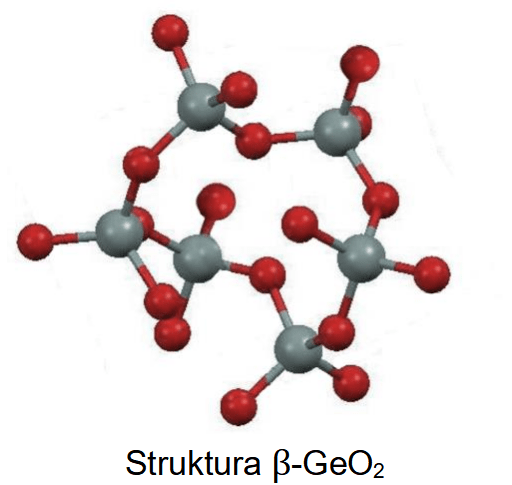
Liczba koordynacyjna to liczba najbliższych atomów lub jonów otaczających dany atom lub jon w sieci krystalicznej kryształu.
Tlenek germanu(IV) jest krystalicznym ciałem stałym. Istnieje w dwóch odmianach: alfa, α-GeO2, oraz beta, β-GeO2. Fragmenty struktur obu odmian przedstawiono poniżej (atomy Ge – szare, atomy O – czerwone).
Uzupełnij zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
W odmianie α-GeO2 liczba koordynacyjna dla atomu germanu wynosi (dwa / cztery / sześć). W strukturze odmiany β-GeO2 dla orbitali walencyjnych atomu germanu zakłada się hybrydyzację (sp2 / sp3).
Zadanie 6. (3 pkt)
Nadtlenek wodoru jest to substancja nietrwała, którą należy przechowywać w zimnym i ciemnym miejscu, gdyż w innych warunkach ulega powolnemu rozkładowi. Postęp rozkładu nadtlenku wodoru można badać np. za pomocą techniki miareczkowania.
W termostatowanym naczyniu umieszczono roztwór H2O2 o pewnym stężeniu, który utrzymywano w temperaturze 40 °C. W równych odstępach czasowych z tego roztworu pobierano próbki, które schładzano i miareczkowano za pomocą zakwaszonego roztworu manganianu(VII) potasu o stężeniu 0,0020 mol ∙ dm−3. Podczas miareczkowania zachodziła reakcja opisana równaniem:
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
Wyznaczenie objętości zużytego roztworu KMnO4 pozwoliło obliczyć stężenie molowe H2O2 w próbce.
Objętość każdej pobieranej próbki była równa 2,0 cm3. Uzyskane wyniki przedstawiono w tabeli.
| Czas, minuty | 0 | 10 | 20 | 30 |
| Objętość KMnO4, cm3 | 19,1 | 14,2 | 9,9 | 6,2 |
6.1. (0–2)
Uzupełnij poniższą tabelę, a następnie narysuj wykres przedstawiający zależność stężenia nadtlenku wodoru od czasu. Wartość stężenia zapisz w zaokrągleniu do trzeciego miejsca po przecinku.
| Czas, minuty | 0 | 10 | 20 | 30 |
| Stężenie molowe H2O2, mol ∙ dm−3 | 0,048 | 0,036 |
Obliczenia pomocnicze:
6.2. (0–1)
Uzupełnij zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Szybkość reakcji rozkładu nadtlenku wodoru wraz z upływem czasu (rośnie / maleje /
nie ulega zmianie).
Szybkość reakcji rozkładu nadtlenku wodoru w temperaturze 40 °C jest (większa niż /
mniejsza niż / taka sama jak) w temperaturze 20 °C.
Zadanie 7. (2 pkt)
Reakcja kwasu solnego z wodorotlenkiem baru przebiega zgodnie z równaniem:
H3O+ + OH– → 2H2O
Oblicz, ile cm3 wodnego roztworu wodorotlenku baru o stężeniu molowym równym 0,020 mol ∙ dm−3 należy dodać do 25 cm3 kwasu solnego o pH = 1,5, aby otrzymany roztwór miał pH równe 3,7. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
Zadanie 8. (2 pkt)
Zmieszano równe objętości dwóch wodnych roztworów: azotanu(V) srebra(I) o stężeniu c1 = 1 ∙ 10−4 mol ∙ dm−3 i chlorku potasu o stężeniu c2 = 2 ∙ 10−6 mol ∙ dm−3. Podczas doświadczenia utrzymywano temperaturę równą 25 °C.
Uzupełnij poniższe zdania. Wpisz wartość iloczynu stężeń kationów srebra(I) i anionów chlorkowych po zmieszaniu roztworów oraz wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Iloczyn stężeń kationów srebra(I) i anionów chlorkowych w otrzymanej mieszaninie jest równy . Jego wartość jest (mniejsza / większa) od wartości iloczynu rozpuszczalności chlorku srebra(I), dlatego osad tej soli się (nie wytrąci / wytrąci).
Obliczenia pomocnicze:
Zadanie 9. (2 pkt)
Zbadano odczyn wodnych roztworów trzech soli: NaHCO3, ZnCl2 i CH3COONH4 za pomocą uniwersalnych papierków wskaźnikowych. Wyniki doświadczenia pokazano na zdjęciu.

9.1. (0–1)
Uzupełnij tabelę. Przyporządkuj numery probówek do wzorów badanych soli.
| Wzór soli | Numer probówki |
|---|---|
| NaHCO3 | |
| ZnCl2 | |
| CH3COONH4 |
9.2. (0–1)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | W roztworze znajdującym się w probówce 1. reakcji z wodą uległy aniony, a w roztworze, który umieszczono w probówce 3., reakcji z wodą uległy kationy. | P | F |
| 2. | W roztworze, który umieszczono w probówce 2., reakcji z wodą uległy zarówno kationy, jak i aniony. | P | F |
Zadanie 10. (2 pkt)
W 150 cm3 wodnego roztworu chlorku manganu(II) o stężeniu molowym 𝑐 = 0,678 mol ∙ dm−3 i gęstości 𝑑 = 1,07 g ∙ cm−3 rozpuszczono 6,00 g hydratu tej soli o wzorze MnCl2 ∙ 4H2O.
Oblicz, jaki procent masy otrzymanego roztworu stanowi masa chlorku manganu(II).
Załóż, że objętość roztworu się nie zmieniła. Przyjmij wartości mas molowych:
MMnCl2 = 126 g ∙ mol–1 oraz MMnCl2 ∙ 4H2O = 198 g ∙ mol–1.
Zadanie 11. (2 pkt)
Jony FeO2–4 mogą powstać podczas reakcji Fe(OH)3 z jonami ClO– w nasyconym roztworze NaOH, zilustrowanej poniższym schematem:
Fe(OH)3 + ClO– + OH– → FeO2–4 + Cl– + H2O
Napisz w formie jonowej skróconej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie reakcji utleniania zachodzącej podczas opisanej przemiany. Uwzględnij środowisko reakcji. Uzupełnij współczynniki stechiometryczne w poniższym schemacie.
Równanie reakcji utleniania:
Fe(OH)3 + ClO– + OH– → FeO2–4 + Cl– + H2O
Zadanie 12. (2 pkt)
Poniżej przedstawiono równania reakcji, które przebiegają w wybranych półogniwach redoks.
| Półogniwo | Równanie reakcji elektrodowej |
|---|---|
| A | MnO−4 (aq) + 8H+ (aq) + 5e− ⇄ Mn2+ (aq) + 4H2O |
| B | Fe3+ (aq) + e− ⇄ Fe2+ (aq) |
W tych półogniwach elementem przewodzącym jest platyna – nie bierze ona udziału w reakcji elektrodowej.
12.1. (0–1)
Uzupełnij poniższy zapis, tak aby powstał schemat ogniwa galwanicznego zbudowanego z półogniw A i B, które generuje prąd w warunkach standardowych. Napisz, które półogniwo pełni funkcję anody, a które – katody w pracującym ogniwie.
funkcja
półogniwa
funkcja
półogniwa
12.2. (0–1)
Napisz w formie jonowej sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie zbudowanym z półogniw A i B.
Zadanie 13. (3 pkt)
Stężeniowa stała równowagi reakcji zilustrowanej poniższym równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g) Δ𝐻 > 0
w temperaturze T wynosi 1,0.
13.1. (0–1)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Zwiększenie ciśnienia w warunkach izotermicznych (T = const) w opisanym układzie będącym w stanie równowagi będzie skutkowało wzrostem wydajności reakcji otrzymywania tlenku węgla(II) i pary wodnej. | P | F |
| 2. | Obniżenie temperatury w warunkach izobarycznych (p = const) w opisanym układzie będącym w stanie równowagi będzie skutkowało zmniejszeniem wartości stałej równowagi reakcji otrzymywania tlenku węgla(II) i pary wodnej. | P | F |
13.2. (0–2)
W reaktorze o pojemności 1,0 dm3 zmieszano w temperaturze T tlenek węgla(IV) i wodór. Sumaryczna liczba moli tych reagentów była równa 10.
Oblicz początkową liczbę moli tlenku węgla(IV) i początkową liczbę moli wodoru w mieszaninie, jeżeli wiadomo, że do momentu ustalenia się stanu równowagi w temperaturze T przereagowało 60% wodoru.
Zadanie 14. (1 pkt)
Poniżej przedstawiono wzory półstrukturalne wybranych węglowodorów – związków X, Y i Q.
W reakcji związku X z bromowodorem powstaje mieszanina związków A i B. Ogrzewanie związku A w alkoholowym roztworze wodorotlenku potasu prowadzi do otrzymania związku X jako jedynego produktu organicznego reakcji eliminacji.
Napisz nazwę systematyczną związku A i narysuj wzór półstrukturalny (grupowy) związku B.
| Nazwa systematyczna związku A: | Wzór związku B: |
|---|---|
Zadanie 15. (1 pkt)
Poniżej przedstawiono wzory półstrukturalne wybranych węglowodorów – związków X, Y i Q.
Rozstrzygnij, czy główny produkt addycji wody do związku Y w obecności katalizatora H3O+ jest taki sam jak główny produkt addycji wody do związku Q prowadzonej w tych samych warunkach. Odpowiedź uzasadnij. W uzasadnieniu odnieś się do konsekwencji różnicy w budowie cząsteczek.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 16. (2 pkt)
Poniżej przedstawiono wzory półstrukturalne wybranych węglowodorów – związków X, Y i Q.
Utlenianie alkenów w zakwaszonym wodnym roztworze KMnO4 przebiega w podwyższonej temperaturze zgodnie ze schematem:
16.1. (0–1)
Jednym z produktów utleniania związku X, Y albo Q jest keton. Napisz nazwę systematyczną alkenu, którego jednym z produktów utleniania jest keton, i narysuj wzór półstrukturalny (grupowy) tego ketonu.
| Nazwa systematyczna alkenu: | Wzór ketonu: |
|---|---|
16.2. (0–1)
W reakcji utleniania węglowodoru X powstają dwa związki organiczne różniące się wartością stałej dysocjacji 𝐾a.
Wybierz związek, który ma wyższą wartość stałej dysocjacji 𝐾a, i napisz wzór półstrukturalny (grupowy) organicznego produktu reakcji tego związku z wodorotlenkiem potasu.
Zadanie 17. (2 pkt)
Cykloalkany ulegają analogicznym reakcjom jak alkany.
Benzen, cykloheksan i styren to węglowodory, które w temperaturze pokojowej są
bezbarwnymi cieczami. Ich wzory przedstawiono poniżej:
W trzech naczyniach znajdowały się oddzielnie i w przypadkowej kolejności: benzen, cykloheksan i styren. W celu identyfikacji tych substancji wykonano dwuetapowe doświadczenie. W pierwszym etapie do trzech probówek zawierających wodny roztwór manganianu(VII) potasu w środowisku obojętnym wprowadzono po jednej z badanych substancji. Następnie każdą probówkę zamknięto korkiem i wstrząśnięto. Po pewnym czasie zawartości probówek przybrały wygląd pokazany na zdjęciach.
W pierwszym etapie zidentyfikowano jeden z trzech węglowodorów. W drugim etapie doświadczenia do próbek niezidentyfikowanych węglowodorów wprowadzono stężony kwas azotowy(V) z dodatkiem stężonego kwasu siarkowego(VI) – i ogrzano zawartości probówek. Wyniki drugiego etapu doświadczenia przedstawiono na poniższych zdjęciach.
17.1. (0–1)
Napisz wzór sumaryczny związku manganu, który powstał w wyniku reakcji zachodzącej w pierwszym etapie doświadczenia, oraz wzór półstrukturalny (grupowy) lub uproszczony organicznego produktu tej przemiany.
| Wzór związku manganu | Wzór produktu organicznego |
|---|---|
17.2. (0–1)
Napisz równanie reakcji, która umożliwiła odróżnienie związków w drugim etapie doświadczenia.
Zadanie 18. (1 pkt)
Na poniższym schemacie zilustrowano dwuetapowy proces otrzymywania PVC – poli(chlorku winylu) – z acetylenu (etynu).
Etyn stosowany w tej reakcji powstaje w wyniku działania wody na acetylenek wapnia, stanowiący główny składnik karbidu.
Podczas spalania PVC powstają tlenek węgla(IV), para wodna i bezbarwny gaz o ostrym zapachu, którego cząsteczki są zbudowane z dwóch atomów. Stosunek molowy produktów spalania jest równy 𝑛CO2 ∶ 𝑛H2O ∶ 𝑛X = 2 : 1 : 1.
Uzupełnij poniższy schemat, tak aby otrzymać równanie reakcji spalania, w której uczestniczy fragment PVC zbudowany z czterech merów.
Zadanie 19. (2 pkt)
Na poniższym schemacie zilustrowano dwuetapowy proces otrzymywania PVC – poli(chlorku winylu) – z acetylenu (etynu).
Etyn stosowany w tej reakcji powstaje w wyniku działania wody na acetylenek wapnia, stanowiący główny składnik karbidu.
Reakcja acetylenku wapnia CaC2 z wodą przebiega według równania:
CaC2 + 2H2O → C2H2 + Ca(OH)2
Oblicz, ile gramów karbidu, zawierającego 82% CaC2, potrzeba do otrzymania 100 g PVC. Całkowita wydajność procesu jest równa 78%.
Zadanie 20. (3 pkt)
Przemiany katalizowane przez jeden z produktów są nazywane reakcjami
autokatalitycznymi.
Reakcja jodowania acetonu, prowadzona w roztworze wodnym w obecności jonów
hydroniowych, przebiega w dwóch etapach:
W etapie 1. zachodzą powolne przemiany prowadzące do powstania enolu. Etap 2. to szybka reakcja enolu z jodem, której produkt przekształca się w jodoaceton.
20.1. (0–1)
Napisz, który etap: 1. czy 2., opisanego mechanizmu jodowania acetonu, decyduje o szybkości powstawania produktu. Wpisz właściwy numer poniżej.
20.2. (0–1)
Napisz w formie jonowej sumaryczne równanie reakcji jodowania acetonu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
20.3. (0–1)
Napisz wzór drobiny, która pełni funkcję katalizatora w reakcji jodowania acetonu. Rozstrzygnij, czy reakcja jodowania acetonu jest zaliczana do reakcji autokatalitycznych.
Katalizator:
Rozstrzygnięcie:
Zadanie 21. (3 pkt)
Przygotowano próbki czterech kwasów:
- CH3COOH
- CH2ClCOOH
- CHCl2COOH
- CCl3COOH
Wszystkie roztwory miały jednakową objętość. Stężenie molowe każdego kwasu było równe 1 mol ∙ dm–3. Do roztworów tych kwasów, znajdujących się w probówkach w przypadkowej kolejności, dodano po pięć kropli roztworu fioletu metylowego, który jest wskaźnikiem pH. Wyniki doświadczenia przedstawiono na zdjęciach.
Fragment skali barw dla fioletu metylowego w roztworach o różnym pH przedstawia poniższy rysunek.
Wartości p𝐾a dla kwasów użytych w doświadczeniu, podane w przypadkowej kolejności, wynoszą: 2,87; 4,76; 0,66; 1,35.
21.1. (0–2)
Na podstawie informacji wstępnej wybierz probówkę, w której znajduje się roztwór najmocniejszego kwasu, i dokończ zdania.
Roztwór najmocniejszego kwasu znajduje się w probówce oznaczonej literą .
Wzór tego kwasu to:
wzór półstrukturalny (grupowy)
Wyjaśnij, dlaczego wybrany kwas wykazuje największą moc. W wyjaśnieniu odwołaj się do budowy cząsteczek tego związku.
Wyjaśnienie:
21.2. (0–1)
Uzupełnij tabelę. Napisz wzór półstrukturalny (grupowy) najsłabszego kwasu użytego w tym doświadczeniu oraz wartość p𝐾a tego kwasu.
| Wzór kwasu | Wartość p𝐾a |
|---|---|
Zadanie 22. (1 pkt)
Chlorki kwasowe otrzymuje się przez podstawienie grupy –OH kwasu karboksylowego atomem chloru. Zazwyczaj stosuje się w tym celu chlorek tionylu o wzorze SOCl2, ponieważ produkty nieorganiczne – tlenek siarki(IV) oraz chlorowodór – są gazami i można je łatwo oddzielić od produktu organicznego.
Chlorki kwasowe to bardzo reaktywne pochodne kwasów karboksylowych. Ich reakcje z alkoholami przebiegają szybko i praktycznie nieodwracalnie. Ten proces można zilustrować równaniem:
R1COCl + R2–OH → R1COOR2 + HCl
Napisz równanie reakcji otrzymywania chlorku benzoilu opisaną metodą. Zastosuj wzór półstrukturalny (grupowy) lub uproszczony odpowiedniego kwasu karboksylowego.
Zadanie 23. (1 pkt)
Chlorki kwasowe otrzymuje się przez podstawienie grupy –OH kwasu karboksylowego atomem chloru. Zazwyczaj stosuje się w tym celu chlorek tionylu o wzorze SOCl2, ponieważ produkty nieorganiczne – tlenek siarki(IV) oraz chlorowodór – są gazami i można je łatwo oddzielić od produktu organicznego.
Chlorki kwasowe to bardzo reaktywne pochodne kwasów karboksylowych. Ich reakcje z alkoholami przebiegają szybko i praktycznie nieodwracalnie. Ten proces można zilustrować równaniem:
R1COCl + R2–OH → R1COOR2 + HCl
Wyjaśnij, dlaczego reakcja powstawania estru z chlorku kwasowego i alkoholu zachodzi z większą wydajnością niż reakcja otrzymywania identycznego estru z kwasu karboksylowego i alkoholu w obecności H2SO4. W odpowiedzi porównaj przebieg obu reakcji.
Zadanie 24. (4 pkt)
Na poniższym schemacie przedstawiono ciąg przemian związków organicznych A, B i C:
24.1. (0–2)
Napisz wzory półstrukturalne (grupowe) związków oznaczonych na schemacie literami A, B i C.
| Związek A | Związek B | Związek C |
|---|---|---|
24.2. (0–2)
Określ typ reakcji (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji oznaczonych na schemacie numerami 1. i 2.
| Typ reakcji | Mechanizm reakcji | |
|---|---|---|
| Reakcja 1. | ||
| Reakcja 2. |
Zadanie 25. (4 pkt)
Trzy związki organiczne X, Y i Q są izomerami o masie molowej równej 90 g ∙ mol–1. W wyniku spalenia 45 mg jednego z tych związków otrzymano 27 mg wody oraz 36,0 cm3 tlenku węgla(IV) odmierzonego w temperaturze 293 K i pod ciśnieniem 1013 hPa.
O cząsteczkach tych związków wiadomo, że:
- szkielet każdej z cząsteczek stanowią połączone atomy węgla
- cząsteczki związków X i Y są chiralne, a związku Q – achiralne
- cząsteczki związków Y i Q mają takie same grupy funkcyjne
- odczyn wodnego roztworu związku X jest obojętny, a odczyn wodnego roztworu związku Y – kwasowy.
Przeprowadzono następujące doświadczenie: do próbki związku X wprowadzono zawiesinę świeżo strąconego Cu(OH)2, wymieszano (na zimno), a następnie ogrzano. Wyniki tego eksperymentu zilustrowano na poniższych zdjęciach.
Na podstawie obliczeń ustal wzór elementarny i rzeczywisty (sumaryczny) opisanych
związków.
Następnie napisz:
- wzory półstrukturalne (grupowe) związków X i Y
- w formie cząsteczkowej równanie reakcji związku Q z wodorotlenkiem sodu.
Zastosuj wzory półstrukturalne (grupowe) związków organicznych. Uniwersalna stała gazowa R = 83,14 hPa ∙ dm3 ∙ mol−1 ∙ K−1.
Wzór sumaryczny związków:
| Wzór półstrukturalny związku X | Wzór półstrukturalny związku Y |
|---|---|
Równanie reakcji związku Q z wodorotlenkiem sodu:
Zadanie 26. (1 pkt)
Przeprowadzono reakcje zgodnie ze schematem:
Wpisz do schematu wzory odpowiednich drobin, tak aby powstało równanie reakcji 3. w formie jonowej skróconej. Zastosuj definicję kwasu i zasady Brønsteda.
Zadanie 27. (1 pkt)
Przeprowadzono reakcje zgodnie ze schematem:
Organiczny związek otrzymany w reakcji 3. zmieszano z bromem (w stosunku molowym 1 : 1) i poddano reakcji w obecności światła.
Narysuj wzór półstrukturalny lub uproszczony organicznego produktu opisanej reakcji i uzupełnij zdanie. Wybierz i zaznacz właściwą odpowiedź spośród podanych w nawiasie.
Opisana przemiana (jest / nie jest) reakcją utlenienia-redukcji.
Zadanie 28. (2 pkt)
Przeprowadzono doświadczenie zilustrowane na poniższym rysunku:
Uzupełnij poniższe schematy, tak aby powstały wzory półstrukturalne (grupowe) fenyloalaniny w postaci, w której ten aminokwas będzie występował w dominującej formie w roztworze w każdej probówce.
Zadanie 29. (1 pkt)
Degradacja Ruffa to dwuetapowa reakcja, która pozwala na skrócenie łańcucha cząsteczki aldozy o jeden atom węgla. Pierwszy etap procesu to utlenienie aldozy do kwasu aldonowego za pomocą wody bromowej. W drugim etapie kwas aldonowy jest utleniany nadtlenkiem wodoru w obecności siarczanu(VI) żelaza(III), co prowadzi do otrzymania aldozy o krótszym łańcuchu węglowym i tlenku węgla(IV).
Poniżej przedstawiono schemat degradacji Ruffa, w której D-glukoza przekształca się w D-arabinozę:
Rozstrzygnij, czy degradacja Ruffa D-mannozy prowadzi do otrzymania tej samej aldopentozy, co degradacja Ruffa D-glukozy. Odpowiedź uzasadnij. W uzasadnieniu porównaj budowę cząsteczek obu aldoheksoz.
Wzór D-mannozy:
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 30. (1 pkt)
Degradacja Ruffa to dwuetapowa reakcja, która pozwala na skrócenie łańcucha cząsteczki aldozy o jeden atom węgla. Pierwszy etap procesu to utlenienie aldozy do kwasu aldonowego za pomocą wody bromowej. W drugim etapie kwas aldonowy jest utleniany nadtlenkiem wodoru w obecności siarczanu(VI) żelaza(III), co prowadzi do otrzymania aldozy o krótszym łańcuchu węglowym i tlenku węgla(IV).
Poniżej przedstawiono schemat degradacji Ruffa, w której D-glukoza przekształca się w D-arabinozę:
Degradacji Ruffa poddano jeden ze związków, których wzory przedstawiono poniżej. Powstały cukier utleniono kwasem azotowym(V) i otrzymano związek, którego cząsteczki są achiralne – kwas mezo-winowy.
Wybierz cukier, którego użyto do przeprowadzenia opisanego doświadczenia, i napisz nazwę tego cukru.