Chemia - Zadania dodatkowe matury dwujęzycznej (tłumaczenie BiologHelp) Maj 2024, Poziom rozszerzony (Formuła 2023)
Zadania dodatkowe matury dwujęzycznej z maja 2024 przetłumaczone z języka angielskiego na polski (tłumaczenie BiologHelp).
Zadanie 1. (2 pkt)
W przyrodzie występuje pięć stabilnych izotopów cynku. Najbardziej rozpowszechniony jest izotop, którego jądro zawiera 34 neutrony.
1.1. (0–1)
Uzupełnij poniższy schemat. Wpisz liczbę atomową i symbol cynku oraz liczbę masową najpowszechniejszego izotopu tego pierwiastka.
1.2. (0–1)
Znanych jest kilka promieniotwórczych izotopów cynku. Jednym z nich jest izotop o liczbie masowej A = 72, który ulega rozpadowi β−.
Napisz równanie rozpadu β− izotopu cynku o liczbie masowej A = 72. Uzupełnij poniższy schemat.
Zadanie 2. (2 pkt)
Poniższy schemat przedstawia graficzny (klatkowy) zapis konfiguracji elektronowej pewnego pierwiastka X w stanie podstawowym.
2.1. (0–1)
Uzupełnij poniższą tabelę. Wpisz nazwę lub symbol pierwiastka X, jego numer grupy w układzie okresowym oraz symbol bloku, do którego należy ten pierwiastek.
| Nazwa pierwiastka | Numer grupy | Symbol bloku konfiguracyjnego |
|---|---|---|
2.2. (0–1)
Pierwiastek X występuje w związkach chemicznych między innymi w postaci jonów X2+.
Uzupełnij poniższy zapis konfiguracji elektronowej jonu X2+ w stanie podstawowym.
1s2 2s2 2p6 3s2 3p6
Zadanie 3. (1 pkt)
Poniżej podano wzory substancji stałych o strukturze krystalicznej w temperaturze 25°C i pod ciśnieniem 1013 hPa.
Spośród poniższych substancji wybierz wszystkie te, które tworzą kryształy jonowe. Zaznacz wybrane substancje.
Zadanie 4. (2 pkt)
Uzupełnij poniższe zdanie dotyczące charakteru wiązania między atomem azotu a atomem wodoru. Wybierz i zaznacz poprawną odpowiedź spośród podanych w nawiasie. Następnie określ hybrydyzację orbitali walencyjnych atomu azotu w cząsteczce amoniaku i narysuj wzór elektronowy kreskowy (wzór Lewisa) tej cząsteczki: zaznacz kreskami pary elektronowe wiązań chemicznych oraz wolne pary elektronowe.
Wiązanie azot – wodór jest (jonowe / kowalencyjne / kowalencyjne spolaryzowane).
Hybrydyzacja orbitali walencyjnych atomu azotu:
Wzór elektronowy kreskowy:
Zadanie 5. (1 pkt)
Fosfor tworzy wodorek zwany fosfiną (fosfanem) o wzorze PH3. Cząsteczka tego związku ma strukturę podobną do cząsteczki amoniaku. W tabeli podano wartości masy cząsteczkowej oraz temperatury wrzenia (p = 1013 hPa) amoniaku i fosfiny.
| Nazwa związku | Masa cząsteczkowa, u | Temperatura wrzenia, °C |
|---|---|---|
| amoniak | 17 | -33,33 |
| fosfina | 34 | -87,75 |
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
W temperaturze 25 °C i pod ciśnieniem 1013 hPa gęstość fosfanu jest (mniejsza / większa) od
gęstości amoniaku. Fosfan jest substancją (mniej / bardziej) lotną niż amoniak, ponieważ
oddziaływania między cząsteczkami fosfanu są (słabsze / silniejsze) niż między cząsteczkami
amoniaku.
Zadanie 6. (1 pkt)
W roztworze wodnym nadtlenek wodoru rozkłada się zgodnie z równaniem:
2H2O2 (aq) → 2H2O (c) + O2 (g)
Reakcja ta zachodzi powoli, stąd trudno zauważyć wydzielanie się tlenu.
Badano zależność szybkości rozkładu nadtlenku wodoru od stężenia wodnego roztworu tej substancji w temperaturze T = 40°C oraz w temperaturze T1. Wyniki eksperymentu przedstawiono na poniższym wykresie.
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Dla danego stężenia nadtlenku wodoru szybkość jego rozkładu jest w temperaturze T1 (mniejsza / większa), niż w temperaturze T = 40 °C, co oznacza, że temperatura T1 jest (wyższa / niższa) od temperatury 40 °C.
Zadanie 7. (1 pkt)
W roztworze wodnym nadtlenek wodoru rozkłada się zgodnie z równaniem:
2H2O2 (aq) → 2H2O (c) + O2 (g)
Reakcja ta zachodzi powoli, stąd trudno zauważyć wydzielanie się tlenu.
Przygotowano wodny roztwór nadtlenku wodoru i podzielono go na dwie porcje o tej samej objętości. Pierwszą porcję wlano do zlewki I, a drugą – do zlewki II. Zlewkę I pozostawiono w temperaturze 25°C, a do zlewki II w tej samej temperaturze dodano niewielką ilość tlenku manganu(IV). W zlewce I nie zauważono zmian. W zlewce II zaobserwowano gwałtowne wydzielanie bezbarwnego, bezwonnego i palnego gazu. Po zakończeniu reakcji roztwór nad osadem w zlewce II pozostał bezbarwny.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Tlenek manganu(IV) w opisanej reakcji pełni funkcję (katalizatora / substratu / produktu). Jego działanie polega na (podwyższeniu energii aktywacji /obniżeniu energii aktywacji / zwiększeniu stężenia substratu) reakcji.
Zadanie 8. (1 pkt)
Reakcja rozkładu jodowodoru przebiega zgodnie z poniższym równaniem:
2HI (g) ⇄ H2 (g) + I2 (g)
W tabeli podano wartości stałej równowagi tej reakcji w wybranych temperaturach (pod ciśnieniem p = 1013 hPa).
| Temperatura, K | 400 | 600 | 800 |
| Stała równowagi | 4,07 ∙ 10‒3 | 1,24 ∙ 10‒2 | 2,31 ∙ 10‒2 |
Oceń, czy poniższe stwierdzenia są prawdziwe. Zaznacz P, jeśli stwierdzenie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Wzrost temperatury (przy p = const) skutkuje spadkiem wydajności reakcji rozkładu jodowodoru. | P | F |
| 2. | Wzrost ciśnienia (przy T = const) nie skutkuje zmianą wydajności reakcji rozkładu jodowodoru. | P | F |
Zadanie 9. (1 pkt)
Cząsteczka kwasu tlenowego pewnego pierwiastka E zawiera jeden atom tego pierwiastka, dwa atomy wodoru oraz atomy tlenu. Masa molowa tego kwasu wynosi 193,6 g · mol–1, a masa pierwiastka E stanowi 65,9% masy kwasu.
Na podstawie obliczeń zidentyfikuj pierwiastek E i napisz wzór sumaryczny opisanego kwasu.
Obliczenia pomocnicze:
Wzór sumaryczny kwasu:
Zadanie 10. (1 pkt)
W eksperymencie zmieszano dwa bezbarwne roztwory wodne. Po zmieszaniu roztworów wytrącił się biały osad.
Spośród poniższych soli wybierz dwie, których wodne roztwory mogły zostać użyte w opisanym eksperymencie. Zaznacz wzory wybranych soli.
Zadanie 11. (1 pkt)
Do wodnego roztworu wodorowęglanu sodu dodano kwas solny. Zaobserwowano wydzielanie bezbarwnego gazu.
Napisz w formie jonowej skróconej równanie reakcji, w wyniku której wydzielił się bezbarwny gaz i określ, jaką funkcję – kwasu czy zasady Brønsteda – pełni w tej reakcji jon wodorowęglanowy.
Równanie reakcji:
Funkcja jonu wodorowęglanowego:
Zadanie 12. (2 pkt)
W oddzielnych zlewkach przygotowano wodne roztwory następujących substancji:
| I | II | III | IV | V |
|---|---|---|---|---|
| CH3COONa | HCl | KOH | NH4Cl | NaCl |
Wszystkie roztwory miały stężenie molowe 0,1 mol ∙ dm−3 i były przechowywane w temperaturze −25°C.
12.1. (0–1)
Spośród wymienionych wyżej roztworów wybierz roztwór: o najniższym pH, o pH = 7 oraz o najwyższym pH. Wpisz poniżej odpowiednie numery, którymi oznaczono te roztwory w powyższej tabeli.
| Roztwór o najniższym pH | Roztwór o pH = 7 | Roztwór o najwyższym pH |
|---|---|---|
12.2. (0–1)
Określ wartość pH roztworu wodorotlenku potasu wymienionego w tabeli powyżej.
Obliczenia pomocnicze:
pH =
Zadanie 13. (1 pkt)
Do probówki z wodnym roztworem chromianu(VI) potasu dodano bezbarwny wodny roztwór pewnej substancji (reakcja 1). Następnie do otrzymanej mieszaniny dodano bezbarwny wodny roztwór innej substancji (reakcja 2). Przebieg eksperymentu zilustrowano na poniższym schemacie.
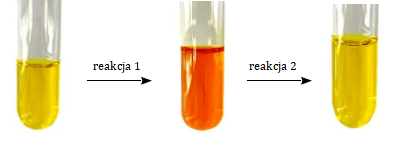
Napisz w formie jonowej skróconej równanie reakcji 2.
Zadanie 14. (2 pkt)
Pod wpływem kwasu solnego tlenek manganu(IV) ulega redukcji zgodnie z poniższym równaniem:
MnO2 + Cl– + H+ ⟶ Mn2+ + Cl2 + H2O
Napisz równania jonowe reakcji redukcji i utleniania zachodzących podczas opisanego procesu, uwzględniając liczbę oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy). Określ stosunek molowy, w jakim reaguje utleniacz z reduktorem.
Równanie reakcji redukcji:
Równanie reakcji utleniania:
Stosunek molowy utleniacza do reduktora
nutleniacza : nreduktora =
Zadanie 15. (2 pkt)
Poniżej podano równania reakcji, które mogą zachodzić w dwóch półogniwach redoks:
półogniwo I: Co3+ + e− ⇄ Co2+
półogniwo II: Fe3+ + e− ⇄ Fe2+
Połączono półogniwo I z półogniwem II w warunkach standardowych, tak aby powstało ogniwo.
Napisz równanie reakcji zachodzącej w ogniwie podczas jego pracy i oblicz siłę elektromotoryczną SEM tego ogniwa w warunkach standardowych.
Równanie reakcji:
SEM:
Zadanie 16. (1 pkt)
Cząsteczka pewnego alkanu X ma strukturę łańcuchową i zawiera 5 atomów węgla. Alkan ten reaguje z chlorem, tworząc 4 izomeryczne monochloropochodne.
Napisz wzór półstrukturalny (grupowy) i podaj nazwę systematyczną alkanu X.
Wzór półstrukturalny (grupowy):
Nazwa systematyczna:
Zadanie 17. (2 pkt)
Poniżej przedstawiono ciąg przemian etanu i jego pochodnych:
C2H6 Cl2, światłoreakcja 1 C2H5Cl KOH (aq)reakcja 2 C2H5OH Al2O3, ogrzewaniereakcja 3 C2H4 Br2 (aq)reakcja 4 związek Y
17.1. (0–1)
Uzupełnij poniższą tabelę. Wpisz numery wszystkich reakcji kwalifikujących się do typu reakcji podanej w nagłówku każdej kolumny.
| Addycja | Eliminacja | Substytucja |
|---|---|---|
17.2. (0–1)
Uzupełnij poniższe zdanie. Wybierz i podkreśl poprawną odpowiedź spośród opcji podanych w nawiasie. Napisz wzór półstrukturalny (grupowy) związku Y.
Reakcja 1 zachodzi według mechanizmu (elektrofilowego / nukleofilowego / rodnikowego).
Wzór półstrukturalny (grupowy) związku Y:
Zadanie 18. (1 pkt)
Poniżej przedstawiono wzór dwufunkcyjnej pochodnej alkanu.
CH2(OH)–CH(OH)–CHO
Oceń, czy poniższe stwierdzenia są prawdziwe. Zaznacz P, jeśli stwierdzenie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Dwufunkcyjna pochodna alkanu, której wzór podano powyżej, jest hydroksykwasem. | P | F |
| 2. | Cząsteczki tego związku są chiralne, ponieważ brakuje im płaszczyzny symetrii. | P | F |
