Matura Czerwiec 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 2. (3 pkt)
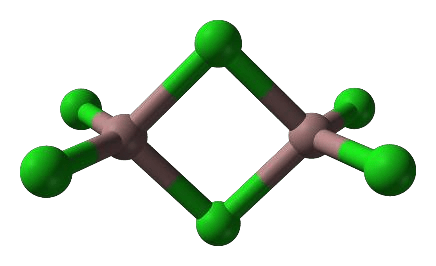
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.
2.1. (0–1)
Narysuj wzór elektronowy monomeru chlorku galu(III). Zaznacz kreskami wiążące i wolne pary elektronowe.
Wzór monomeru chlorku galu(III):
2.2. (0–1)
Uzupełnij tabelę. Napisz, jaki typ hybrydyzacji (sp, sp2 albo sp3) przypisuje się orbitalom walencyjnym atomu galu w monomerze oraz w dimerze chlorku galu(III).
| Chlorek galu(III): | monomer | dimer |
|---|---|---|
| Typ hybrydyzacji |
2.3. (0–1)
Wyjaśnij, dlaczego monomery chlorku galu(III) mają zdolność łączenia się w dimery. Uwzględnij sposób powstawania wiązań, dzięki którym z monomeru chlorku galu(III) powstaje dimer.