Chemia - Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 176.
Aminokwas alanina w roztworze wodnym o zasadowym odczynie ulega reakcji zgodnie z zapisem:
176.1 (0-1)
Wypełnij tabelę, wpisując wzory kwasów i zasad Brønsteda, które w tej reakcji tworzą sprzężone pary.
| Sprzężona para | |
| kwas | zasada |
| |
|
| |
|
Punkt izoelektryczny aminokwasów to takie pH roztworu, przy którym aminokwas występuje w postaci soli wewnętrznej.
176.2 (0-1)
Podaj wzór jonu, w którego postaci alanina występuje w roztworach wodnych o pH > 7 i wzór jonu, w którego postaci aminokwas ten występuje w roztworach wodnych o pH < 5.
176.3 (0-1)
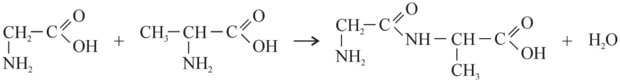
Napisz równanie reakcji tworzenia dipeptydu o nazwie glicyloalanina Gly-Ala.
176.4 (0-1)
Dokończ zdanie, zaznaczając wniosek A lub B i jego uzasadnienie 1. lub 2.
Badając właściwości alaniny, stwierdzono, że alanina
| A. | jest | związkiem optycznie czynnym, | 1. | ponieważ w jej cząsteczce występuje asymetryczny atom węgla. |
| B. | nie jest | 2. | ponieważ w jej cząsteczce nie występuje asymetryczny atom węgla. |
Rozwiązanie
176.1 (0-1)
| Sprzężona para | |
| kwas | zasada |
| CH3–CH(NH+3)–COO− | CH3–CH(NH2)–COO− |
| H2O | OH− |
176.2 (0-1)
Wzór jonu w roztworze o pH > 7: CH3–CH(NH2)–COO−
Wzór jonu w roztworze o pH < 5: CH3–CH(NH+3)–COOH
176.3 (0-1)
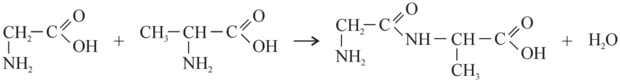
176.4 (0-1)
A. 1.
Wskazówki
176.1 (0-1)
Wypełnienie tabeli wymaga znajomości teorii protonowej Brønsteda. Według tej teorii kwas, to substancja zdolna do oddawania protonów, czyli donor protonów. Zasada, to substancja zdolna do pobierania protonów, czyli akceptor protonów. W każdej reakcji występuje kwas i zasada ze sobą sprzężone.
Dlatego jon o wzorze CH3–CH(NH+3)–COO− jest kwasem, jon CH3–CH(NH2)–COO− jest zasadą. Drugą sprzężoną parę kwas-zasada stanowią H2O i OH–, kwasem jest H2O jako dawca protonu, a zasadą jest OH–, bo przyjmuje proton.
176.2 (0-1)
Alanina to aminokwas, w jej cząsteczce obecne są 2 grupy funkcyjne: karboksylowa i aminowa. Wykazuje właściwości amfoteryczne, reaguje z kwasami i zasadami. Aby rozwiązać tę część zadania, odczytujemy wartość punktu izoelektrycznego alaniny z zestawu Wybranych wzorów i stałych fizykochemicznych na egzamin maturalny z biologii, chemii i fizyki. Wynosi ona 6,11. W roztworze o takim pH alanina przyjmuje postać jonu obojnaczego CH3–CH(NH+3)–COO−, w roztworach o pH > 6,11 alanina będzie występować w postaci anionu CH3–CH(NH2)–COO−, a w roztworach o pH < 6,11 – w postaci kationu CH3–CH(NH+3)–COOH .
Dlatego w roztworze o pH > 7 alanina ma postać:
CH3–CH(NH2)–COO−,
a w roztworze o pH < 5 postać: CH3–CH(NH+3)–COOH
176.3 (0-1)
Zapis sekwencji aminokwasów w cząsteczce dipeptydu Gly-Ala wskazuje, że pierwszym aminokwasem jest glicyna (Gly), drugim alanina (Ala). Oznacza to, że grupa karboksylowa glicyny łączy się z grupą aminową alaniny, tworząc wiązanie peptydowe (produktem ubocznym jest woda). Wiedząc to, możemy napisać równanie reakcji kondensacji tych dwóch aminokwasów:
Przy tworzeniu nazw peptydów końcówkę nazwy pierwszego aminokwasu, którego grupa karboksylowa jest podstawiona, zmieniamy na –ylo. Aminokwas znajdujący się na końcu łańcucha peptydowego ma wolną grupą karboksylową i jego nazwa pozostaje niezmieniona.
176.4 (0-1)
Ze wzoru alaniny wynika, że jest ona związkiem optycznie czynnym, ponieważ w jej cząsteczce występuje asymetryczny atom węgla, czyli taki, który jest połączony z 4 różnymi podstawnikami. Jest to drugi atom węgla, połączony z atomem wodoru, grupą karboksylowa, grupą aminową i grupą metylową.
