Matura Czerwiec 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 8. (1 pkt)
Reakcja tlenku węgla(IV) z wodorem przebiega zgodnie z równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g)
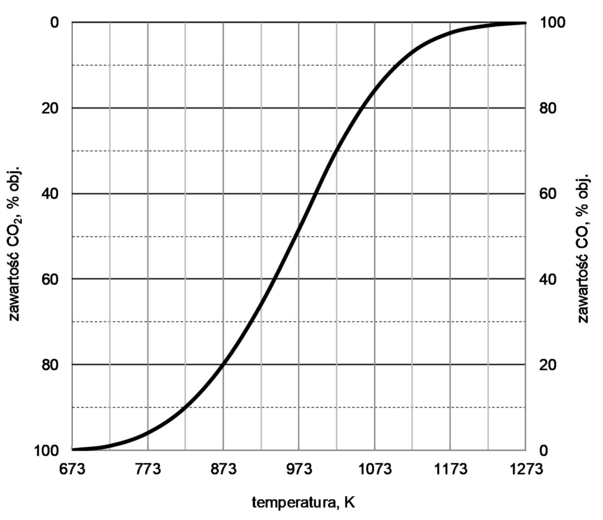
W tabeli przedstawiono wartości stężeniowej stałej równowagi Kc tej reakcji w wybranych temperaturach.
| Temperatura, K | 400 | 600 | 800 | 1000 |
| Stała równowagi | 6,47 ∙ 10–4 | 3,54 ∙ 10–2 | 2,37 ∙ 10–1 | 6,97 ∙ 10–1 |
Rozstrzygnij, czy reakcja tlenku węgla(IV) z wodorem jest procesem endoenergetycznym. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie: