Chemia - Test diagnostyczny CKE Grudzień 2022, Poziom rozszerzony (Formuła 2023)
Zadanie 1. (2 pkt)
Na zdjęciu obok przedstawiono wodny roztwór soli, w skład której wchodzą pierwiastki X1, X2 i X3. Dwa z nich są w stanie wolnym metalami i należą do tego samego okresu, a jeden jest niemetalem i leży w innym okresie. Masy atomowe tych trzech pierwiastków, zaokrąglone do liczb całkowitych, spełniają zależność: MX1 + MX2 = MX3. Atom pierwiastka X3 ma na zewnętrznej powłoce dwa razy więcej elektronów niż atom pierwiastka X2, a atom pierwiastka X1 ma na zewnętrznej powłoce dwa razy więcej niesparowanych elektronów niż atom pierwiastka X2.

1.1. (0–1)
Zidentyfikuj pierwiastki X1, X2 oraz X3. Napisz ich symbole chemiczne.
X1:
X2:
X3:
1.2. (0–1)
Uzupełnij poniższą tabelę. Wpisz wartości liczb kwantowych odpowiadających niesparowanym elektronom w atomach (w stanie podstawowym) pierwiastków X1 i X3.
| Pierwiastek | Główna liczba kwantowa 𝑛 | Poboczna liczba kwantowa 𝑙 |
|---|---|---|
| X1 | ||
| X3 |
Zadanie 2. (1 pkt)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Atomy tego samego pierwiastka mogą się różnić pod względem masy atomowej. | P | F |
| 2. | Atomy różnych pierwiastków mogą mieć taką samą liczbę masową. | P | F |
Zadanie 3. (5 pkt)
Cząstki α emitowane przez jądra wielu promieniotwórczych izotopów ulegają zobojętnieniu elektronami z otoczenia, co prowadzi do powstania gazowego helu. Jeżeli rozpad promieniotwórczy zachodzi w układzie zamkniętym, ilość helu otrzymanego w taki sposób jest proporcjonalna do liczby wyemitowanych cząstek α. Ta zależność stała się podstawą jednej z pierwszych metod wyznaczania stałej Avogadra.
Zmierzono aktywność radu 226Ra i stwierdzono, że 1,0 g tego izotopu w ciągu sekundy emituje 3,4 ⸱ 1010 cząstek α, co powoduje jego przemianę w radon 222Rn. Następnie z izotopu 222Rn, w wyniku ciągu kilku szybkich przemian promieniotwórczych α i β–, powstaje ołów 210Pb. Dalszy rozpad tego nuklidu nie wpływa na przebieg eksperymentu.
Próbkę zawierającą 200 mg izotopu 226Ra zamknięto na 80 dni (6 912 000 s) w zbiorniku i po tym czasie stwierdzono, że powstało 7,0 mm3 helu (w przeliczeniu na warunki normalne). Można przyjąć, że aktywność radu 226Ra była stała w czasie trwania eksperymentu.
3.1. (0–4)
Oblicz stałą Avogadra na podstawie danych z opisanego eksperymentu. Przedstaw tok rozumowania.
Stała Avogadra:
3.2. (0–1)
Oblicz, ile cząstek β– jest emitowanych w ciągu przemian jądra 22688Ra w jądro 21082Pb.
Liczba cząstek β–:
Zadanie 4. (1 pkt)
Niżej przedstawiono konfigurację elektronową kationu pewnego pierwiastka o ładunku 3+.
1s22s22p63s23p63d3
Wpisz symbol tego pierwiastka w miejscu na to przeznaczonym oraz uzupełnij poniższy schemat tak, aby przedstawiał konfigurację elektronową jego atomu w stanie podstawowym.
Zadanie 5. (1 pkt)
Niżej wymieniono wybrane wiązania chemiczne i oddziaływania międzycząsteczkowe, którym przyporządkowano numery od 1 do 6.
| wiązanie metaliczne | 1 |
| wiązanie jonowe | 2 |
| wiązanie kowalencyjne spolaryzowane | 3 |
| oddziaływanie jon – dipol | 4 |
| oddziaływanie dipol – dipol | 5 |
| wiązanie wodorowe | 6 |
Porównaj dwa układy: stały azotan(V) potasu i rozcieńczony wodny roztwór tej soli, pod względem występujących w nich wiązań chemicznych i oddziaływań międzycząsteczkowych. Wpisz właściwe numery w odpowiednie kolumny tabeli. Uwzględnij wszystkie wiązania i oddziaływania występujące w każdym z tych układów.
| Stały azotan(V) potasu | Wodny roztwór azotanu(V) potasu |
|---|---|
Zadanie 6. (1 pkt)
Dwie substancje oznaczono umownie literami A i B. W poniższej tabeli przedstawiono podobieństwa i różnice we właściwościach tych substancji.
| Właściwości fizyczne | Substancja A | Substancja B |
| wygląd | białe kryształy | |
| twardość | kruche | |
| rozpuszczalność w wodzie | dobra | |
| przewodnictwo elektryczne roztworu | dobre | nie przewodzi |
| temperatura topnienia | powyżej 800 ℃ | poniżej 200 ℃ |
Określ rodzaje kryształów (metaliczne, jonowe, kowalencyjne, molekularne) tworzone przez badane substancje.
| Substancja A | Substancja B | |
|---|---|---|
| Rodzaj kryształów |
Zadanie 7. (1 pkt)
Rozstrzygnij, czy na podstawie wartości entalpii tworzenia CO oraz CO2 można stwierdzić, że reakcja spalania tlenku węgla(II) jest egzotermiczna. Uzasadnij swoją odpowiedź.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 8. (2 pkt)
Przygotowano dwa zestawy laboratoryjne umożliwiające pomiar objętości gazu wydzielonego w reakcji metali z kwasem solnym. W kolbie jednego zestawu umieszczono próbkę mieszaniny wiórków magnezu i miedzi w stosunku molowym 8 : 3, a w kolbie drugiego zestawu – próbkę o takiej samej masie, ale złożoną z wiórków glinu i srebra. Do kolb wprowadzono nadmiar kwasu solnego i stwierdzono, że objętość wydzielonego gazu była taka sama w obu zestawach.
Oblicz zawartość glinu w % masowych w mieszaninie wiórków użytej w doświadczeniu. Przyjmij wartości mas molowych:
MMg = 24 g∙mol–1, MCu = 64 g∙mol–1, MAl = 27 g∙mol–1, MAg = 108 g∙mol–1.
Zawartość glinu w % masowych:
Zadanie 9. (1 pkt)
Badano reakcje stężonego kwasu azotowego(V) z metalami: z cynkiem, z glinem, z magnezem oraz ze srebrem. Jedno z przeprowadzonych doświadczeń pokazano na zdjęciu.

Wskaż metal, który znajduje się w probówce z kwasem pokazanej na zdjęciu, i uzasadnij swój wybór.
Symbol metalu:
Uzasadnienie:
Zadanie 10. (2 pkt)
Chlorek, bromek i jodek ołowiu(II) są solami trudno rozpuszczalnymi w wodzie. Chlorek i bromek mają barwę białą, a jodek jest żółty. Do 5,0 cm3 nasyconego roztworu chlorku ołowiu(II) dodano 2,5 cm3 roztworu pewnej soli i zaobserwowano efekt pokazany na zdjęciu.

Spośród poniższych soli wybierz tę, której roztwór mógł być użyty w tym doświadczeniu, i zaznacz jej wzór. Oblicz, jakie powinno być minimalne stężenie molowe użytego roztworu tej soli, żeby wystąpił zaobserwowany efekt.
Minimalne stężenie molowe soli:
Zadanie 11. (4 pkt)
W poniższej tabeli zamieszczono dane dotyczące rozpuszczalności substancji X w wodzie, a na wykresie przedstawiono krzywą zależności rozpuszczalności substancji Y w wodzie.
| Temperatura, °C | Rozpuszczalność substancji X, g na 100 g wody |
|---|---|
| 0 | 89 |
| 20 | 53 |
| 40 | 33 |
| 60 | 23 |
| 80 | 16 |
11.1. (0–2)
Narysuj na wykresie krzywą rozpuszczalności substancji X i wyznacz wartość temperatury, w której substancje X i Y mają taką samą rozpuszczalność. Oblicz stężenie procentowe nasyconego roztworu substancji X lub Y w tej temperaturze.
Substancje X i Y mają taką samą rozpuszczalność w temperaturze ℃.
Stężenie % nasyconego roztworu:
11.2. (0–2)
Spośród wymienionych niżej substancji wybierz tę, która była oznaczona symbolem X, oraz tę, która była oznaczona symbolem Y. Napisz ich wzory i uzasadnij swój wybór.
Wzór substancji X:
Uzasadnienie:
Wzór substancji Y:
Uzasadnienie:
Zadanie 12. (3 pkt)
Przeprowadzono dwa doświadczenia.
Doświadczenie I: Uczeń strącił osad Fe(OH)2, a następnie dodał trochę wody utlenionej (wodnego roztworu H2O2 o stężeniu 3%) i zauważył, że barwa osadu zmieniła się na rdzawobrązową (reakcja 1.).
Doświadczenie II: Uczeń przygotował zielony roztwór Na3[Cr(OH)6], a następnie dodał trochę H2O2 i stwierdził, że barwa roztworu zmieniła się na żółtą (reakcja 2.).
Na podstawie wyników tych doświadczeń uczeń sformułował hipotezę:
H2O2 w reakcjach utleniania-redukcji zawsze zachowuje się jak utleniacz.
12.1. (0–2)
Napisz równania reakcji przebiegających w opisanych doświadczeniach:
- w formie cząsteczkowej – równanie reakcji 1.
- w formie jonowej skróconej – równanie reakcji 2.
Reakcja 1.:
Reakcja 2.:
12.2. (0–1)
Nauczyciel zaproponował, żeby w celu
weryfikacji postawionej hipotezy sprawdzić,
czy woda utleniona reaguje z jonami
manganianowymi(VII). Doświadczenie
przeprowadzono.
Na zdjęciach obok pokazano, jak zmieniał
się wygląd zawartości probówki
z roztworem KMnO4, gdy dodano do niego
H2O2.

Rozstrzygnij, czy wynik doświadczenia potwierdza uczniowską hipotezę. Uzasadnij swoją odpowiedź – zinterpretuj zmiany zaobserwowane w trakcie doświadczenia.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 13. (1 pkt)
W celu skutecznego usunięcia jonów z roztworu stosuje się często metodę strąceniową, w której odczynnik strącający jest dodawany w nadmiarze.
Rozstrzygnij, czy w ten sposób można usunąć jony glinu z roztworu jego soli, gdy odczynnikiem strącającym będzie roztwór NaOH. Uzasadnij swoją odpowiedź.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 14. (2 pkt)
W trzech probówkach oznaczonych numerami 1, 2, 3, znajdowała się woda z dodatkiem oranżu metylowego. Do każdej z tych probówek wprowadzono małą porcję jednego z tlenków wybranych z poniższego zbioru:
Zawartość każdej z probówek wymieszano i pozostawiono na pewien czas.

14.1. (0–1)
Uzupełnij tabelę. Wpisz wzory tlenków wprowadzonych do probówek 1 i 2.
| Nr probówki | Wzór tlenku |
|---|---|
| 1 | |
| 2 |
14.2. (0–1)
Napisz w formie cząsteczkowej równanie reakcji, której produkt spowodował zmianę barwy oranżu metylowego w probówce 3.
Zadanie 15. (2 pkt)
W wysokiej temperaturze tlenki żelaza można zredukować wodorem do metalicznego żelaza. Redukcja tlenku Fe3O4 przebiega zgodnie z równaniem:
Fe3O4(s) + 4H2(g) ⇄ 3Fe(s) + 4H2O(g)
Z reaktora o pojemności 8,0 dm3, zawierającego 420 g tlenku Fe3O4, odpompowano powietrze i wprowadzono 6,0 g wodoru. Zawartość reaktora ogrzano do temperatury 𝑇, w której stała równowagi powyższej reakcji wynosi 0,20.
Oblicz stężenie pary wodnej w reaktorze po ustaleniu się stanu równowagi oraz masę otrzymanego żelaza.
Stężenie pary wodnej:
Masa żelaza:
Zadanie 16. (2 pkt)
Badano kinetykę reakcji utleniania jonów bromkowych jonami bromianowymi(V) w środowisku kwasowym, która przebiega zgodnie z równaniem:
5Br– + BrO–3 + 6H+ → 3Br2 + 3H2O
Na podstawie pomiarów kinetycznych ustalono następującą zależność między szybkością tej reakcji a stężeniami reagentów:
𝑣 = 𝑘 ⸱ [Br–] ⸱ [BrO–3] ⸱ [H+]2
16.1. (0–1)
Stała szybkości reakcji w zależności od postaci równania kinetycznego może mieć różny wymiar. Niżej przedstawiono przykładowe wyrażenia oznaczone literami A–D.
- dm6mol2∙s
- dm9mol3∙s
- dm3∙smol
- 1s
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Stała szybkości reakcji utleniania jonów bromkowych jonami bromianowymi(V) ma jednostkę oznaczoną literą (A / B / C / D). Jedno z podanych wyrażeń nie może być jednostką stałej szybkości reakcji. To wyrażenie oznaczono literą (A / B / C / D).
16.2. (0–1)
Oblicz, jak zmieni się szybkość opisanej reakcji, jeżeli początkowe pH roztworu będzie wyższe o 𝟎,𝟑.
Szybkość reakcji
Zadanie 17. (1 pkt)
Na zdjęciu obok pokazano dwuetapowe doświadczenie, podczas którego do probówki wprowadzono kilka cm3 chloroformu (CHCl3) oraz wodę bromową (etap 1.), a następnie ciecze wymieszano i pozostawiono na pewien czas (etap 2.).

Przedstaw wniosek z pokazanego doświadczenia dotyczący porównania gęstości wody bromowej i chloroformu. Nazwij proces, który spowodował zmianę wyglądu zawartości probówki po wymieszaniu i ponownym rozdzieleniu się cieczy.
Gęstość chloroformu jest niż gęstość wody bromowej.
Nazwa procesu:
Zadanie 18. (1 pkt)
Jedna z metod wykrywania obecności jonów bromkowych albo jodkowych w roztworze polega na utlenieniu ich do wolnego bromu albo jodu.
Rozstrzygnij, czy zarówno jony bromkowe, jak i jony jodkowe można utlenić za pomocą kwasu azotowego(V). Uzasadnij swoją odpowiedź. W uzasadnieniu odnieś się do wartości odpowiednich potencjałów standardowych.
Rozstrzygnięcie:
jony bromkowe:
jony jodkowe:
Uzasadnienie:
Zadanie 19. (1 pkt)
Zbudowano dwa ogniwa składające się z półogniw metalicznych (I rodzaju). W jednym z ogniw półogniwo cynkowe stanowi anodę, a w drugim – katodę. Wartości SEM tych ogniw różnią się o 59 mV.
Uzupełnij schematy opisanych ogniw. Elektrodą w dobieranym półogniwie powinien być jeden z wymienionych metali:
Schematy ogniw:
A ( ̶ ): Zn │ Zn2+║ │ :(+) K
A ( ̶ ): │ ║ Zn2+ │ Zn :(+) K
Zadanie 20. (1 pkt)
Związek organiczny X jest substratem w procesach produkcji niektórych tworzyw sztucznych. Ten związek ulega reakcji polimeryzacji i jest stosowany jako jeden z reagentów w procesach polikondensacji. Niżej przedstawione są wzory fragmentów łańcucha dwóch polimerów (oznaczonych literami A i B), w których syntezie bierze udział związek X.
Uzupełnij tabelę. Wpisz informacje dotyczące związku X.
| Wzór strukturalny | Nazwa systematyczna |
|---|---|
Zadanie 21. (2 pkt)
Jedną z metod analizy instrumentalnej jest spektrometria mas. Podczas takiej analizy badana próbka (w fazie gazowej) jest poddawana jonizacji. Cząsteczki tracą elektrony i stają się kationami oraz ulegają fragmentacji, w wyniku której powstają mniejsze kationy. Następnie wiązka kationów przechodzi przez pole magnetyczne, w którym tor jej ruchu ulega zakrzywieniu. Wielkość zakrzywienia zależy od stosunku masy do ładunku i dla jednododatnich kationów jest odwrotnie proporcjonalna do ich masy. W ten sposób kationy o różnych masach zostają rozdzielone i odpowiadają im oddzielne piki w otrzymanym widmie masowym. Wysokość tych pików (intensywność) jest proporcjonalna do zawartości odpowiednich kationów w próbce. Cząsteczkom, które uległy jonizacji, ale nie uległy fragmentacji, odpowiadają tzw. piki molekularne o największej masie. Poniżej przedstawiono uproszczony schemat działania spektrometru mas.
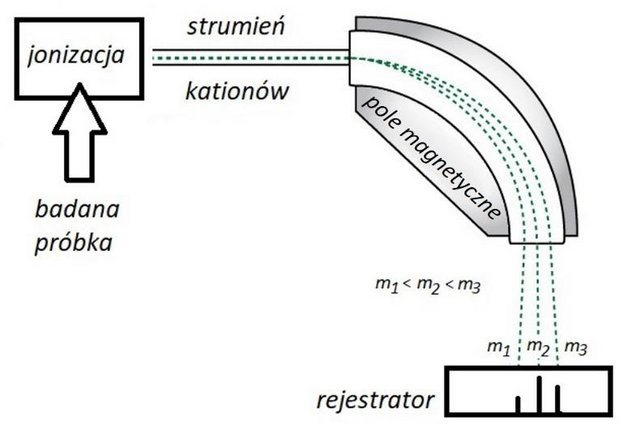
Niżej przedstawiono fragment widma masowego bromu, na którym są widoczne piki molekularne pochodzące od kationów Br+2 o różnym składzie izotopowym. Intensywność sygnałów (wysokość pików) jest mierzona względem najwyższego piku molekularnego.
Na poniższym fragmencie widma masowego chlorobenzenu pokazano trzy piki, oznaczone numerami 1 (pik fragmentacyjny) oraz 2, 3 (piki molekularne).
Wpisz do tabeli wzory sumaryczne kationów odpowiadających kolejnym pikom. Jeśli w jonie występuje chlor, podaj jego liczbę masową. Wyjaśnij, dlaczego dwa piki molekularne znacznie różnią się pod względem wysokości.
| Numer piku | Wzór kationu |
|---|---|
| 1 | |
| 2 | |
| 3 |
Wyjaśnienie:
Zadanie 22. (2 pkt)
Atomy wodoru w cząsteczkach etynu są bardziej reaktywne niż atomy wodoru w alkanach i alkenach. Przykładowo: przez metaliczny sód jest wypierany wodór z etynu i przy nadmiarze tego alkinu reakcja przebiega zgodnie z równaniem:
etynek sodu
Podobna reakcja z udziałem sodu zachodzi w ciekłym amoniaku:
2NH3 + 2Na → 2NaNH2 + H2
Z kolei działanie etynu na produkt tej reakcji (NaNH2) rozpuszczony w etoksyetanie (eterze dietylowym) prowadzi do ponownego powstania amoniaku:
HC≡CH + NaNH2 → HC≡CNa + NH3
Etynek sodu nie jest trwałym związkiem i po wprowadzeniu do wody rozkłada się z wydzieleniem etynu.
22.1. (0–1)
Napisz w formie cząsteczkowej równanie reakcji etynku sodu z wodą.
22.2. (0–1)
Etyn, amoniak i wodę uszereguj od najsłabszego do najsilniejszego charakteru kwasowego.
Zadanie 23. (2 pkt)
Jedną z monobromopochodnych butanu (związek A) poddano reakcji z KOH w bezwodnym etanolu (reakcja 1.), a na otrzymany związek B podziałano bromowodorem (reakcja 2.). Główny produkt C był izomerem związku A.
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Następnie uzupełnij tabelę. Napisz wzory półstrukturalne (grupowe) związków A i C.
Związek B powstał w reakcji (substytucji / addycji / eliminacji), a jego przemiana w związek C jest przykładem reakcji (substytucji / addycji / eliminacji).
| Wzór związku A | Wzór związku C |
|---|---|
Zadanie 24. (2 pkt)
W temperaturze powyżej 67℃ fenol miesza się z wodą w dowolnych proporcjach, natomiast w przedziale temperatury 15–40℃ jego maksymalne stężenie w roztworze wodnym nie przekracza 10%.
Do probówki wprowadzono fenol i wodę w stosunku masowym 1 : 5 i przeprowadzono doświadczenie.
Etap 1. Zawartość probówki ogrzano do temperatury 70℃.
Etap 2. Mieszaninę ochłodzono do temperatury 25℃.
Etap 3. Dodano stechiometryczną ilość wodorotlenku sodu (w stosunku do fenolu).
24.1. (0–1)
Uzupełnij tabelę. Opisz wygląd zawartości probówki po kolejnych etapach doświadczenia.
| Wygląd zawartości probówki | |
|---|---|
| po 1. etapie | |
| po 2. etapie | |
| po 3. etapie |
24.2. (0–1)
Po pewnym czasie stwierdzono, że mieszanina otrzymana w 3. etapie ma odczyn zasadowy.
Napisz równanie reakcji odpowiadającej za odczyn tej mieszaniny na podstawie definicji kwasów i zasad Brønsteda. Wzory odpowiednich drobin wpisz w poniższą tabelę.
Zadanie 25. (3 pkt)
W wyniku działania kwasem azotowym(III) na pierwszorzędowe aminy aromatyczne powstają tzw. sole diazoniowe, które znajdują zastosowanie w syntezie organicznej. W praktyce, zamiast nietrwałego kwasu azotowego(III) stosuje się jego sól w obecności mocnego kwasu. Przykład takiej reakcji z udziałem aniliny zilustrowano równaniem:
Gdy otrzymana sól diazoniowa reaguje z wodą, powstaje fenol.
Opisane przemiany mogą być stosowane w celu otrzymania pochodnych benzenu, w których podstawniki kierujące w pozycje orto- i para- znajdują się względem siebie w pozycji meta-.
Zaprojektuj ciąg przemian, w wyniku których z benzenu powstanie 3-bromofenol – uzupełnij w poniższym, dwuczęściowym schemacie wzory produktów pośrednich, a nad każdą strzałką wpisz literę oznaczającą zestaw użytych reagentów. Zestawy odczynników wybierz spośród wymienionych poniżej.
Zadanie 26. (1 pkt)
Izomeryczne związki A, B i C należące do jednej klasy związków organicznych mają wzór sumaryczny C4H10O. Jeden z tych związków ma rozgałęziony łańcuch węglowy. Izomer A został wprowadzony do roztworu K2Cr2O7 z dodatkiem kwasu siarkowego(VI) i na zdjęciu obok pokazano, jak wygląda zawartość probówki na początku tego doświadczenia (1) oraz po pewnym czasie (2). Wiadomo, że cząsteczki związku A nie są chiralne, ale jego izomer B, który podobnie zachowałby się w opisanym doświadczeniu, wykazuje czynność optyczną. Izomer C nie ulega działaniu jonów dichromianowych(VI).

Napisz wzory półstrukturalne (grupowe) izomerów A, B, C.
| Izomer A | Izomer B | Izomer C |
|---|---|---|
Zadanie 27. (2 pkt)
Uczniowie badali zachowanie związków organicznych wobec kwasów i zasad. Mieli do dyspozycji: propano-1-aminę, propan-1-ol, glicynę oraz kwas propanowy. Te związki zostały w przypadkowej kolejności oznaczone numerami 1–4.
W pierwszym etapie doświadczenia badane związki wprowadzono pojedynczo do czterech probówek zawierających kwas solny z dodatkiem oranżu metylowego, a w drugim etapie – do czterech probówek zawierających roztwór NaOH z dodatkiem fenoloftaleiny. Efekty doświadczenia pokazano na zdjęciach.
Uzupełnij tabelę. Wymienionym związkom przyporządkuj numery ich roztworów.
| Nazwa związku | propano-1-amina | propan-1-ol | glicyna | kwas propanowy |
| Numer roztworu |
Zadanie 28. (1 pkt)
Jednym z silnie toksycznych związków wytwarzanych przez pleśnie jest aflatoksyna B1, wykazująca właściwości rakotwórcze. Poniższy wzór przedstawia strukturę cząsteczki tego związku.
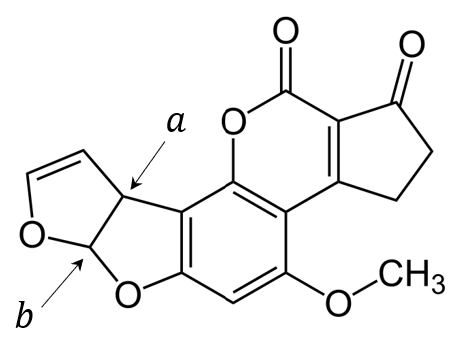
Uzupełnij tabelę. Wpisz formalne stopnie utlenienia atomów węgla oznaczonych literami 𝒂 i 𝒃 we wzorze cząsteczki aflatoksyny B1 oraz określ typ hybrydyzacji, jaki można przypisać orbitalom walencyjnym atomu węgla 𝒂.
| Stopień utlenienia atomu węgla 𝑎 | Stopień utlenienia atomu węgla 𝑏 | Hybrydyzacja orbitali atomu węgla 𝑎 |
|---|---|---|
Zadanie 29. (4 pkt)
Do parametrów charakteryzujących tłuszcze należy tzw. liczba jodowa. Jest ona miarą nienasycenia tłuszczu i odpowiada liczbie gramów jodu, który może przereagować z próbką tłuszczu o masie 100 g.
Tłuszcze poddaje się w przemyśle m.in. transestryfikacji, która polega na wymianie reszt kwasowych na inne lub na podstawieniu innego alkoholu w miejscu glicerolu.
29.1. (0–2)
Napisz równanie reakcji kwasu oleinowego z jodem oraz równanie transestryfikacji trioleinianu glicerolu z metanolem. Zastosuj wzory półstrukturalne (grupowe) reagentów organicznych.
29.2. (0–2)
Pewien trigliceryd, którego cząsteczki nie są chiralne, ma liczbę jodową ok. 30. Ten związek poddano transestryfikacji z metanolem i stwierdzono, że w produktach znajdują się tylko dwa estry: oleinian metylu i palmitynian metylu.
Wykonaj odpowiednie obliczenia i uzupełnij poniższy wzór, tak aby przedstawiał
trigliceryd, który poddano opisanym reakcjom.
Przyjmij wartości mas molowych:
Wzór triglicerydu:
Zadanie 30. (1 pkt)
Wanilina jest popularną substancją zapachową stosowaną w przemyśle spożywczym i kosmetycznym. Strukturę cząsteczki tego związku przedstawia wzór I.
W jednej z metod otrzymywania waniliny produktem pośrednim jest związek opisany wzorem II.
Wśród wymienionych niżej odczynników wybierz te, które reagują z grupami funkcyjnymi oznaczonymi we wzorze waniliny cyframi (1) i (2). Wpisz te cyfry w odpowiednie komórki poniższej tabeli.
| Odczynnik | [Ag(NH3)2]OH (aq) | NaCl (aq) | KOH (aq) |
| Grupa funkcyjna |
Zadanie 31. (1 pkt)
Wanilina jest popularną substancją zapachową stosowaną w przemyśle spożywczym i kosmetycznym. Strukturę cząsteczki tego związku przedstawia wzór I.
W jednej z metod otrzymywania waniliny produktem pośrednim jest związek opisany wzorem II.
Grupa oznaczona cyfrą (3) może występować w formie anionu w związku, który jest produktem reakcji metanolu z jednym z wymienionych niżej reagentów:
Wybierz odpowiedni reagent i napisz w formie cząsteczkowej równanie tej reakcji. Napisz nazwę jej organicznego produktu.
Równanie reakcji:
Nazwa produktu:
Zadanie 32. (1 pkt)
Wanilina jest popularną substancją zapachową stosowaną w przemyśle spożywczym i kosmetycznym. Strukturę cząsteczki tego związku przedstawia wzór I.
W jednej z metod otrzymywania waniliny produktem pośrednim jest związek opisany wzorem II.
Związek oznaczony wzorem II otrzymuje się w reakcji bromowania 4-hydroksybenzaldehydu (aldehydu 4-hydroksybenzoesowego).
Rozstrzygnij, czy związek opisany wzorem II jest głównym czy ubocznym produktem tej reakcji. Odpowiedź uzasadnij. W uzasadnieniu odwołaj się do wpływu kierującego podstawników.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 33. (1 pkt)
Wanilina jest popularną substancją zapachową stosowaną w przemyśle spożywczym i kosmetycznym. Strukturę cząsteczki tego związku przedstawia wzór I.
W jednej z metod otrzymywania waniliny produktem pośrednim jest związek opisany wzorem II.
Silniejszym środkiem zapachowym od waniliny, ale o podobnym aromacie, jest związek nazywany etylowaniliną. Położenie atomów tlenu względem pierścienia aromatycznego jest takie samo w obu tych związkach, natomiast ich masy cząsteczkowe różnią się o 14 u.
Uzupełnij poniższy wzór tak, aby przedstawiał cząsteczkę etylowaniliny.
Zadanie 34. (1 pkt)
Pewien tripeptyd zbudowany z aminokwasów białkowych zawiera w każdej ze swoich cząsteczek cztery atomy tlenu, cztery atomy azotu i dwa asymetryczne atomy węgla. Dwa aminokwasy wchodzące w skład tego tripeptydu mają 4-węglowe łańcuchy boczne. Reszty aminokwasów są uporządkowane zgodnie ze wzrostem ich mas cząsteczkowych, czyli największą masę cząsteczkową ma aminokwas z wolną grupą karboksylową.
Napisz wzór tripeptydu spełniającego opisane warunki. Użyj trzyliterowych kodów aminokwasów. Pamiętaj, że z lewej strony umieszcza się kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α.
Zadanie 35. (1 pkt)
Jednym z procesów, którym mogą ulegać cukry, jest skracanie łańcucha węglowego. Jeżeli aldoheksozę podda się utlenieniu za pomocą wody bromowej, otrzymany kwas będzie można przekształcić w aldopentozę. Przykład takiego ciągu przemian przedstawiono na poniższym schemacie.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Schemat przedstawia przemianę D-glukozy w L-arabinozę. | P | F |
| 2. | Podczas przemiany glukozy w arabinozę zmienia się liczba asymetrycznych atomów węgla. | P | F |


