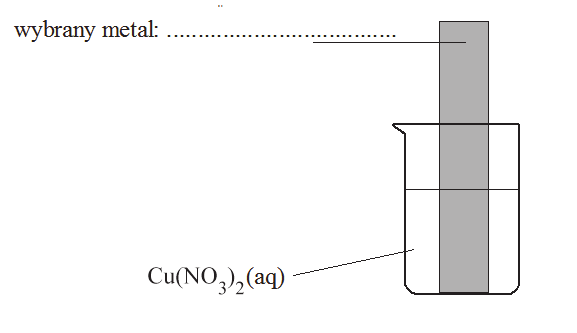
Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 79. (1 pkt)
Oczyszczoną blaszkę wykonaną z pewnego metalu zważono, a następnie zanurzono w wodnym roztworze Cu(NO3)2. Zauważono, że powierzchnia blaszki znajdująca się w roztworze pokryła się różowym nalotem o metalicznym połysku. Po pewnym czasie blaszkę wyjęto z roztworu, osuszono i zważono. Stwierdzono, że masa blaszki po wyjęciu z roztworu była mniejsza od jej masy początkowej. Roztwór w zlewce pozostał klarowny i nie zaobserwowano w nim żadnego osadu.
Uzupełnij schemat wykonania doświadczenia, wpisując nazwę lub symbol metalu, z którego była wykonana blaszka. Metal wybierz spośród podanych poniżej.
Nazwa metalu: glin, nikiel, ołów, srebro.
Schemat wykonania doświadczenia: