Test diagnostyczny (matura próbna) Grudzień 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 5. (1 pkt)
Poniżej przedstawiono przebieg przemiany jądrowej, która zachodzi w wyniku bombardowania jąder pewnego izotopu uranu przyśpieszonymi cząstkami 𝛼.
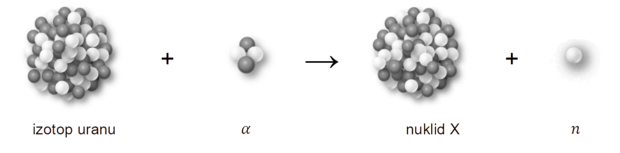
Powstający nuklid X jest nietrwały i ulega rozpadowi β–, którego produktem jest izotop ameryku 241Am.
Napisz równanie opisanej przemiany jądrowej, w której powstaje nuklid X. Uzupełnij wszystkie pola w poniższym schemacie. Zastosuj symbole chemiczne pierwiastków.