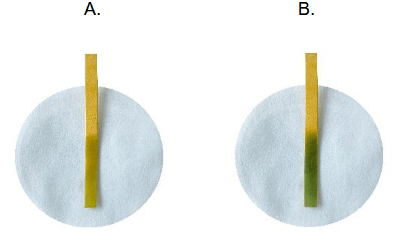
Zadania dodatkowe matury dwujęzycznej (tłumaczenie BiologHelp) Maj 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 12. (2 pkt)
W oddzielnych zlewkach przygotowano wodne roztwory następujących substancji:
| I | II | III | IV | V |
|---|---|---|---|---|
| CH3COONa | HCl | KOH | NH4Cl | NaCl |
Wszystkie roztwory miały stężenie molowe 0,1 mol ∙ dm−3 i były przechowywane w temperaturze −25°C.
12.1. (0–1)
Spośród wymienionych wyżej roztworów wybierz roztwór: o najniższym pH, o pH = 7 oraz o najwyższym pH. Wpisz poniżej odpowiednie numery, którymi oznaczono te roztwory w powyższej tabeli.
| Roztwór o najniższym pH | Roztwór o pH = 7 | Roztwór o najwyższym pH |
|---|---|---|
12.2. (0–1)
Określ wartość pH roztworu wodorotlenku potasu wymienionego w tabeli powyżej.
Obliczenia pomocnicze:
pH =