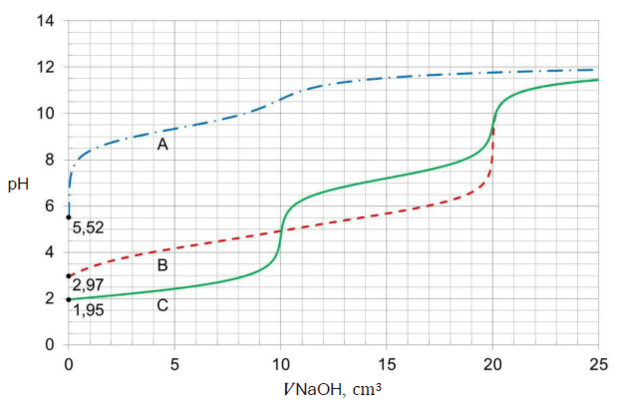
Matura Maj 2023, Poziom rozszerzony (Formuła 2015) - Zadanie 9. (1 pkt)
W wodnych roztworach słabych kwasów jednoprotonowych zachodzi dysocjacja. Dla danej wartości stężenia molowego roztworu i w danej temperaturze ustala się stan równowagi między cząsteczkami i jonami obecnymi w roztworze.
Na poniższym wykresie przedstawiono zależność stopnia dysocjacji (α) dwóch kwasów jednoprotonowych HX i HQ od stężenia molowego roztworu w temperaturze 20 °C.
Rozstrzygnij, na podstawie analizy danych zamieszczonych na wykresie, który kwas (HX czy HQ) jest mocniejszy. Zaznacz jego wzór. Odpowiedź uzasadnij.
Uzasadnienie: