Chemia - Zadania dodatkowe matury dwujęzycznej (tłumaczenie BiologHelp) Maj 2023, Poziom rozszerzony (Formuła 2023)
Zadania dodatkowe matury dwujęzycznej z maja 2023 przetłumaczone z języka angielskiego na polski (tłumaczenie BiologHelp).
Zadanie 1. (2 pkt)
Konfiguracja elektronowa powłoki walencyjnej atomu pierwiastka chemicznego E w stanie podstawowym to 4s24p3.
1.1. (0–1)
Uzupełnij poniższą tabelę. Wpisz symbol chemiczny, numer grupy i numer okresu pierwiastka E.
| Symbol pierwiastka | Numer grupy | Numer okresu |
|---|---|---|
1.2. (0–1)
Napisz konfigurację elektronową jonu E3+ w stanie podstawowym. Użyj skróconej konfiguracji elektronowej z symbolem gazu szlachetnego.
Zadanie 2. (2 pkt)
Wzory chemiczne tlenku siarki(IV) i tlenku węgla(IV) mają taką samą stechiometrię (AB2), ale ich cząsteczki mają różną geometrię.
Uzupełnij poniższe zdania. Wybierz i podkreśl poprawną odpowiedź spośród opcji podanych w każdym nawiasie.
- Orbitalom walencyjnym atomu siarki w tlenku siarki(IV) przypisuje się hybrydyzację (sp / sp2 / sp3). Cząsteczka tlenku siarki(IV) ma budowę (liniową / kątową / tetraedryczną).
- Orbitalom walencyjnym atomu węgla w tlenku węgla(IV) przypisuje się hybrydyzację (sp / sp2 / sp3). Cząsteczka tlenku węgla (IV) ma budowę (liniową / kątową / tetraedryczną).
Zadanie 3. (2 pkt)
Wodorki to związki chemiczne wodoru z innymi pierwiastkami chemicznymi. Wodorki można podzielić między innymi na wodorki metali i niemetali, a także na wodorki zasadowe, kwasowe i obojętne, zgodnie z ich charakterem chemicznym.
3.1. (0–1)
Uporządkuj następujące wodorki
zgodnie ze wzrostem ich charakteru zasadowego.
3.2. (0–1)
Napisz w formie cząsteczkowej równanie reakcji wodorku litu z wodą.
Zadanie 4. (1 pkt)
Węgiel i tlenek węgla(IV) umieszczono w zamkniętym pojemniku o objętości 1 dm3 w temperaturze T i pod ciśnieniem p. Następnie zainicjowano reakcję chemiczną. Po pewnym czasie osiągnięto stan równowagi reakcji zilustrowanej poniższym równaniem:
C (s) + CO2 (g) ⇄ 2CO (g) ΔH > 0
Oceń, czy poniższe stwierdzenia są prawdziwe. Zaznacz P, jeśli stwierdzenie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Zmniejszenie objętości reaktora w warunkach izotermicznych (T = const.) nie wpływa na stan równowagi. | P | F |
| 2. | Po wprowadzeniu katalizatora wzrasta wydajność reakcji, w której powstaje tlenek węgla(II). | P | F |
Zadanie 5. (2 pkt)
Aby określić pH wodnych roztworów NaNO2 i NaNO3, dwa kawałki żółtego uniwersalnego papierka wskaźnikowego zanurzono w roztworach, jak pokazano na poniższym schemacie.
5.1. (0-1)
Wyniki eksperymentu przedstawiono na poniższych fotografiach.
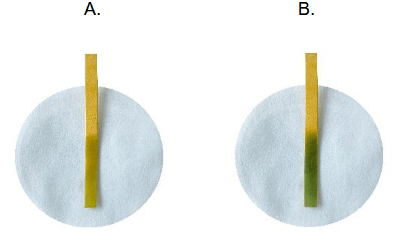
Określ, który uniwersalny papierek wskaźnikowy (A czy B) został zanurzony w wodnym roztworze w probówce I.
5.2. (0-1)
Napisz w formie jonowej skróconej równanie reakcji, w wyniku której pH jednego z badanych roztworów zmieniło odczyn na zasadowy. Zastosuj teorię kwasów i zasad Brønsteda-Lowry'ego.
Zadanie 6. (2 pkt)
Kwas siarkowy(IV) jest słabym kwasem, który ulega stopniowej dysocjacji. Stałe dysocjacji dla tego kwasu w temperaturze 25°C wynoszą odpowiednio Ka1 = 1,23·10−2 i Ka2 = 6,61·10−8.
Zależność między stałą dysocjacji kwasu Ka a stałą dysocjacji sprzężonej zasady Kb jest określona wzorem: Kw = Ka · Kb, gdzie Kw jest iloczynem jonowym wody. Ta zależność oznacza, że im mocniejszy jest kwas Brønsteda-Lowry'ego, tym słabsza jest sprzężona z nim zasada.
6.1. (0–1)
Określ, który z jonów powstających podczas protolizy (dysocjacji) kwasu siarkowego(IV) ma najwyższe stężenie. Napisz wzór tego jonu.
6.2. (0–1)
Uzupełnij poniższy schemat wzorami odpowiednich drobin, aby utworzyć równanie reakcji między najmocniejszą zasadą obecną w wodnym roztworze kwasu siarkowego(IV) a wodą. Zastosuj teorię kwasów i zasad Brønsteda-Lowry'ego.
Zadanie 7. (2 pkt)
Przygotowano wodne roztwory dwóch kwasów jednoprotonowych o stężeniu 0,1 mol·dm−3 w temperaturze 20°C i określono stopień dysocjacji dla każdego roztworu. Wyniki podano w tabeli poniżej.
| Kwas | Stężenie molowe | Stopień dysocjacji |
|---|---|---|
| HA | 0,1 mol ∙ dm−3 | 3% |
| HR | 0,1 mol ∙ dm−3 | 1% |
Rozstrzygnij, czy kwas HA jest mocniejszy czy słabszy od kwasu HR. Odpowiedź uzasadnij. Spośród poniższych opcji wybierz i zakreśl odpowiednią stałą dysocjacji dla kwasu HR w temperaturze 20°C.
Rozstrzygnięcie:
Uzasadnienie:
Stała dysocjacji kwasu HR:
Zadanie 8. (2 pkt)
Dwie nieoznaczone zlewki, A i B, zawierają próbki wody destylowanej i wody wodociągowej, która jest rozcieńczonym roztworem różnych soli. Aby rozróżnić zawartość zlewek, przeprowadzono eksperyment z użyciem wodnego roztworu azotanu(V) srebra(I) jako odczynnika. Poniższe fotografie przedstawiają zlewki A i B po dodaniu odczynnika.
Rozstrzygnij, która zlewka (A czy B) zawierała wodę wodociągową. Spośród jonów wymienionych poniżej
wybierz ten, który mógł być obecny w badanej próbce wody wodociągowej pozwalając na jej rozpoznanie i napisz w formie jonowej skróconej równanie reakcji zachodzącej z udziałem tego jonu podczas eksperymentu.
Woda wodociągowa znajdowała się w zlewce:
Równanie reakcji:
Zadanie 9. (2 pkt)
Aby porównać właściwości cynku, miedzi i srebra, przeprowadzono eksperyment, którego schemat przedstawiono poniżej.
Wyniki eksperymentu przedstawiono na poniższych fotografiach.
9.1. (0–1)
Uzupełnij poniższe zdania. Wybierz i zaznacz poprawną odpowiedź spośród opcji podanych w każdym nawiasie.
- Masa płytki zanurzonej w wodnym roztworze AgNO3 (wzrosła / nie zmieniła się / zmalała).
- Na podstawie wyników eksperymentu można stwierdzić, że (Zn(s) / Cu(s) / Ag(s)) jest najsilniejszym reduktorem.
9.2. (0–1)
Napisz w formie jonowej skróconej równanie reakcji, która zaszła w zlewce I.
Zadanie 10. (2 pkt)
Reakcja między jonami żelaza(II) a jonami manganianowymi(VII) w środowisku kwasowym przebiega zgodnie z równaniem:
5Fe2+ + 8H+ + MnO−4 → Mn2+ + 5Fe3+ + 4H2O
10.1. (0–1)
Podaj stosunek molowy utleniacza do reduktora dla powyższej reakcji.
Stosunek molowy utleniacza do reduktora: :
10.2. (0–1)
Podaj, ile moli elektronów jest przyłączanych przez jeden mol jonów manganianowych(VII) w opisywanej reakcji.
Liczba moli elektronów:
Zadanie 11. (2 pkt)
Poniżej przedstawiono ciąg przemian.
alkan X + Br2światło 2-bromopropan + NaOHH2O związek B + Al2O3T związek C
11.1. (0–1)
Określ typ (addycja, eliminacja, substytucja) i mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji, w której powstaje związek B.
Typ reakcji:
Mechanizm reakcji:
11.2. (0–1)
Napisz wzór półstrukturalny (grupowy) alkanu X i podaj nazwę systematyczną związku C.
Wzór alkanu X:
Nazwa systematyczna związku C:
Zadanie 12. (2 pkt)
Pewien alkohol powstaje w reakcji między 3-metylobutan-2-onem a wodorem w obecności katalizatora.
12.1. (0–1)
Uzupełnij tabelę. Napisz wzór półstrukturalny (grupowy) powstałego alkoholu i sklasyfikuj go jako alkohol pierwszo-, drugo- lub trzeciorzędowy.
| Wzór alkoholu | Rzędowość alkoholu |
|---|---|
12.2. (0–1)
Rozstrzygnij, czy cząsteczki powstałego alkoholu są chiralne. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 13. (2 pkt)
Diazometan (CH2N2) jest popularnym odczynnikiem stosowanym w syntezie organicznej jako czynnik metylujący, który wprowadza grupę metylową do cząsteczki związku organicznego. Na przykład reakcja między diazometanem a kwasem karboksylowym prowadzi do powstania odpowiedniego estru metylowego oraz bezbarwnego, bezwonnego i niepalnego gazu.
13.1. (0–1)
Napisz w formie cząsteczkowej równanie reakcji, w której powstaje benzoesan metylu (ester metylowy kwasu benzoesowego) metodą opisaną powyżej. Użyj wzorów półstrukturalnych (grupowych) lub strukturalnych dla związków organicznych.
13.2. (0–1)
Wyjaśnij, dlaczego wydajność reakcji syntezy estru – reakcji między kwasem karboksylowym a diazometanem – może być wyższa niż wydajność reakcji, w której ten sam ester otrzymuje się z kwasu karboksylowego i alkoholu.





