Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 37. (1 pkt)
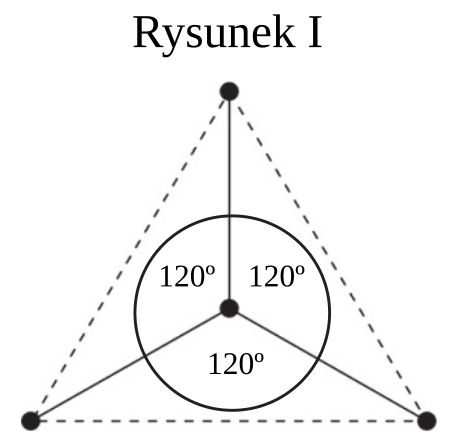
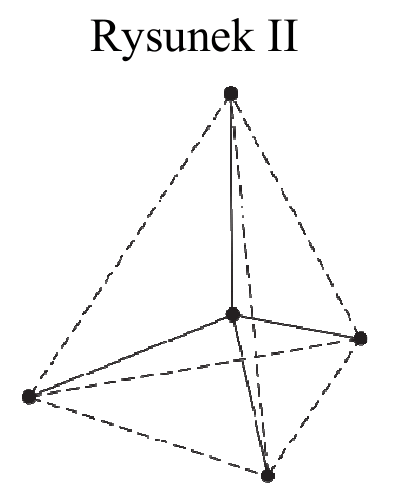
Cząsteczka arsenowodoru AsH3 ma kształt piramidy o podstawie trójkąta równobocznego, w którego narożach znajdują się środki atomów wodoru.
Napisz wzór elektronowy cząsteczki arsenowodoru, zaznaczając kreskami wiązania chemiczne i wolne pary elektronowe. Określ typ hybrydyzacji atomu arsenu w cząsteczce tego związku chemicznego.
Wzór:
Typ hybrydyzacji: