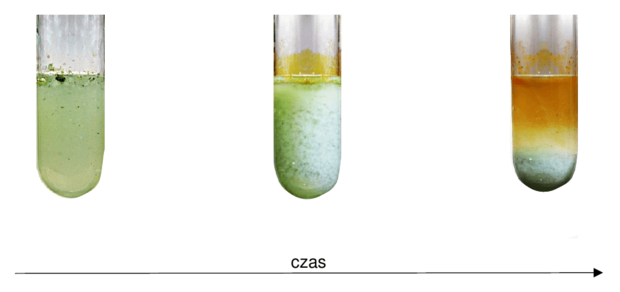
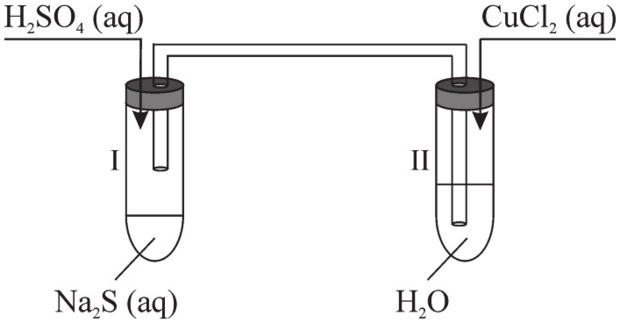
Matura Maj 2023, Poziom rozszerzony (Formuła 2015) - Zadanie 2. (1 pkt)
Węgiel tworzy kilka odmian alotropowych, które różnią się strukturą krystaliczną. Są wśród nich diament, grafit i fulereny.
Poniżej przedstawiono informacje o jednej z odmian alotropowych węgla, a obok – model jej struktury krystalicznej.
Występuje w postaci miękkiego minerału o słabym metalicznym połysku. Ta odmiana charakteryzuje się dobrym przewodnictwem elektryczności i ciepła.
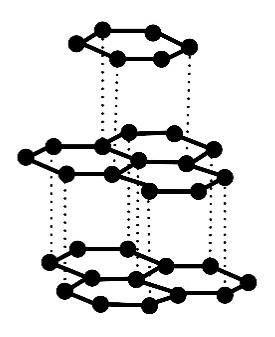
Rozstrzygnij, czy przedstawione informacje dotyczą diamentu czy grafitu. Wyjaśnij, dlaczego ta odmiana charakteryzuje się dobrym przewodnictwem elektryczności.
Rozstrzygnięcie:
Wyjaśnienie: