Chemia - Matura Maj 2023, Poziom rozszerzony (Formuła 2015)
Zadanie 1. (3 pkt)
O dwóch pierwiastkach umownie oznaczonych literami A i X wiadomo, że:
- należą do tego samego bloku konfiguracyjnego
- liczba masowa jednego z izotopów pierwiastka A jest dwa razy większa od jego liczby atomowej i jest równa liczbie atomowej niklu
- suma elektronów, neutronów i protonów w atomie jednego z izotopów pierwiastka X jest równa 114, a liczba nukleonów jest równa 79.
1.1. (0–1)
Uzupełnij tabelę. Wpisz symbol pierwiastka A i symbol pierwiastka X oraz symbol bloku konfiguracyjnego, do którego należą te pierwiastki.
| Symbol pierwiastka | Symbol bloku konfiguracyjnego | |
|---|---|---|
| Pierwiastek A | ||
| Pierwiastek X |
1.2. (0–1)
Napisz fragment konfiguracji elektronowej atomu A (w stanie podstawowym) opisujący rozmieszczenie elektronów walencyjnych na podpowłokach. Zastosuj graficzny zapis konfiguracji elektronowej. W tym zapisie uwzględnij numer powłoki i symbole podpowłok.
1.3. (0–1)
Pierwiastki A i X tworzą związek o wzorze AX4.
Oblicz bezwzględną masę (wyrażoną w gramach) jednej cząsteczki AX4 złożonej jedynie z atomów tych izotopów, które opisano we wstępie do zadania. Przyjmij, że masa atomowa izotopu jest równa jego liczbie masowej.
Zadanie 2. (1 pkt)
Węgiel tworzy kilka odmian alotropowych, które różnią się strukturą krystaliczną. Są wśród nich diament, grafit i fulereny.
Poniżej przedstawiono informacje o jednej z odmian alotropowych węgla, a obok – model jej struktury krystalicznej.
Występuje w postaci miękkiego minerału o słabym metalicznym połysku. Ta odmiana charakteryzuje się dobrym przewodnictwem elektryczności i ciepła.
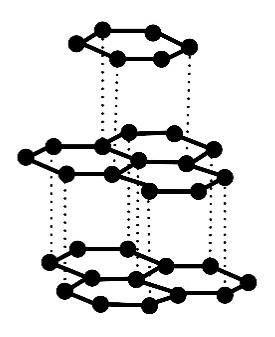
Rozstrzygnij, czy przedstawione informacje dotyczą diamentu czy grafitu. Wyjaśnij, dlaczego ta odmiana charakteryzuje się dobrym przewodnictwem elektryczności.
Rozstrzygnięcie:
Wyjaśnienie:
Zadanie 3. (1 pkt)
Węgiel tworzy kilka odmian alotropowych, które różnią się strukturą krystaliczną. Są wśród nich diament, grafit i fulereny.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Odmienna budowa wewnętrzna diamentu, grafitu i fulerenów jest przyczyną różnic ich właściwości chemicznych, przy zachowaniu identycznych właściwości fizycznych. | P | F |
| 2. | W krysztale diamentu każdy z atomów węgla tworzy kowalencyjne wiązania 𝜎 z czterema otaczającymi go atomami. | P | F |
Zadanie 4. (1 pkt)
Z podanego zbioru:
wybierz i napisz wzór tej drobiny, w której:
- orbitalom walencyjnym atomu centralnego przypisuje się hybrydyzację sp2.
- atom centralny może być akceptorem pary elektronowej.
Zadanie 5. (2 pkt)
Ze względu na zdolność atomów węgla do łączenia się w łańcuchy ten pierwiastek tworzy z tlenem nie tylko związki takie jak CO i CO2, lecz także mniej typowe połączenia. Jednym z nich jest ditlenek triwęgla o wzorze sumarycznym C3O2. Cząsteczka tego związku ma budowę liniową, atomami wewnętrznymi są w niej atomy węgla, a skrajnymi – atomy tlenu. Ditlenek triwęgla reaguje z wodą. W tej reakcji powstaje jeden produkt – kwas dikarboksylowy.
Narysuj wzór elektronowy cząsteczki C3O2 (zaznacz kreskami wiązania chemiczne i wolne pary elektronowe). Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Wzór elektronowy:
Aby wyjaśnić budowę cząsteczki C3O2, hybrydyzację typu sp przypisuje się orbitalom walencyjnym (trzech atomów / dwóch atomów / jednego atomu) węgla. Liczba wiązań σ w cząsteczce C3O2 wynosi (2 / 4 / 6 / 8).
Zadanie 6. (1 pkt)
Ze względu na zdolność atomów węgla do łączenia się w łańcuchy ten pierwiastek tworzy z tlenem nie tylko związki takie jak CO i CO2, lecz także mniej typowe połączenia. Jednym z nich jest ditlenek triwęgla o wzorze sumarycznym C3O2. Cząsteczka tego związku ma budowę liniową, atomami wewnętrznymi są w niej atomy węgla, a skrajnymi – atomy tlenu. Ditlenek triwęgla reaguje z wodą. W tej reakcji powstaje jeden produkt – kwas dikarboksylowy.
Narysuj wzór półstrukturalny (grupowy) produktu reakcji ditlenku triwęgla z wodą.
Zadanie 7. (1 pkt)
W poniższej tabeli podano wzory dwóch związków organicznych: alkoholu benzylowego i etylobenzenu, a także wartości masy molowej oraz temperatury wrzenia tych związków.
Rozstrzygnij, który związek – alkohol benzylowy czy etylobenzen – jest substancją bardziej lotną. Wyjaśnij, dlaczego alkohol benzylowy i etylobenzen znacznie różnią się wartościami temperatury wrzenia. Odnieś się do wpływu różnicy w budowie cząsteczek obu związków na ich właściwości fizykochemiczne.
Rozstrzygnięcie:
Wyjaśnienie:
Zadanie 8. (1 pkt)
Reakcja rozkładu chlorku bromu(I) przebiega w fazie gazowej zgodnie z równaniem:
2BrCl (g) ⇄ Br2 (g) + Cl2 (g)
Wartość stężeniowej stałej równowagi reakcji rozkładu chlorku bromu(I) w temperaturze 500 K jest równa 32.
Reakcja syntezy chlorku bromu(I) przebiega w fazie gazowej zgodnie z równaniem:
Br2 (g) + Cl2 (g) ⇄ 2BrCl (g)
Oblicz wartość stężeniowej stałej równowagi reakcji syntezy chlorku bromu(I) w temperaturze 500 K.
Zadanie 9. (1 pkt)
W wodnych roztworach słabych kwasów jednoprotonowych zachodzi dysocjacja. Dla danej wartości stężenia molowego roztworu i w danej temperaturze ustala się stan równowagi między cząsteczkami i jonami obecnymi w roztworze.
Na poniższym wykresie przedstawiono zależność stopnia dysocjacji (α) dwóch kwasów jednoprotonowych HX i HQ od stężenia molowego roztworu w temperaturze 20 °C.
Rozstrzygnij, na podstawie analizy danych zamieszczonych na wykresie, który kwas (HX czy HQ) jest mocniejszy. Zaznacz jego wzór. Odpowiedź uzasadnij.
Uzasadnienie:
Zadanie 10. (4 pkt)
Sole można otrzymać m.in. w reakcjach:
- soli kwasu I z kwasem II mocniejszym od kwasu I
- wodorotlenku z tlenkiem kwasowym.
10.1. (0–3)
Uzupełnij schemat doświadczenia (s. 9), w którym można otrzymać:
- w kolbie rozpuszczalną w wodzie sól metodą 1.
- w probówce nierozpuszczalną sól metodą 2.
Wzory użytych odczynników wybierz spośród następujących:
Następnie napisz w formie jonowej równania reakcji, które zaszły w kolbie oraz w probówce podczas tego doświadczenia.
Równanie reakcji zachodzącej w kolbie:
Równanie reakcji zachodzącej w probówce:
10.2. (0–1)
Podczas opisanego doświadczenia dodano z wkraplacza do kolby stechiometryczną ilość reagenta.
Spośród czynności, których nazwy podano poniżej, wybierz tę, którą należy wykonać w celu wyodrębnienia jonowego produktu reakcji z mieszaniny poreakcyjnej, powstałej w kolbie. Zaznacz jej nazwę.
Zadanie 11. (1 pkt)
Spośród wymienionych par drobin wybierz i zaznacz wszystkie te, które nie tworzą sprzężonej pary Brønsteda kwas – zasada.
Zadanie 12. (2 pkt)
Przeprowadzono doświadczenie, w którym do dwóch probówek z wodnym roztworem Na2SO3 dodano:
- do probówki 1. – kilka kropel roztworu fenoloftaleiny
- do probówki 2. – nadmiar stężonego HCl (aq).
12.1. (0–1)
Zawartość probówki 1., po dodaniu do niej roztworu fenoloftaleiny, zabarwiła się na kolor czerwonoróżowy (malinowy).
Wpisz do schematu wzory odpowiednich drobin tak, aby powstało równanie procesu decydującego o odczynie roztworu w probówce 1. Zastosuj definicję kwasu i zasady Brønsteda.
12.2. (0–1)
Napisz, co zaobserwowano podczas doświadczenia w probówce 2. po dodaniu odczynnika. Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną zaobserwowanych zmian.
Obserwacje:
Równanie reakcji:
Zadanie 13. (2 pkt)
Badano reakcje mocnego kwasu HA i słabego kwasu HX z mocną zasadą. W tym celu wykonano miareczkowanie wodnych roztworów tych kwasów za pomocą wodnego roztworu wodorotlenku potasu – zgodnie z poniższym opisem.
Umieszczono w zlewce 20,0 cm3 roztworu wybranego kwasu o stężeniu 0,10 mol ∙ dm−3 i zmierzono pH tego roztworu. Następnie do zlewki z roztworem kwasu dodawano porcjami wodny roztwór KOH o stężeniu 0,10 mol ∙ dm−3. Po dodaniu każdej porcji roztworu wodorotlenku mierzono pH mieszaniny reakcyjnej. Punkt równoważnikowy (PR) został osiągnięty po dodaniu takiej objętości roztworu KOH, w jakiej liczba moli zasady jest równa liczbie moli kwasu. Uzyskane wyniki przedstawiono w formie wykresu zależności mierzonego pH od objętości roztworu KOH – naniesione punkty połączono, w wyniku czego otrzymano krzywą miareczkowania.
Poniżej przedstawiono krzywą miareczkowania wodnego roztworu jednego z tych kwasów (HA albo HX) wodnym roztworem wodorotlenku potasu.
Rozstrzygnij, czy przedstawiony wykres ilustruje wyniki miareczkowania wodnego roztworu słabego kwasu HX wodnym roztworem KOH w opisanym doświadczeniu. Odpowiedź uzasadnij – przytocz dwa różne argumenty.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 14. (2 pkt)
W temperaturze 25 °C rozpuszczalność amoniaku w wodzie jest równa 46 g w 100 g wody.
Oblicz pH wodnego roztworu amoniaku nasyconego w tej temperaturze, jeżeli jego gęstość jest równa 0,91 g ∙ cm–3. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Zadanie 15. (1 pkt)
Wymieszano po dwa wodne roztwory różnych soli o stężeniu ok. 0,5 mol ∙ dm−3. W ten sposób otrzymano roztwory A i B, których skład podany jest w poniższej tabeli.
| Roztwór A | Roztwór B |
|---|---|
| NH+4, Ca2+, Cl–, NO–3 | Na+, K+, SO2–3, Br– |
Określ odczyn roztworów A i B.
Odczyn roztworu A:
Odczyn roztworu B:
Zadanie 16. (1 pkt)
Przygotowano wodne roztwory następujących substancji:
- kwasu azotowego(V) o stężeniu 0,5 mol ∙ dm−3
- kwasu octowego (etanowego) o stężeniu 0,5 mol ∙ dm−3
- wodorotlenku baru o pH = 11
- wodorotlenku potasu o pH = 11.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Wartość pH roztworu kwasu azotowego(V) jest (większa niż / mniejsza niż / taka sama jak)
wartość pH roztworu kwasu octowego.
Spośród roztworów o odczynie zasadowym mniejsze stężenie molowe ma roztwór numer
(3 / 4).
Zadanie 17. (2 pkt)
Czysty tlenek wapnia można otrzymać w laboratorium w wyniku prażenia szczawianu wapnia o wzorze CaC2O4. Podczas ogrzewania szczawian wapnia najpierw rozkłada się na węglan wapnia i tlenek węgla(II) (reakcja 1.). Dalsze ogrzewanie, w wyższej temperaturze, prowadzi do rozkładu węglanu wapnia na tlenek wapnia i tlenek węgla(IV) (reakcja 2.). Tlenek wapnia jest ciałem stałym o temperaturze topnienia równej 2858 K. Energicznie reaguje z wodą, a przemianie tej towarzyszy wydzielanie się znacznej ilości ciepła.
17.1. (0–1)
Napisz równanie reakcji, która zachodzi w pierwszym etapie rozkładu termicznego szczawianu wapnia (reakcja 1.), i równanie reakcji, która zachodzi w drugim etapie tego procesu (reakcja 2.).
Równanie reakcji 1.:
Równanie reakcji 2.:
17.2. (0–1)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Tlenek wapnia jest związkiem jonowym. | P | F |
| 2. | Entalpia reakcji tlenku wapnia z wodą Δ𝐻 < 0. | P | F |
Zadanie 18. (2 pkt)
W celu określenia zawartości węglanu wapnia w mieszaninie dwóch soli, zawierającej również węglan magnezu, próbkę tej mieszaniny o masie 2,84 g roztworzono w kwasie. Podczas analizy przebiegły reakcje chemiczne:
CaCO3 (s) + 2H3O+ (aq) → Ca2+ (aq) + CO2 (g) + 3H2O (c)
MgCO3 (s) + 2H3O+ (aq) → Mg2+ (aq) + CO2 (g) + 3H2O (c)
W wyniku zachodzących reakcji otrzymano 672 cm3 tlenku węgla(IV) w przeliczeniu na warunki normalne.
Oblicz wyrażoną w procentach masowych zawartość CaCO3 w badanej próbce mieszaniny.
Zadanie 19. (1 pkt)
Dane w poniższej tabeli pokazują zależność rozpuszczalności amoniaku w wodzie od temperatury.
| Temperatura, °C | 20 | 40 | 60 | 80 |
| Rozpuszczalność, g w 100 g wody | 51 | 34 | 23 | 16 |
Narysuj krzywą rozpuszczalności amoniaku w wodzie w zakresie temperatury od 20 °C do 80 °C i odczytaj – w zaokrągleniu do jedności – wartość rozpuszczalności tego gazu w temperaturze 68 °C. Rozpuszczalność amoniaku w wodzie w podanym zakresie temperatury jest funkcją malejącą.
Rozpuszczalność amoniaku w temperaturze 68 °C: g w 100 g wody.
Zadanie 20. (2 pkt)
Chlorek wapnia tworzy rozpuszczalne hydraty o wzorze ogólnym CaCl2 ∙ 𝑛H2O. W zależności od temperatury w równowadze z roztworem nasyconym pozostają hydraty o różnych wartościach współczynnika 𝑛.
W temperaturze 40 °C jeden z hydratów chlorku wapnia rozpuszcza się w ilości 767,4 g na 100 g wody, a stężenie nasyconego roztworu chlorku wapnia wynosi 53,66% masowych.
Wykonaj obliczenia i napisz wzór opisanego hydratu chlorku wapnia.
Wzór hydratu:
Zadanie 21. (1 pkt)
W środowisku wodnym aniony tiosiarczanowe reagują z chlorem zgodnie ze schematem:
S2O2–3 + Cl2 + H2O → SO2–4 + Cl– + H3O+
Podczas tej reakcji aniony tiosiarczanowe ulegają utlenieniu, które przebiega według schematu:
S2O2–3 + 15H2O → 2SO2–4 + 10H3O+ + 𝑥 e–
Uzupełnij współczynniki stechiometryczne w poniższym schemacie reakcji.
Równanie reakcji:
S2O2–3 + Cl2 + H2O → SO2–4 + Cl– + H3O+
Zadanie 22. (1 pkt)
Technet, podobnie jak mangan, jest pierwiastkiem, który w związkach chemicznych może występować na VI stopniu utlenienia. Jony TcO2−4 są trwałe jedynie w środowisku silnie zasadowym, natomiast w roztworach obojętnych ulegają dysproporcjonowaniu, zgodnie ze schematem:
TcO2−4 + H2O → TcO−4 + TcO2 + OH−
Napisz w formie jonowej skróconej, z uwzględnieniem liczby wymienianych elektronów (zapis jonowo-elektronowy), równanie reakcji redukcji zachodzącej podczas opisanej przemiany. Uwzględnij środowisko reakcji.
Zadanie 23. (1 pkt)
Przeprowadzono doświadczenie, podczas którego do probówek I i II z wodnymi roztworami pewnych substancji dodano jeden, taki sam odczynnik. W obu probówkach zaszły reakcje utleniania i redukcji. Po zakończeniu doświadczenia w obu probówkach widoczny był brunatny osad.
Uzupełnij schemat przeprowadzonego doświadczenia. Zaznacz wzory substancji, których wodne roztwory znajdowały się w probówkach I i II, oraz wzór odczynnika dodanego do obu probówek.
Zadanie 24. (2 pkt)
Pewien alkan, którego achiralne cząsteczki mają rozgałęziony łańcuch węglowy, w temperaturze 𝑇 i pod ciśnieniem 𝑝 jest gazem i ma gęstość 50 razy większą od gęstości wodoru wyznaczonej w tych samych warunkach. W reakcji chlorowania tego alkanu może powstać 6 różnych monochloropochodnych, będących izomerami konstytucyjnymi (bez uwzględniania stereoizomerów).
Oblicz liczbę atomów węgla w cząsteczce opisanego alkanu oraz napisz jego wzór półstrukturalny (grupowy).
Wzór alkanu:
Zadanie 25. (2 pkt)
Reakcję hydratacji (uwodnienia) etenu opisuje równanie:
CH2=CH2 (g) + H2O (g) katalizator, 𝑝, 𝑇 CH3CH2OH (g)
Równowagowy stopień przereagowania etenu, który jest miarą wydajności przedstawionej reakcji, zależy od warunków prowadzenia procesu: temperatury i ciśnienia. Tę zależność przedstawiono na poniższym wykresie.
25.1. (0–1)
Wyjaśnij, dlaczego w danej temperaturze równowagowy stopień przereagowania etenu w opisanej reakcji jest tym większy, im wyższe jest ciśnienie, pod którym prowadzona jest reakcja.
25.2. (0–1)
Rozstrzygnij, czy reakcja hydratacji etenu jest procesem endo- czy egzotermicznym. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 26. (2 pkt)
Na poniższym schemacie zilustrowano ciąg przemian chemicznych. Literami X oraz Y oznaczono produkty organiczne kolejnych przemian.
Napisz w formie jonowej skróconej równania reakcji 1. i 2. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Równanie reakcji 1.:
Równanie reakcji 2.:
Zadanie 27. (1 pkt)
Na poniższym schemacie zilustrowano ciąg przemian chemicznych. Literami X oraz Y oznaczono produkty organiczne kolejnych przemian.
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Organiczny produkt reakcji 3. powstaje w procesie (substytucji / addycji / eliminacji) zachodzącym według mechanizmu (rodnikowego / elektrofilowego / nukleofilowego).
Zadanie 28. (1 pkt)
Poniżej podano wzory półstrukturalne (grupowe) trzech związków organicznych.
Wybierz związek (A, B albo C), którego cząsteczki są chiralne, i napisz literę, którą oznaczono jego wzór. Uzasadnij swój wybór. W uzasadnieniu odwołaj się do budowy cząsteczek tego związku.
Związek:
Uzasadnienie:
Zadanie 29. (2 pkt)
Poniżej podano wzory półstrukturalne (grupowe) trzech związków organicznych.
Każdy ze związków A, B, C ma izomery. Poniżej opisano trzy z nich – oznaczone odpowiednio jako związki A1, B1, C1.
- Związek A1 to izomer związku A, który można utlenić do związku B.
- Związek B1 to izomer związku B, który można zredukować do związku A.
- Związek C1 to izomer związku C, który można otrzymać przez utlenienie związku B.
Narysuj wzory półstrukturalne (grupowe) związków A1, B1 i C1.
| A1 | B1 | C1 |
|---|---|---|
Zadanie 30. (2 pkt)
Fosgen to silnie trujący związek o wzorze COCl2. W reakcjach fosgenu z alkoholami otrzymuje się odpowiednie estry kwasu węglowego, a w procesach polikondensacji z udziałem fosgenu powstają poliwęglany – szeroko stosowane tworzywa zastępujące szkło.
Substratami do otrzymywania fosgenu są tlenek węgla(II) i chlor. W mieszaninie tych gazów zachodzi – pod wpływem światła – odwracalna reakcja opisana równaniem:
CO (g) + Cl2 (g) ⇄ COCl2 (g)
Do reaktora o pojemności 4,0 dm3 wprowadzono gazowe substraty: 0,40 mol CO i 0,20 mol Cl2. Gdy w temperaturze 𝑇 ustaliła się równowaga, stwierdzono, że przereagowało 80% chloru.
Oblicz stężeniową stałą równowagi syntezy fosgenu w temperaturze T.
Zadanie 31. (1 pkt)
Fosgen to silnie trujący związek o wzorze COCl2. W reakcjach fosgenu z alkoholami otrzymuje się odpowiednie estry kwasu węglowego, a w procesach polikondensacji z udziałem fosgenu powstają poliwęglany – szeroko stosowane tworzywa zastępujące szkło.
Substratami do otrzymywania fosgenu są tlenek węgla(II) i chlor. W mieszaninie tych gazów zachodzi – pod wpływem światła – odwracalna reakcja opisana równaniem:
CO (g) + Cl2 (g) ⇄ COCl2 (g)
Napisz równanie reakcji fosgenu z metanolem w stosunku molowym 1 : 2. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 32. (1 pkt)
Fosgen to silnie trujący związek o wzorze COCl2. W reakcjach fosgenu z alkoholami otrzymuje się odpowiednie estry kwasu węglowego, a w procesach polikondensacji z udziałem fosgenu powstają poliwęglany – szeroko stosowane tworzywa zastępujące szkło.
Substratami do otrzymywania fosgenu są tlenek węgla(II) i chlor. W mieszaninie tych gazów zachodzi – pod wpływem światła – odwracalna reakcja opisana równaniem:
CO (g) + Cl2 (g) ⇄ COCl2 (g)
Bisfenol A, którego wzór przedstawiono poniżej, stosuje się do otrzymywania poliwęglanu.
W tym celu bisfenol A poddaje się najpierw reakcji z wodorotlenkiem sodu, która przebiega tak samo jak reakcja tego wodorotlenku z fenolem, a następnie przeprowadza się polikondensację produktu tej reakcji z fosgenem.
Uzupełnij schemat tak, aby powstało równanie reakcji otrzymywania poliwęglanu z bisfenolanu sodu i fosgenu.
Zadanie 33. (3 pkt)
Poniżej przedstawiono wzory półstrukturalne (grupowe) dwóch związków zapachowych: geranialu oraz geraniolu.
33.1. (0–2)
Uzupełnij tabelę. Wpisz formalny stopień utlenienia oraz typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu węgla oznaczonego literą a w cząsteczkach geranialu i geraniolu.
| Stopień utlenienia | Typ hybrydyzacji | |
|---|---|---|
| Geranial | ||
| Geraniol |
33.2. (0–1)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Geraniol jest produktem redukcji geranialu. | P | F |
| 2. | W cząsteczce geranialu liczba wiązań 𝜋 jest większa niż w cząsteczce geraniolu. | P | F |
Zadanie 34. (1 pkt)
Badano właściwości czterech kwasów. Podczas doświadczenia stwierdzono, że zachodzą następujące reakcje:
CHCl2–COOH + CH2Cl–COONa → CHCl2–COONa + CH2Cl–COOH
CH2Cl–COOH + CH3–COONa → CH2Cl–COONa + CH3–COOH
CH2Cl–COOH + C6H5–COONa → CH2Cl–COONa + C6H5–COOH
a reakcja:
C6H5–COONa + CH3–COOH → nie zachodzi
Na podstawie wyników przeprowadzonego doświadczenia uporządkuj badane kwasy od najsłabszego do najmocniejszego.
Zadanie 35. (2 pkt)
Kwas 4-aminobenzoesowy (PABA) jest substratem do produkcji niektórych leków oraz jednym z substratów enzymatycznej syntezy kwasu foliowego. Poniżej przedstawiono schemat syntezy kwasu 4-aminobenzoesowego z toluenu.
Poniżej wymieniono sześć odczynników:
- KMnO4 (aq) / H2SO4 (aq)
- HCl (aq) / Zn (s)
- NH4Cl (aq)
- HNO3 (stężony) / H2SO4 (stężony)
- odczynnik Tollensa
- NaOH (aq)
Spośród wymienionych odczynników wybierz wszystkie te, które należy zastosować w kolejnych etapach syntezy PABA (reakcje I–III). Napisz numery, którymi oznaczono wzory tych odczynników.
Reakcja I:
Reakcja II:
Reakcja III:
Zadanie 36. (2 pkt)
Ester o wzorze sumarycznym C5H10O2 poddano hydrolizie w środowisku kwasowym i otrzymano kwas A oraz alkohol X. W wyniku przeprowadzonych badań kwasu i alkoholu ustalono, że:
- po tym, jak do roztworu manganianu(VII) potasu zakwaszonego kwasem siarkowym(VI) dodano wodny roztwór kwasu A, nastąpiło odbarwienie zawartości probówki, a także zaobserwowano wydzielenie bezbarwnego i bezwonnego gazu
- w wyniku przepuszczenia oparów alkoholu X nad rozżarzonym tlenkiem miedzi(II) powstaje związek, który nie wykazuje właściwości redukujących w próbie Tollensa.
Uzupełnij poniższą tabelę. Narysuj wzory półstrukturalne (grupowe) kwasu A i alkoholu X oraz napisz nazwę systematyczną alkoholu X.
| Wzór kwasu A | Wzór alkoholu X | Nazwa alkoholu X |
|---|---|---|
Zadanie 37. (2 pkt)
Do zakwaszonego roztworu alaniny dodawano kroplami wodny roztwór wodorotlenku sodu i mierzono pH mieszaniny reakcyjnej. Na poniższym wykresie zilustrowano zależność pH mieszaniny od objętości dodanego roztworu wodorotlenku sodu (w jednostkach umownych).
Aminokwasy w roztworach wodnych istnieją głównie w formie jonów. W roztworach o niskim pH cząsteczka aminokwasu jest protonowana. W pewnym zakresie pH dominującą formą jest jon obojnaczy. W roztworach o wysokim pH cząsteczka aminokwasu traci proton. W punkcie oznaczonym na wykresie numerem I alanina jest mieszaniną formy protonowanej i jonu obojnaczego w stosunku molowym 1 : 1, a w punkcie oznaczonym na wykresie numerem III ten aminokwas jest mieszaniną jonu obojnaczego i formy zdeprotonowanej w stosunku molowym 1 : 1.
37.1. (0–1)
Napisz wzór półstrukturalny (grupowy) tej formy alaniny, która występuje przy wartości pH odpowiadającej punktowi II zaznaczonemu na wykresie. Podaj nazwę tej wartości pH.
Wzór:
Nazwa:
37.2. (0–1)
Spośród poniższych wzorów form alaniny wybierz i zaznacz wzory tych, które obecne są w roztworze o wartości pH odpowiadającej punktowi III, zaznaczonemu na wykresie.
Zadanie 38. (1 pkt)
Pewien łańcuchowy peptyd ma wzór sumaryczny C9H17N3S2O4 i tworzą go tylko reszty alaniny i cysteiny. Wiadomo także, że na obu końcach tego peptydu znajduje się ten sam aminokwas.
Ustal sekwencję aminokwasów w analizowanym peptydzie i napisz jego wzór. Zastosuj trzyliterowe kody aminokwasów.
