Chemia - Biomedica 2022, Poziom rozszerzony (Formuła 2015)
Arkusz 30 zadań sporządzony na podstawie wybranych zadań autorskich ze zbioru zadań z chemii matura 2022 wydawnictwa Biomedica. Pełny zbiór zadań można zakupić na stronie sklepmaturalny.pl

Zadanie 1. (2 pkt)
Pierwiastek X należy do metali ziem alkalicznych. Pierwiastek ten jest składnikiem minerału o nazwie dolomit. Dodatkowo wiadomo, że jon pierwiastka X ma największą zdolność do hydratacji spośród berylowców. Liczba neutronów w atomie tego pierwiastka jest równa dwukrotnej ilości elektronów walencyjnych atomu siarki.
1.1. (0-1)
Ustal i zapisz konfigurację elektronową dla jonu X2+.
1.2. (0-1)
Zapisz konfigurację elektronową drugiego atomu wchodzącego w skład dolomitu (dotyczy metalu ziem alkalicznych).

Zadanie 2. (1 pkt)
Metody izotopowe znalazły zastosowanie przy określaniu wieku wykopalisk. W takich przypadkach oznaczana jest zawartość promieniotwórczego izotopu węgla 146C.
Zapisz równanie przemiany promieniotwórczej wiedząc, że izotop węgla, o którym mowa w informacji wstępnej powstaje w wyniku bombardowania jąder azotu neutronami.

Zadanie 3. (3 pkt)
Poniższy wykres ilustruje zanik promieniotwórczych nuklidów (oznaczonych 1, 2, 3) w zależności od czasu.
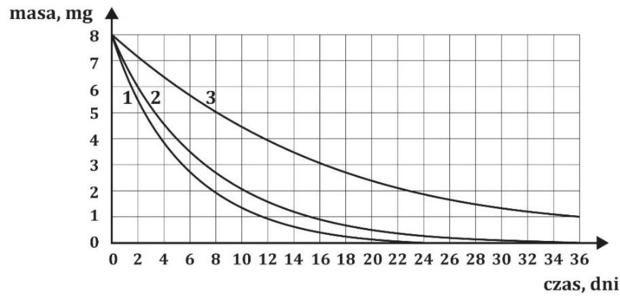
3.1. (0-1)
Podaj, który z przedstawionych na wykresie nuklidów (1, 2, 3) jest najmniej stabilnym izotopem.
3.2. (0-1)
Oszacuj czas połowicznego rozpadu izotopu oznaczonego nr 2.
3.3. (0-1)
Oblicz, jaki procent pierwotnej masy nuklidu nr 3 pozostanie po upływie 60 dni. Do obliczeń czas półtrwania nuklidu nr 3 należy zaokrąglić do liczb całkowitych.

Zadanie 4. (2 pkt)
Oceń poprawność podanych stwierdzeń. Zaznacz P, jeśli zdanie jest prawdziwe lub F, jeśli zdanie jest fałszywe. Następnie zapisz wszystkie błędne zdania w poprawnej wersji.
| 1. | Wiązanie metaliczne jest ukierunkowane. | P | F |
| 2. | W cząsteczce SO2 występują 2 wiązania koordynacyjne. | P | F |
| 3. | Cząsteczka SO3 ma kształt trójkąta równobocznego. | P | F |
| 4. | Dla SF6 liczba koordynacyjna wynosi 7. | P | F |
| 5. | W cząsteczce HF wspólna para elektronowa przesunięta jest w stronę atomu fluoru. | P | F |

Zadanie 5. (2 pkt)
Temperatury wrzenia związków organicznych zależą od ich budowy, kształtu oraz wiązań występujących w ich cząsteczkach oraz pomiędzy ich cząsteczkami. Duże znaczenie ma też masa cząsteczkowa.
Podkreśl w poszczególnych podpunktach związek organiczny o wyższej temperaturze wrzenia. Wyjaśnij, dlaczego ma on wyższą temperaturę wrzenia.
- metan, etan
- etan, eten
- butan, 2-metylopropan
- etanol, kwas metanowy

Zadanie 6. (3 pkt)
Przeprowadzono prażenie kredy pastewnej (skała pochodzenia osadowego). Kreda pastewna stosowana jest do produkcji pasz dla zwierząt. Zawiera ona 10% domieszek (węglan magnezu, minerały ilaste, tlenek glinu, tlenki żelaza i tlenek krzemu(IV)). W wyniku reakcji otrzymano 36 g tlenku wapnia. Dodatkowo wiadomo, że reakcję przerwano w momencie, gdy otrzymano 86% produktu możliwego do otrzymania.
6.1. (0-1)
Oblicz, ile gramów kredy pastewnej poddano prażeniu.
6.2. (0-2)
Oblicz, ile cząsteczek gazu mogłoby się jeszcze wydzielić, gdyby kontynuowano prażenie.

Zadanie 7. (1 pkt)
Do 200 g 15% roztworu azotanu(V) cynku dodawano powoli 500 cm3 roztworu wodorotlenku potasu.
Oblicz minimalne stężenie wodorotlenku potasu potrzebne, aby uzyskać w wyniku zachodzących reakcji klarowny roztwór. Wynik podaj z dokładnością do drugiego miejsca po przecinku.

Zadanie 8. (2 pkt)
W wyniku reakcji kwasu bromowodorowego z kwasem bromowym(V) powstaje brom i woda. Równanie kinetyczne tej reakcji ma postać:
v = k[Br−][BrO−3][H+]2
8.1. (0-1)
Napisz równanie tej reakcji w formie jonowej skróconej. Uzupełnij współczynniki reakcji za pomocą bilansu jonowo-elektronowego z uwzględnieniem oddanych i przyjętych elektronów.
8.2. (0-1)
Jak zmieni się szybkość tej reakcji, jeśli stężenie każdego z substratów zmaleje dwukrotnie?
Odpowiedź:

Zadanie 9. (1 pkt)
Oceń poprawność podanych stwierdzeń dotyczących szybkości reakcji chemicznych. Zaznacz P jeśli zdanie jest prawdziwe lub F, jeśli zdanie jest fałszywe.
| 1. | Podwyższenie ciśnienia substratów gazowych powoduje spowolnienie przebiegu reakcji. | P | F |
| 2. | Związki o budowie jonowej reagują szybciej niż związki o budowie cząsteczkowej. | P | F |
| 3. | Katalizatory dodatnie obniżają energię aktywacji oraz zwiększają wydajność reakcji. | P | F |
| 4. | Podwyższenie temperatury dla odwracalnej reakcji egzotermicznej jest niekorzystne, ponieważ mimo że reakcja biegnie szybciej, to stała równowagi maleje, a więc wydajność procesu zmniejsza się. | P | F |

Zadanie 10. (1 pkt)
Poniżej przedstawiono zapis dwóch równań reakcji chemicznych:
2C (s) + H2 (g) → C2H2 (g) ΔH°tw = 226 kJmol
C2H2 (g) + 52 O2 (g) → 2CO2 (g) + H2O (g) ΔH°sp = −1283 kJmol
Oceń poprawność podanych stwierdzeń. Zaznacz P, jeśli zdanie jest prawdziwe lub F, jeśli zdanie jest fałszywe.
| 1. | Reakcja tworzenia acetylenu jest reakcją endoenergetyczną. | P | F |
| 2. | Reakcja spalania acetylenu jest reakcją endoenergetyczną. | P | F |
| 3. | Jeśli zmniejszymy o połowę ilość substratów w reakcji egzoenergetycznej, to jej efekt energetyczny wyniesie -641,5 kJ. | P | F |
| 4. | Jeśli będziemy chcieli otrzymać 2 mole acetylenu, to efekt energetyczny takiej reakcji wyniesie 452 kJ. | P | F |

Zadanie 11. (2 pkt)
Przeprowadzono reakcję pewnego aktywnego chemicznie metalu z wodą. Metal ten reaguje gwałtownie z wodą (szybko się porusza po powierzchni wody). W reakcji tej wydzieliło się 0,112 dm3 wodoru (warunki normalne). Otrzymany roztwór o objętości 150 cm3 zmieszano z 1500 cm3 HCl o stężeniu 0,01 moldm3.
Oblicz pH otrzymanego roztworu.

Zadanie 12. (1 pkt)
Rozpuszczalność molową substancji trudno rozpuszczalnej w wodzie wyrażamy za pomocą stężenia molowego nasyconego roztworu tej substancji i oznaczamy literą S. Często używaną wielkością dla substancji trudno rozpuszczalnych w wodzie jest iloczyn rozpuszczalności, oznaczany symbolem Kso lub Ir. Iloczyn rozpuszczalności jest to iloczyn stężeń jonów powstałych w wyniku dysocjacji substancji rozpuszczalnej w nasyconym roztworze tej substancji, podniesionych do odpowiednich potęg, będących współczynnikami stechiometrycznymi w równaniu dysocjacji tej substancji.
AxBy ⇄ xAy+ + yBx−
KSo = [Ay+]x · [Bx−]y
Oblicz rozpuszczalność molową wodorotlenku magnezu w wodzie, jeżeli jego iloczyn rozpuszczalności wynosi 3,2 · 10−11.

Zadanie 13. (1 pkt)
Oblicz wartość stałej dysocjacji kwasu dichlorooctowego wiedząc, że stopień dysocjacji kwasu dichlorooctowego w roztworze wodnym o stężeniu 0,01 mol/dm3 wynosi 85%.

Zadanie 14. (1 pkt)
Zmieszano 200 cm3 0,2-molowego roztworu wodorotlenku sodu z 25 cm3 35% roztworu kwasu solnego o gęstości 1,176 g/cm3.
Oblicz stężenie molowe otrzymanej soli. Wynik podaj z dokładnością do trzeciego miejsca po przecinku.

Zadanie 15. (1 pkt)
Podczas miareczkowania szczawianu sodu Na2C2O4 roztworem KMnO4 zachodzą następujące reakcje redoks:
MnO4− + 5e− + 8H+ ⇄ Mn2+ + 4H2O
C2O2−4 ⇄ 2CO2 + 2e−
Wykorzystując powyższe reakcje, oblicz stężenie molowe roztworu nadmanganianu potasu wiedząc, że na zmiareczkowanie odważki 0,24 g szczawianu sodu zużyto 38 cm3 roztworu KMnO4. Wynik zaokrąglij do trzech miejsc po przecinku.

Zadanie 16. (3 pkt)
Wywoływacz fotograficzny często zawiera związek zwany hydrochinonem (nazwa systematyczna: benzeno-1,4-diol). Redukuje on jony srebra powstałe na błonie fotograficznej podczas jej naświetlania do metalicznego srebra, sam utleniając się do chinonu, czyli cykloheksa-2,5-dieno-1,4-dionu. Powstaje wtedy obraz negatywowy, który należy jeszcze utrwalić, wypłukując z błony fotograficznej pozostały AgBr za pomocą utrwalacza.
16.1. (0-1)
Napisz w postaci jonowej skróconej, używając wzorów półstrukturalnych związków organicznych, równanie reakcji zachodzącej podczas wywoływania obrazu negatywowego na błonie fotograficznej za pomocą roztworu hydrochinonu. Współczynniki dobierz za pomocą bilansu jonowo-elektronowego.
Równanie reakcji:
Równanie reakcji utleniania:
Równanie reakcji redukcji:
16.2. (0-1)
Określ, który związek pełni w tej reakcji rolę utleniacza, a który reduktora.
Utleniacz:
Reduktor:
16.3. (0-1)
Czy hydrochinon i chinon są związkami aromatycznymi?

Zadanie 17. (3 pkt)
Poniżej przedstawiony jest schemat reakcji:
17.1. (0-1)
Określ stopnie utlenienia atomów azotu w cząsteczce nitrobenzenu i aniliny. Wypełnij tabelę, wpisując stopień utlenienia atomu azotu.
17.2. (0-1)
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania procesów redukcji i utleniania, zachodzących podczas tej przemiany.
Równanie reakcji utleniania:
Równanie reakcji redukcji:
17.3. (0-1)
Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.

Zadanie 18. (2 pkt)
Niektóre metale ulegają pasywacji w kwasach utleniających. Tak dzieje się na przykład w przypadku glinu.
18.1. (0-1)
Przeprowadzono w temperaturze pokojowej doświadczenie zobrazowane na poniższym schemacie.
Przeanalizuj przedstawione doświadczenie i napisz, w których probówkach zajdzie reakcja chemiczna.
18.2. (0-1)
Zapisz obserwacje będące dowodem zachodzących reakcji w tych probówkach.

Zadanie 19. (2 pkt)
Pewien pierwiastek (metal z bloku konfiguracyjnego d) tworzy sól XSO4. Bezwodna sól tego metalu jest koloru białego, natomiast pięciowodna ma intensywny niebieski kolor. W przypadku, gdy ogrzewamy pentahydrat XSO4 w temperaturze 375 K traci on 2 cząsteczki wody, natomiast ogrzewanie do temperatury powyżej 470 K pozwala uzyskać sól bezwodną.
19.1. (0-1)
Podaj wzór sumaryczny soli, o której mowa w informacji wstępnej.
19.2. (0-1)
Pentahydrat XSO4 ogrzano do temperatury 200°C.
Podaj wzór sumaryczny soli otrzymanej po ogrzaniu do tej temperatury.

Zadanie 20. (3 pkt)
Student miał za zadanie dobrać prawidłową metodę pozwalającą na otrzymanie magnezu. Z wykładów pamięta, że należy przeprowadzić elektrolizę MgCl2. Niestety nie pamięta szczegółów.
20.1. (0-1)
Wybierz prawidłowe dokończenie zdania. Podkreśl jedną odpowiedź spośród podanych.
Do otrzymania magnezu można wykorzystać elektrolizę stopionego MgCl2 / wodnego roztworu MgCl2.
20.2. (0-1)
Wyjaśnij, dlaczego jedna z metod nie pozwala na otrzymanie magnezu.
20.3. (0-1)
Zapisz równania reakcji chemicznych, które zachodzą podczas procesu elektrolizy, o którym mowa w informacji wstępnej.

Zadanie 21. (1 pkt)
Oceń poprawność podanych stwierdzeń. Zaznacz P, jeśli zdanie jest prawdziwe lub F, jeśli zdanie jest fałszywe.
| 1. | Węglowodór o wzorze sumarycznym C6H12 odbarwia wodę bromową. | P | F |
| 2. | Benzen rozpuszcza się w wodzie. | P | F |
| 3. | W wyniku reakcji addycji wodoru do benzenu otrzymujemy heksen. | P | F |
| 4. | W reakcji substytucji atomu wodoru atomem bromu w toluenie, bromek żelaza(III) pełni funkcję inhibitora. | P | F |
| 5. | Grupa metylowa jest dezaktywatorem, który kieruje inne podstawniki w położenie orto lub para. | P | F |

Zadanie 22. (3 pkt)
Przeprowadzono doświadczenie, którego schemat przedstawiono na poniższym rysunku:
22.1. (0-1)
Napisz, jakie obserwacje towarzyszyły przeprowadzonej reakcji.
22.2. (0-1)
Napisz równanie reakcji przebiegającej w probówce po dodaniu toluenu wraz z opiłkami żelaza.
22.3. (0-1)
Określ typ reakcji zachodzącej podczas przeprowadzonego doświadczenia. Podkreśl poprawną odpowiedź.

Zadanie 23. (2 pkt)
Grupa hydroksylowa obecna w fenolach, uaktywnia pierścień aromatyczny na podstawienie elektrofilowe z powodu sprzęgania wolnej pary elektronowej z atomu tlenu z sekstetem elektronowym pierścienia aromatycznego. Uaktywnione na tę substytucję są wtedy pozycje orto- i para- w stosunku do grupy hydroksylowej. Substytucja elektrofilowa zachodzi wtedy łatwo, nie wymaga katalizatorów, co więcej podstawniki wchodzą we wszystkie możliwe pozycje orto- i para- w jednym produkcie.
Napisz równania reakcji fenolu z bromem (reakcja 1.) oraz ze stężonym kwasem azotowym(V) (reakcja 2.). Nazwij produkty tych reakcji.
Reakcja 1.:
Reakcja 2.:

Zadanie 24. (2 pkt)
W reakcji Küczerowa można otrzymać etanal lub ketony, działając na odpowiednie alkiny wodą w obecności siarczanu(VI) rtęci(II) oraz kwasu siarkowego(VI). Nietrwałymi produktami przejściowymi w tych reakcjach są enole, czyli nienasycone alkohole z podwójnym wiązaniem przy atomie węgla połączonym z grupą hydroksylową. W mieszaninie poreakcyjnej ustala się stan równowagi między enolami a związkami karbonylowymi, przesunięty bardzo mocno w stronę związków karbonylowych z powodu nietrwałości enoli. Przemianę enoli w związki karbonylowe lub odwrotnie nazywamy tautomerią keto-enolową nawet wtedy, kiedy produktem jest aldehyd, a nie keton. Jedynym aldehydem, który możemy otrzymać w reakcji Küczerowa jest etanal. Z reakcji dłuższych alkinów z wodą otrzymujemy ketony.
Napisz równanie reakcji pent-2-ynu z wodą w obecności odpowiednich katalizatorów. Uwzględnij oba możliwe produkty przejściowe i ujmij je w nawiasy kwadratowe. Jako ostateczne produkty napisz wzory obu możliwych do otrzymania w tej reakcji związków karbonylowych. Napisz nazwy otrzymanych związków karbonylowych.

Zadanie 25. (2 pkt)
Próba jodoformowa wykrywa obecność grupy acetylowej w związkach organicznych. Jest to reakcja z jodem i wodorotlenkiem sodu. Pozytywny wynik tej próby dają wszystkie metyloketony, etanal, kwas octowy oraz etanol i wszystkie alkohole zawierające grupę hydroksylową przy atomie węgla połączonym z grupą metylową.
25.1. (0-1)
Uzasadnij fakt, że pozytywny wynik próby jodoformowej dają również niektóre alkohole, mimo że nie zawierają grupy acetylowej.
25.2. (0-1)
Napisz równanie reakcji jodoformowej dla etanalu i etanolu. Współczynniki uzupełnij metodą bilansu elektronowego.

Zadanie 26. (1 pkt)
Kwasy karboksylowe są kwasami słabymi elektrolitycznie. Kwas metanowy jest najmocniejszym kwasem spośród kwasów alkanowych, jednak i on nie jest mocnym elektrolitem. Moc kwasów karboksylowych zwiększa się jednak wyraźnie, jeśli zawierają one jako podstawnik atom lub atomy fluorowca. Efekt ten jest tym większy:
- im więcej atomów fluorowca zawiera cząsteczka danego kwasu,
- im bliżej grupy karboksylowej położony jest atom fluorowca,
- im aktywniejszy jest dany fluorowiec, czyli im wyżej jest położony w 17. grupie układu okresowego.
Korzystając z podanych wyżej informacji, uszereguj następujące kwasy od najmocniejszego do najsłabszego za pomocą wzorów półstrukturalnych (grupowych):
kwas etanowy, kwas chloroetanowy, kwas trichloroetanowy, kwas 3-chloropropanowy, kwas 3-bromopropanowy, kwas trifluoroetanowy

Zadanie 27. (2 pkt)
Przeprowadzono doświadczenia zobrazowane na poniższym schemacie.
27.1. (0-1)
Uzupełnij tabelkę. Zapisz nazwy systematyczne produktów powyższej reakcji i napisz jakiego pH roztworu każdego z produktów można się spodziewać.
| Produkt | Nazwa systematyczna | pH |
|---|---|---|
| 1 | ||
| 2 |
27.2. (0-1)
Zapisz równanie reakcji hydrolizy dla produktu, który ulega tej reakcji.

Zadanie 28. (3 pkt)
Przeprowadzono doświadczenie zilustrowane poniższym schematem:
Przeanalizuj przedstawione doświadczenie, a następnie wykonaj poniższe polecenia.
28.1. (0-1)
Napisz przewidywane obserwacje dla probówki 1. i 2.
Probówka 1.:
Probówka 2.:
28.2. (0-1)
Na podstawie przeprowadzonego doświadczenia sformuj wniosek dla probówki 1. i 2.
Probówka 1.:
Probówka 2.:
28.3. (0-1)
Zapisz równanie reakcji w formie jonowej skróconej, która zaszła w probówce 2.

Zadanie 29. (3 pkt)
Grupę aldehydową aldozy można w łatwy sposób zredukować za pomocą wodoru, wykorzystując jako katalizator nikiel.
29.1. (0-1)
Zapisz równanie reakcji glukozy (stosując wzory grupowe) z wodorem w obecności Ni.
29.2. (0-1)
Podaj nazwę systematyczną produktu reakcji.
29.3. (0-1)
Do jakiej grupy związków organicznych należy produkt reakcji.

Zadanie 30. (2 pkt)
Przeprowadzono doświadczenie zgodnie z poniższym schematem:
30.1. (0-1)
Napisz, co zaobserwowano podczas tego doświadczenia.
Probówka 1.:
Probówka 2.:
30.2. (0-1)
Na podstawie przeprowadzonego doświadczenia sformułuj wniosek.

