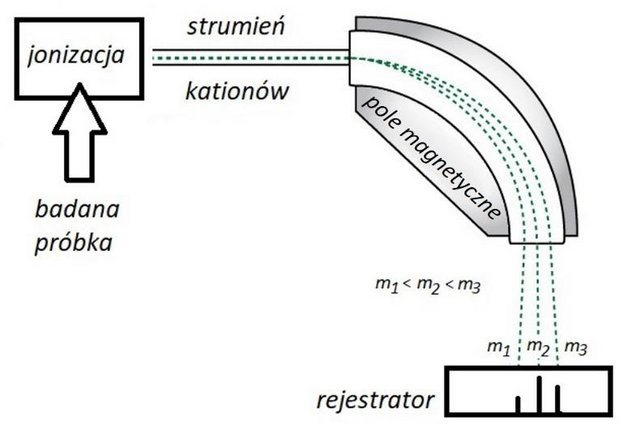
Test diagnostyczny CKE Grudzień 2022, Poziom rozszerzony (Formuła 2023) - Zadanie 21. (2 pkt)
Jedną z metod analizy instrumentalnej jest spektrometria mas. Podczas takiej analizy badana próbka (w fazie gazowej) jest poddawana jonizacji. Cząsteczki tracą elektrony i stają się kationami oraz ulegają fragmentacji, w wyniku której powstają mniejsze kationy. Następnie wiązka kationów przechodzi przez pole magnetyczne, w którym tor jej ruchu ulega zakrzywieniu. Wielkość zakrzywienia zależy od stosunku masy do ładunku i dla jednododatnich kationów jest odwrotnie proporcjonalna do ich masy. W ten sposób kationy o różnych masach zostają rozdzielone i odpowiadają im oddzielne piki w otrzymanym widmie masowym. Wysokość tych pików (intensywność) jest proporcjonalna do zawartości odpowiednich kationów w próbce. Cząsteczkom, które uległy jonizacji, ale nie uległy fragmentacji, odpowiadają tzw. piki molekularne o największej masie. Poniżej przedstawiono uproszczony schemat działania spektrometru mas.
Niżej przedstawiono fragment widma masowego bromu, na którym są widoczne piki molekularne pochodzące od kationów Br+2 o różnym składzie izotopowym. Intensywność sygnałów (wysokość pików) jest mierzona względem najwyższego piku molekularnego.
Na poniższym fragmencie widma masowego chlorobenzenu pokazano trzy piki, oznaczone numerami 1 (pik fragmentacyjny) oraz 2, 3 (piki molekularne).
Wpisz do tabeli wzory sumaryczne kationów odpowiadających kolejnym pikom. Jeśli w jonie występuje chlor, podaj jego liczbę masową. Wyjaśnij, dlaczego dwa piki molekularne znacznie różnią się pod względem wysokości.
| Numer piku | Wzór kationu |
|---|---|
| 1 | |
| 2 | |
| 3 |
Wyjaśnienie: