Matura Maj 2022, Poziom rozszerzony (Formuła 2015) - Zadanie 5. (2 pkt)
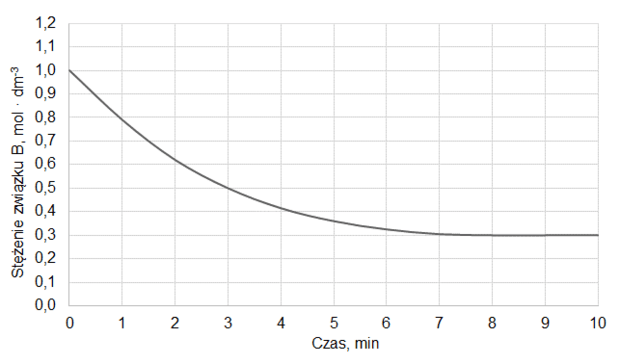
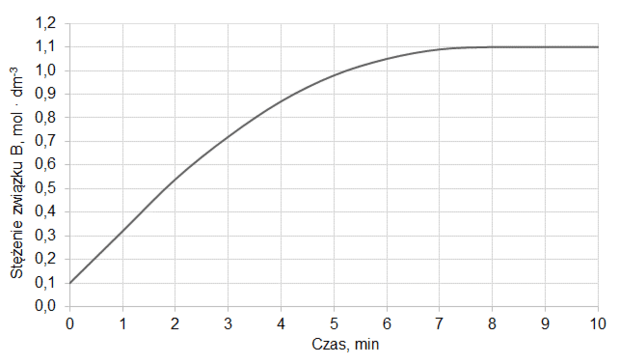
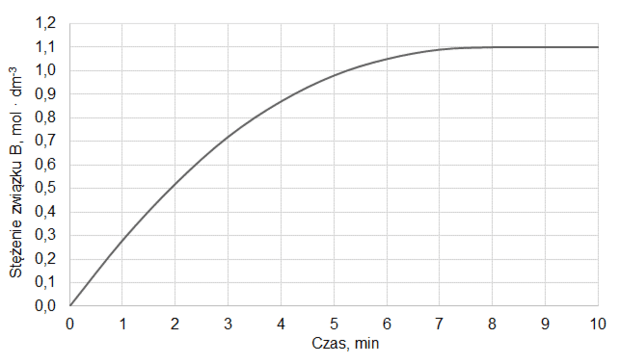
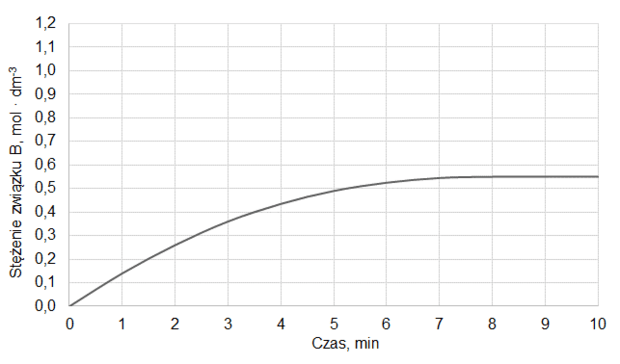
Do reaktora o pojemności 1,0 dm3 wprowadzono pewną liczbę moli substancji A oraz pewną liczbę moli substancji B. Reaktor zamknięto i zainicjowano reakcję chemiczną, która przebiegała w stałej temperaturze T zgodnie z równaniem:
A (g) + B (g) ⇄ C (g) + D (g)
Do momentu ustalenia stanu równowagi przereagowało 20 % substancji A. W tych warunkach stężeniowa stała równowagi opisanej reakcji jest równa 2,0.
Oblicz, jaki procent liczby moli wyjściowej mieszaniny stanowiła substancja A.