Matura Maj 2023, Poziom rozszerzony (Formuła 2023) - Zadanie 22. (1 pkt)
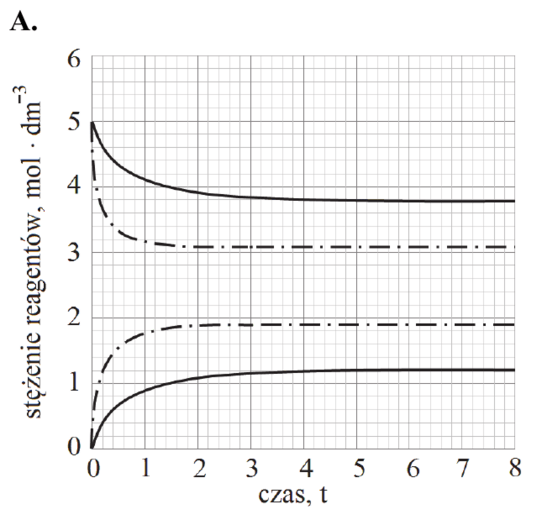
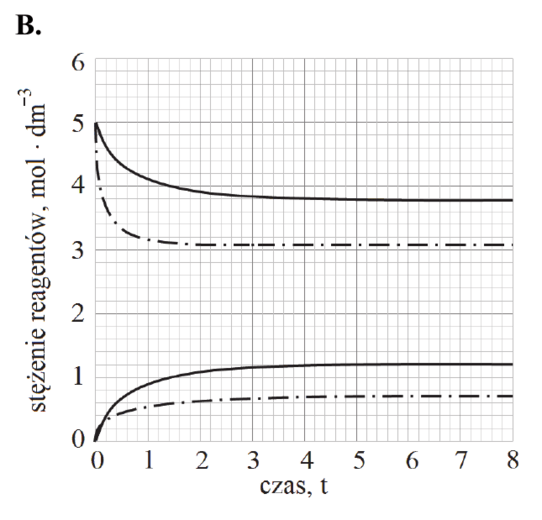
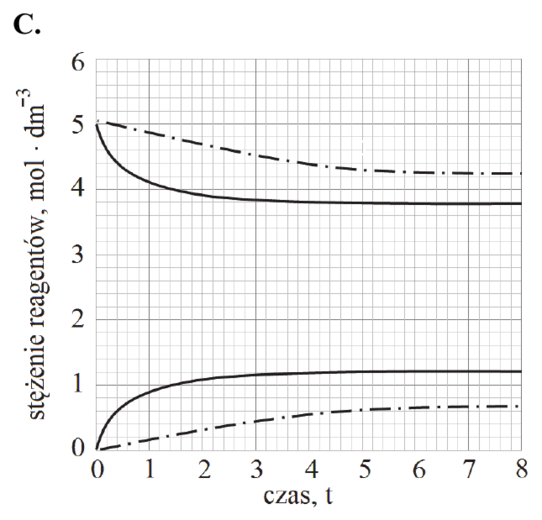
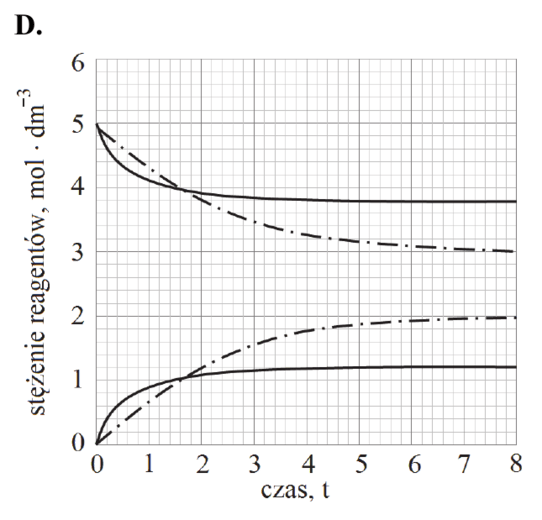
Reakcję hydratacji (uwodnienia) etenu opisuje równanie:
CH2=CH2 (g) + H2O (g) katalizator, 𝑝, 𝑇 CH3CH2OH (g)
Równowagowy stopień przereagowania etenu, który jest miarą wydajności przedstawionej reakcji, zależy od warunków prowadzenia procesu: temperatury i ciśnienia. Tę zależność przedstawiono na poniższym wykresie.
Rozstrzygnij, czy reakcja hydratacji etenu jest procesem endo- czy egzotermicznym. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie: