Chemia - Matura Czerwiec 2023, Poziom rozszerzony (Formuła 2015)
Zadanie 1. (1 pkt)
O atomach dwóch pierwiastków należących do czwartego okresu układu okresowego, oznaczonych umownie literami X i E, wiadomo, że w stanie podstawowym:
- atom pierwiastka X ma w zewnętrznej powłoce cztery elektrony sparowane i dwa niesparowane
- w atomie pierwiastka E liczba elektronów, które mogą brać udział w tworzeniu wiązań, jest taka sama jak w atomie pierwiastka X, ale te elektrony są rozmieszczone na dwóch powłokach.
Wpisz do tabeli symbole chemiczne pierwiastków X i E, numer grupy i symbol bloku konfiguracyjnego, do których należy każdy z pierwiastków.
| Symbol pierwiastka | Numer grupy | Symbol bloku konfiguracyjnego | |
|---|---|---|---|
| pierwiastek X | |||
| pierwiastek E |
Zadanie 2. (2 pkt)
O atomach dwóch pierwiastków należących do czwartego okresu układu okresowego, oznaczonych umownie literami X i E, wiadomo, że w stanie podstawowym:
- atom pierwiastka X ma w zewnętrznej powłoce cztery elektrony sparowane i dwa niesparowane
- w atomie pierwiastka E liczba elektronów, które mogą brać udział w tworzeniu wiązań, jest taka sama jak w atomie pierwiastka X, ale te elektrony są rozmieszczone na dwóch powłokach.
Pierwiastki X i E mogą przyjmować w związkach chemicznych różne stopnie utlenienia.
2.1. (0–1)
Napisz najwyższy i najniższy stopień utlenienia, jaki może przyjmować pierwiastek X w związkach chemicznych.
Najwyższy stopień utlenienia:
Najniższy stopień utlenienia:
2.2. (0–1)
Przeprowadzono doświadczenie, którego wynik przedstawiono w tabeli. Znakiem + oznaczono te układy, w których zaobserwowano objawy reakcji.
| NaOH (aq) | HCl (aq) | H2O | |
|---|---|---|---|
| Tlenek I | + | + | |
| Tlenek II | + | + | |
| Tlenek III | + |
Napisz wzory trzech różnych tlenków pierwiastka E, spełniających podane warunki.
Tlenek I:
Tlenek II:
Tlenek III:
Zadanie 3. (1 pkt)
Na podstawie budowy atomów pierwiastków należących do grup 13.–17. i okresów 2.–6. układu okresowego uzupełnij poniższe zdanie. Wpisz symbol lub nazwę odpowiedniego pierwiastka, tak aby powstało zdanie prawdziwe.
Spośród pierwiastków należących do grup 13.–17. i okresów 2.–6.
- najmniejszy ładunek jądra ma atom
- najmniejszy promień atomowy ma atom
- największą wartość pierwszej energii jonizacji ma atom
Zadanie 4. (1 pkt)
Uzupełnij zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
- Tlen i siarka tworzą wodorki typu H2E. Energia oddziaływań pomiędzy cząsteczkami wody jest (większa / mniejsza) niż energia odziaływań pomiędzy cząsteczkami siarkowodoru.
- Woda w postaci lodu tworzy kryształ (molekularny / kowalencyjny).
Zadanie 5. (1 pkt)
Stapianie tlenku krzemu(IV) z wodorotlenkiem sodu pozwala otrzymać różne krzemiany, w zależności od stosunku molowego substratów tej reakcji. Wskutek hydrolizy wodnego roztworu tetraoksokrzemianu(IV) sodu, czyli Na4SiO4, tworzy się roztwór silnie alkaliczny. Taki roztwór obok cząsteczek kwasu tetraoksokrzemowego(IV) zawiera wszystkie rodzaje wodoroanionów tego kwasu.
Napisz w formie cząsteczkowej równanie reakcji otrzymywania tetraoksokrzemianu(IV) sodu opisaną metodą. Oblicz stosunek masowy substratów.
Równanie reakcji:
Stosunek masowy:
m(SiO2)m(NaOH) =
Zadanie 6. (1 pkt)
Stapianie tlenku krzemu(IV) z wodorotlenkiem sodu pozwala otrzymać różne krzemiany, w zależności od stosunku molowego substratów tej reakcji. Wskutek hydrolizy wodnego roztworu tetraoksokrzemianu(IV) sodu, czyli Na4SiO4, tworzy się roztwór silnie alkaliczny. Taki roztwór obok cząsteczek kwasu tetraoksokrzemowego(IV) zawiera wszystkie rodzaje wodoroanionów tego kwasu.
Napisz wzór sumaryczny tego wodoroanionu kwasu tetraoksokrzemowego(IV), który zbudowany jest z siedmiu atomów.
Zadanie 7. (1 pkt)
Stapianie tlenku krzemu(IV) z wodorotlenkiem sodu pozwala otrzymać różne krzemiany, w zależności od stosunku molowego substratów tej reakcji. Wskutek hydrolizy wodnego roztworu tetraoksokrzemianu(IV) sodu, czyli Na4SiO4, tworzy się roztwór silnie alkaliczny. Taki roztwór obok cząsteczek kwasu tetraoksokrzemowego(IV) zawiera wszystkie rodzaje wodoroanionów tego kwasu.
Narysuj elektronowy wzór kreskowy kwasu tetraoksokrzemowego(IV). Określ typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu krzemu w cząsteczce tego kwasu.
Elektronowy wzór kreskowy:
Typ hybrydyzacji:
Zadanie 8. (1 pkt)
Reakcja syntezy pewnego związku XY jest opisana równaniem:
X2(g) + Y2(g) ⇄ 2XY(g)
Stężeniowa stała równowagi tej przemiany w temperaturze T jest równa Kc = 4,0.
Spośród poniższych wykresów wybierz ten, który może przedstawiać zmianę stężenia substratu X2 i produktu XY w czasie, przy założeniu, że substraty reakcji zmieszano w stosunku stechiometrycznym. Zaznacz literę A, B, C albo D.
Zadanie 9. (2 pkt)
Reakcja syntezy pewnego związku XY jest opisana równaniem:
X2(g) + Y2(g) ⇄ 2XY(g)
Stężeniowa stała równowagi tej przemiany w temperaturze T jest równa Kc = 4,0.
Aby przewidzieć, czy w układzie – mieszaninie reakcyjnej substratów i produktu – został już osiągnięty stan równowagi, można obliczyć tzw. iloraz reakcji Q. Wyrażenie na iloraz reakcji jest takie samo jak wyrażenie na stałą równowagi, lecz stężenia w nim występujące dotyczą dowolnego stadium przemiany. Obliczoną wartość ilorazu reakcji Q porównuje się z wartością Kc. Jeżeli Q < Kc, to można założyć, że (w dążeniu do osiągnięcia stanu równowagi) reakcja zachodzi w kierunku tworzenia produktów, jeżeli Q > Kc – w kierunku tworzenia substratów.
W temperaturze T do reaktora o pojemności 1,0 dm3 wprowadzono po 1,5 mol substancji X2 i Y2 oraz 3,5 mol substancji XY.
Oblicz iloraz reakcji Q w momencie zmieszania reagentów w temperaturze T. Następnie uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w nawiasie.
W momencie zmieszania reagentów w temperaturze 𝑇 szybkość reakcji syntezy produktu XY jest (mniejsza niż / taka sama jak / większa niż) szybkość reakcji rozpadu produktu XY na substraty.
Zadanie 10. (2 pkt)
Reakcja syntezy pewnego związku XY jest opisana równaniem:
X2(g) + Y2(g) ⇄ 2XY(g)
Stężeniowa stała równowagi tej przemiany w temperaturze T jest równa Kc = 4,0.
W temperaturze 𝑇 do reaktora o pojemności 1,0 dm3 wprowadzono po 1,5 mol substancji X2 i Y2 oraz 3,5 mol substancji XY. Stężeniowa stała równowagi w temperaturze T jest równa Kc = 4,0.
Oblicz stężenie równowagowe substratów (X2 i Y2) opisanej przemiany w temperaturze T.
Zadanie 11. (1 pkt)
Do probówek oznaczonych numerami 1.–4. wprowadzono wodne roztwory czterech substancji chemicznych: wodorotlenku baru, manganianu(VII) potasu, fenolanu sodu i chlorku żelaza(III). Stężenie molowe każdego roztworu wynosiło 0,10 mol ∙ dm–3.
Wpisz do schematu wzory odpowiednich drobin, tak aby powstało równanie procesu decydującego o odczynie roztworu fenolanu sodu. Zastosuj definicję kwasu i zasady Brønsteda.
Zadanie 12. (1 pkt)
Do probówek oznaczonych numerami 1.–4. wprowadzono wodne roztwory czterech substancji chemicznych: wodorotlenku baru, manganianu(VII) potasu, fenolanu sodu i chlorku żelaza(III). Stężenie molowe każdego roztworu wynosiło 0,10 mol ∙ dm–3.
Uporządkuj roztwory znajdujące się w probówkach według wzrastającego pH. Uzupełnij poniższy schemat. Wpisz w wolne pola wzory substancji znajdujących się w roztworach.
Zadanie 13. (3 pkt)
Do probówek oznaczonych numerami 1.–4. wprowadzono wodne roztwory czterech substancji chemicznych: wodorotlenku baru, manganianu(VII) potasu, fenolanu sodu i chlorku żelaza(III). Stężenie molowe każdego roztworu wynosiło 0,10 mol ∙ dm–3.
Roztwory z probówek 1.–4. posłużyły do przeprowadzenia doświadczenia. Do jednej z probówek wprowadzono tlenek węgla(IV), a do pozostałych dodano pojedynczo odczynniki: NaOH (aq), Na2SO3 (aq) oraz HCl (aq). Każdego z roztworów użyto jeden raz. Po wymieszaniu zawartości probówek w każdej z nich zaobserwowano zmętnienie lub wytrącenie osadu.
13.1. (0–1)
Ustal, do której probówki został wprowadzony tlenek węgla(IV), a do których – wodne roztwory: NaOH oraz HCl. Uzupełnij poniższe schematy.
13.2. (0–1)
Wpisz do tabeli wzory substancji, których powstanie w probówkach 1., 3. oraz 4. odpowiadało za opisany objaw reakcji.
| Probówka | 1. | 3. | 4. |
| Wzór substancji |
13.3. (0–1)
W probówce 2., po zmieszaniu reagentów, zachodzi proces utleniania-redukcji. Utleniacz i reduktor reagują ze sobą w stosunku molowym 2 : 3, a trzecim substratem reakcji jest woda.
Napisz w formie jonowej skróconej równanie tej reakcji.
Zadanie 14. (1 pkt)
Poniżej podano wartości stałych dysocjacji (𝑇 = 25 °C, 𝑝 = 1000 hPa) trzech substancji, które wykazują kwasowy charakter chemiczny w roztworach wodnych:
| Substancja (H2X) | 𝐾a1 | 𝐾a2 |
|---|---|---|
| benzeno-1,2-diol, C6H4(OH)2 | 4,57 ∙ 10−10 | 2,51 ∙ 10−13 |
| kwas butanodiowy, HOOC–(CH2)2–COOH | 6,16 ∙ 10−5 | 2,29 ∙ 10−6 |
| tlenek siarki(IV), SO2 (aq, nas.), [H2SO3] | 1,41 ∙ 10−2 | 6,31 ∙ 10−8 |
Próbkę wodnego roztworu każdej z substancji (analitu) o objętości 10,0 cm3 i stężeniu molowym 0,020 mol ∙ dm–3, umieszczano w kolbie i miareczkowano roztworem titranta: NaOH (aq) o stężeniu molowym 0,020 mol ∙ dm–3. Krzywe miareczkowania oznaczone literami A, B i C przedstawiono na wykresie.
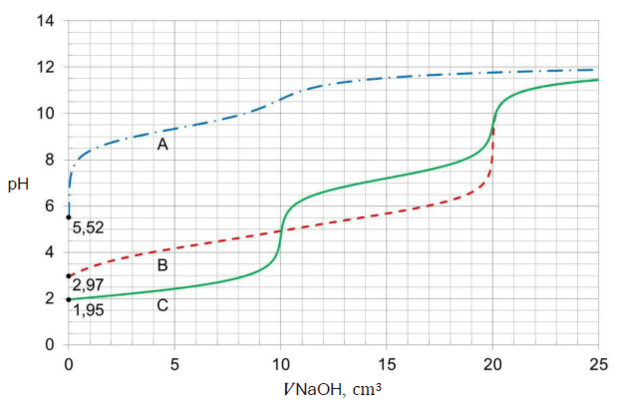
Punkt równoważnikowy (PR) to punkt na krzywej miareczkowania odpowiadający takiej ilości titranta, która jest równoważna stechiometrycznej ilości analitu. W pobliżu PR podczas miareczkowania zachodzą zwykle wyraźnie zmiany wartości pH, zwane skokiem miareczkowania.
Oceń, prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Krzywa C obrazuje zmiany pH podczas miareczkowania najmocniejszego kwasu, a krzywa A – zmiany pH podczas miareczkowania kwasu pośredniej mocy spośród wymienionych. | P | F |
| 2. | W przebiegu krzywej B jest widoczny jeden skok miareczkowania, a pH w punkcie równoważnikowym miareczkowania okazuje się większe od 7. | P | F |
Zadanie 15. (1 pkt)
Poniżej podano wartości stałych dysocjacji (𝑇 = 25 °C, 𝑝 = 1000 hPa) trzech substancji, które wykazują kwasowy charakter chemiczny w roztworach wodnych:
| Substancja (H2X) | 𝐾a1 | 𝐾a2 |
|---|---|---|
| benzeno-1,2-diol, C6H4(OH)2 | 4,57 ∙ 10−10 | 2,51 ∙ 10−13 |
| kwas butanodiowy, HOOC–(CH2)2–COOH | 6,16 ∙ 10−5 | 2,29 ∙ 10−6 |
| tlenek siarki(IV), SO2 (aq, nas.), [H2SO3] | 1,41 ∙ 10−2 | 6,31 ∙ 10−8 |
Próbkę wodnego roztworu każdej z substancji (analitu) o objętości 10,0 cm3 i stężeniu molowym 0,020 mol ∙ dm–3, umieszczano w kolbie i miareczkowano roztworem titranta: NaOH (aq) o stężeniu molowym 0,020 mol ∙ dm–3. Krzywe miareczkowania oznaczone literami A, B i C przedstawiono na wykresie.

Punkt równoważnikowy (PR) to punkt na krzywej miareczkowania odpowiadający takiej ilości titranta, która jest równoważna stechiometrycznej ilości analitu. W pobliżu PR podczas miareczkowania zachodzą zwykle wyraźnie zmiany wartości pH, zwane skokiem miareczkowania.
W wodnych roztworach kwasów diprotonowych (H2X) oraz podczas miareczkowania ich roztworów za pomocą NaOH (aq) zachodzi wiele procesów, np.:
| Proces | Równanie |
|---|---|
| I | H2X + H2O ⇄ HX– + H3O+ |
| II | HX– + H2O ⇄ X2– + H3O+ |
| III | HX– + H2O ⇄ H2X + OH– |
| IV | X2– + H2O ⇄ HX– + OH– |
Na podstawie krzywej miareczkowania oznaczonej literą C wskaż, który z procesów I–IV decyduje o pH roztworu obecnego w kolbie, w różnych momentach miareczkowania. Uzupełnij poniższą tabelę. Wpisz numer procesu lub numery procesów.
| Proces decydujący o pH układu: | |
|---|---|
| przed wprowadzeniem NaOH | |
| po wprowadzeniu 10 cm3 roztworu NaOH | |
| po wprowadzeniu 20 cm3 roztworu NaOH |
Zadanie 16. (2 pkt)
W celu określenia zawartości tlenku kobaltu(II) w mieszaninie zawierającej tylko CoO i Co3O4 próbkę tej mieszaniny o masie 100 g poddano prażeniu. Podczas tego procesu zaszły reakcje chemiczne:
2CoO + C T 2Co + CO2
Co3O4 + 2C T 3Co + 2CO2
W wyniku zachodzących reakcji otrzymano 75,0 g metalicznego kobaltu.
Oblicz w procentach masowych zawartość tlenku kobaltu(II) w wyjściowej mieszaninie. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100%.
Zadanie 17. (2 pkt)
W 150 g wody o temperaturze 80 °C rozpuszczono 160 g bezwodnego tiosiarczanu sodu (Na2S2O3). Otrzymany roztwór ochłodzono do temperatury 20 °C.
Oblicz, ile gramów Na2S2O3 ∙ 5H2O wykrystalizuje po ochłodzeniu roztworu. W temperaturze 20 °C rozpuszczalność hydratu wynosi 176 g w 100 g wody.
Zadanie 18. (3 pkt)
Rozpuszczalność soli X w wodzie wzrasta ze wzrostem temperatury, co pokazują dane zamieszczone w poniższej tabeli.
| Temperatura, °C | 0 | 20 | 40 | 60 | 80 | 100 |
| Rozpuszczalność, g w 100 g wody | 5 | 12 | 26 | 47 | 71 | 96 |
18.1. (0–1)
Narysuj krzywą rozpuszczalności soli X w zakresie temperatury 0 °C– 100 °C i odczytaj z niego wartość rozpuszczalności w temperaturze 70 °C. Rozpuszczalność soli X jest funkcją rosnącą w całym podanym zakresie temperatury.
Rozpuszczalność soli X w temperaturze 70 °C: g w 100 g wody.
18.2. (0–2)
Oblicz, ile gramów soli X wykrystalizowało, gdy z 300 g roztworu nasyconego w temperaturze 80 °C odparowała woda o masie 25 g. Wynik podaj w zaokrągleniu do jedności.
Zadanie 19. (1 pkt)
Bezbarwny wodny roztwór dwóch soli może zawierać znaczące ilości następujących jonów:
W celu ustalenia składu badanego roztworu pobrano cztery jego próbki i wykonano doświadczenia zilustrowane na poniższym schemacie:
Wszystkie wyniki doświadczenia przedstawiono w tabeli.
| Probówka | Wyniki doświadczenia |
|---|---|
| 1. | Wydziela się gaz o charakterystycznym zapachu. |
| 2. | Brak zmian. |
| 3. | Wytrąca się biały osad. |
| 4. | Mieszanina w probówce zmieniła zabarwienie. |
Napisz wzory sumaryczne dwóch soli, z których przygotowano badany roztwór.
Zadanie 20. (2 pkt)
Bezbarwny wodny roztwór dwóch soli może zawierać znaczące ilości następujących jonów:
W celu ustalenia składu badanego roztworu pobrano cztery jego próbki i wykonano doświadczenia zilustrowane na poniższym schemacie:
Wszystkie wyniki doświadczenia przedstawiono w tabeli.
| Probówka | Wyniki doświadczenia |
|---|---|
| 1. | Wydziela się gaz o charakterystycznym zapachu. |
| 2. | Brak zmian. |
| 3. | Wytrąca się biały osad. |
| 4. | Mieszanina w probówce zmieniła zabarwienie. |
Napisz w formie jonowej skróconej równania reakcji zachodzących podczas doświadczenia w probówkach 1. i 4.
Równanie reakcji zachodzącej w probówce 1.:
Równanie reakcji zachodzącej w probówce 4.:
Zadanie 21. (2 pkt)
Zmieszano 500 cm3 wodnego roztworu wodorotlenku sodu o nieznanym stężeniu 𝑐 (roztwór A) i 250 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 0,10 mol ∙ dm−3 (roztwór B). W temperaturze 25 °C pH otrzymanego roztworu C wynosiło 12,7.
Oblicz stężenie molowe c roztworu A wodorotlenku sodu. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów. Wynik podaj z odpowiednią jednostką.
Zadanie 22. (3 pkt)
Uczniowie przeprowadzili dwuetapowe doświadczenie, w którym w temperaturze pokojowej otrzymali z metalicznego glinu wodorotlenek glinu.
22.1. (0–1)
Wybierz i zaznacz na poniższym schemacie wzory odczynników, których użyto podczas doświadczenia przeprowadzonego przez uczniów.
22.2. (0–2)
Zapisz w formie jonowej skróconej:
- równanie reakcji zachodzącej w etapie I
- równanie reakcji zachodzącej w etapie II
opisanego doświadczenia, a następnie napisz, jakie zmiany zaobserwowano po dodaniu – w etapie II – nadmiaru wybranego odczynnika.
Równania reakcji:
Etap I:
Etap II:
Zaobserwowane zmiany:
Zadanie 23. (2 pkt)
Pewien związek o wzorze sumarycznym C5H11Cl jest drugorzędową chloropochodną węglowodoru łańcuchowego. Cząsteczki tego związku są chiralne i w każdej z nich występuje trzeciorzędowy atom węgla.
23.1. (0–1)
Uzupełnij poniższy schemat, tak aby przedstawiał budowę obu enancjomerów opisanej chloropochodnej.
23.2. (0–1)
Związek opisany w informacji poddano w odpowiednich warunkach reakcji eliminacji chlorowodoru. W reakcji eliminacji halogenowodorów (HX) z halogenków alkilowych jako organiczny produkt główny powstaje alken, którego cząsteczka zawiera maksymalną liczbę grup alkilowych przy atomach węgla połączonych podwójnym wiązaniem.
Napisz wzór półstrukturalny (grupowy) organicznego produktu głównego opisanej reakcji eliminacji.
Zadanie 24. (2 pkt)
W reakcjach substytucji na świetle względna reaktywność atomów wodoru połączonych z atomami węgla o różnej rzędowości wskazuje, że najłatwiej ulega podstawieniu atom wodoru związany z atomem węgla o najwyższej rzędowości. Ilości poszczególnych produktów zależą od liczby atomów wodoru o określonej rzędowości oraz od ich reaktywności i są zwykle podawane w przeliczeniu na jeden atom wodoru jako tzw. współczynnik reaktywności. Względna ilość produktu reakcji substytucji jest iloczynem liczby atomów wodoru o określonej rzędowości i ich współczynnika reaktywności.
Dla reakcji monochlorowania w temperaturze pokojowej współczynniki reaktywności atomów wodoru wynoszą odpowiednio:
| Atom wodoru związany z atomem węgla | |||
|---|---|---|---|
| trzeciorzędowym | drugorzędowym | pierwszorzędowym | |
| współczynnik reaktywności | 5,0 | 3,8 | 1,0 |
W wyniku reakcji monochlorowania na świetle jednego z alkanów o wzorze sumarycznym C4H10 otrzymano dwie izomeryczne monochloropochodne: 64% izomeru A i 36% izomeru B.
Na podstawie obliczeń ustal, który alkan poddano reakcji monochlorowania na świetle, a następnie napisz jego nazwę systematyczną.
Nazwa systematyczna alkanu:
Zadanie 25. (2 pkt)
W reakcjach substytucji na świetle względna reaktywność atomów wodoru połączonych z atomami węgla o różnej rzędowości wskazuje, że najłatwiej ulega podstawieniu atom wodoru związany z atomem węgla o najwyższej rzędowości. Ilości poszczególnych produktów zależą od liczby atomów wodoru o określonej rzędowości oraz od ich reaktywności i są zwykle podawane w przeliczeniu na jeden atom wodoru jako tzw. współczynnik reaktywności. Względna ilość produktu reakcji substytucji jest iloczynem liczby atomów wodoru o określonej rzędowości i ich współczynnika reaktywności.
Podobny szereg reaktywności 3° > 2° > 1° dla monobromowania alkanów wyraża się stosunkiem znacznie większych liczb. Dla reakcji monobromowania w temperaturze 127 °C współczynniki reaktywności atomów wodoru wynoszą odpowiednio:
| Atom wodoru związany z atomem węgla | |||
|---|---|---|---|
| trzeciorzędowym | drugorzędowym | pierwszorzędowym | |
| współczynnik reaktywności | 1600 | 82 | 1,0 |
25.1. (0–1)
Napisz:
- liczbę różnych monobromopochodnych będących izomerami konstytucyjnymi, które można otrzymać w reakcji monobromowania 2-metylopentanu na świetle
- nazwę systematyczną tej monobromopochodnej, która powstaje z największą wydajnością.
Liczba monobromopochodnych:
Nazwa systematyczna:
25.2. (0–1)
Wyjaśnij, dlaczego główny produkt reakcji monobromowania 2,3-dimetylobutanu w temperaturze 127 °C jest praktycznie jedynym produktem tej reakcji.
Zadanie 26. (1 pkt)
W wyniku działania na węglowodór o wzorze sumarycznym C8H10 stężonym kwasem azotowym(V) w obecności kwasu siarkowego(VI) można otrzymać trzy produkty mononitrowania, przy czym jeden powstaje z małą wydajnością. Ten węglowodór reaguje również z bromem w obecności światła i w reakcji monobromowania jeden związek powstaje w przewadze.
Napisz wzór półstrukturalny (grupowy) albo uproszczony organicznego produktu, który powstaje w przewadze podczas reakcji opisanego węglowodoru z bromem na świetle.
Zadanie 27. (4 pkt)
Na schemacie przedstawiono dwie reakcje, oznaczone numerami 1. i 2. Organicznym produktem obu przemian jest związek A, a organicznymi substratami – związki D i E o wzorach sumarycznych podanych na schemacie. O związku D dodatkowo wiadomo, że występuje w postaci izomerów cis-trans.
27.1. (0–2)
Napisz w formie cząsteczkowej równania reakcji 1. i 2. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Równanie reakcji 1.:
Równanie reakcji 2.:
27.2. (0–2)
Uzupełnij zdania, tak aby poprawnie opisywały przebieg reakcji 1. i 2. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Reakcja 1. jest reakcją (substytucji / addycji / eliminacji), która zachodzi zgodnie z mechanizmem (elektrofilowym / rodnikowym / nukleofilowym). Katalizują ją jony (H+ / OH−).
Reakcja 2. jest reakcją (substytucji / addycji / eliminacji), która zachodzi zgodnie z mechanizmem (elektrofilowym / rodnikowym / nukleofilowym).
Zadanie 28. (3 pkt)
Przemiany, w których ta sama substancja pełni funkcję utleniacza i reduktora, noszą nazwę reakcji dysproporcjonowania. Przykładem takiej reakcji jest przemiana charakterystyczna dla niektórych aldehydów, np. metanalu. Pod wpływem wodnego roztworu wodorotlenku sodu metanal przekształca się w alkohol i w sól kwasu karboksylowego.
28.1. (0–1)
Napisz w formie jonowej skróconej równanie opisanej reakcji dysproporcjonowania metanalu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
28.2. (0–1)
Uzupełnij tabelę. Wpisz formalne stopnie utlenienia atomów węgla w substracie i produktach reakcji dysproporcjonowania metanalu.
| Formalny stopień utlenienia atomu węgla | ||
|---|---|---|
| w substracie | w produktach | |
| w alkoholu | w soli | |
28.3. (0–1)
Rozstrzygnij, czy tlenek węgla(IV) może ulegać dysproporcjonowaniu. Uzasadnij odpowiedź.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 29. (1 pkt)
Przeciwutleniacze i konserwanty to ważne dodatki do żywności. Przeciwutleniacze zawierają w swoich cząsteczkach takie elementy budowy, które mogą ulegać utlenianiu, dzięki czemu zapobiegają utlenianiu innych substancji. Z kolei działanie konserwantów polega na dezaktywacji enzymów oraz na zahamowaniu rozwoju drobnoustrojów. Jako konserwantów można używać kwasu sorbowego oraz jego soli, sorbinianów: sodu, potasu, wapnia. Wzór kwasu sorbowego podano poniżej:
W poniższej tabeli zebrano kilka ważniejszych właściwości fizykochemicznych dla kwasu sorbowego i sorbinaniu potasu.
| Właściwość | Kwas sorbowy | Sorbinian potasu |
|---|---|---|
| barwa i stan skupienia | białe ciało stałe | białe ciało stałe |
| temperatura topnienia, °C | 134,5 | 270 (rozkład) |
| temperatura wrzenia, °C | 228 (rozkład) | ⸺ |
| rozpuszczalność w wodzie, g/100 g; 25°C | ok. 0,17 | ok. 58,5 |
Wartość 𝐾a dla kwasu sorbowego wynosi 1,7 ∙ 10–5.
oraz W. Grajek (red.), Przeciwutleniacze w żywności, Warszawa 2007.
Rozstrzygnij, czy kwas sorbowy może pełnić funkcję przeciwutleniacza. W uzasadnieniu odwołaj się do elementów budowy cząsteczki kwasu.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 30. (2 pkt)
Przeciwutleniacze i konserwanty to ważne dodatki do żywności. Przeciwutleniacze zawierają w swoich cząsteczkach takie elementy budowy, które mogą ulegać utlenianiu, dzięki czemu zapobiegają utlenianiu innych substancji. Z kolei działanie konserwantów polega na dezaktywacji enzymów oraz na zahamowaniu rozwoju drobnoustrojów. Jako konserwantów można używać kwasu sorbowego oraz jego soli, sorbinianów: sodu, potasu, wapnia. Wzór kwasu sorbowego podano poniżej:
W poniższej tabeli zebrano kilka ważniejszych właściwości fizykochemicznych dla kwasu sorbowego i sorbinaniu potasu.
| Właściwość | Kwas sorbowy | Sorbinian potasu |
|---|---|---|
| barwa i stan skupienia | białe ciało stałe | białe ciało stałe |
| temperatura topnienia, °C | 134,5 | 270 (rozkład) |
| temperatura wrzenia, °C | 228 (rozkład) | ⸺ |
| rozpuszczalność w wodzie, g/100 g; 25°C | ok. 0,17 | ok. 58,5 |
Wartość 𝐾a dla kwasu sorbowego wynosi 1,7 ∙ 10–5.
oraz W. Grajek (red.), Przeciwutleniacze w żywności, Warszawa 2007.
Kwas sorbowy jest najczęściej stosowany do konserwacji margaryn i innych tłuszczów, rzadziej – do konserwacji win, cydrów i napojów, które konserwuje się sorbinianami.
Wskaż cechy budowy i właściwości fizykochemiczne kwasu sorbowego oraz jego soli, które powodują, że te substancje służą jako konserwanty odpowiednich produktów żywnościowych. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
- Do konserwacji margaryn i innych tłuszczów wybierany jest częściej kwas sorbowy, ponieważ jego cząsteczki zawierają fragmenty (polarne / niepolarne).
- Do konserwacji win, cydrów i napojów używa się sorbinianów zamiast kwasu sorbowego, ponieważ ze względu na budowę jonową te sole wykazują (większą / mniejszą) od kwasu sorbowego rozpuszczalność w wodzie.
Zadanie 31. (1 pkt)
Przeciwutleniacze i konserwanty to ważne dodatki do żywności. Przeciwutleniacze zawierają w swoich cząsteczkach takie elementy budowy, które mogą ulegać utlenianiu, dzięki czemu zapobiegają utlenianiu innych substancji. Z kolei działanie konserwantów polega na dezaktywacji enzymów oraz na zahamowaniu rozwoju drobnoustrojów. Jako konserwantów można używać kwasu sorbowego oraz jego soli, sorbinianów: sodu, potasu, wapnia. Wzór kwasu sorbowego podano poniżej:
W poniższej tabeli zebrano kilka ważniejszych właściwości fizykochemicznych dla kwasu sorbowego i sorbinaniu potasu.
| Właściwość | Kwas sorbowy | Sorbinian potasu |
|---|---|---|
| barwa i stan skupienia | białe ciało stałe | białe ciało stałe |
| temperatura topnienia, °C | 134,5 | 270 (rozkład) |
| temperatura wrzenia, °C | 228 (rozkład) | ⸺ |
| rozpuszczalność w wodzie, g/100 g; 25°C | ok. 0,17 | ok. 58,5 |
Wartość 𝐾a dla kwasu sorbowego wynosi 1,7 ∙ 10–5.
oraz W. Grajek (red.), Przeciwutleniacze w żywności, Warszawa 2007.
Wybierz i zaznacz nazwę odczynnika, który wprowadzony w postaci roztworu pozwoli odróżnić wodny roztwór kwasu sorbowego i wodny roztwór sorbinianu potasu o jednakowych stężeniach. Odpowiedź uzasadnij.
brom fenoloftaleina
Uzasadnienie:
Zadanie 32. (2 pkt)
Estry można otrzymać w reakcji alifatycznych chlorowcopochodnych z solami kwasów karboksylowych. Poniżej przedstawiono mechanizm reakcji – zachodzącej w obecności jodków – między pierwszorzędowym halogenkiem alkilowym a anionem karboksylanowym:
32.1. (0–1)
Napisz sumaryczne równanie reakcji anionu octanowego z 1-chlorobutanem. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
32.2. (0–1)
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Opisane przemiany, w których udział biorą alifatyczne chlorowcopochodne i sole kwasów karboksylowych, są reakcjami (addycji / substytucji). Anion jodkowy pełni funkcję katalizatora i jego obecność skutkuje (obniżeniem / podwyższeniem) energii aktywacji oraz wzrostem (szybkości / wydajności) reakcji w porównaniu do reakcji prowadzonej bez jego udziału.
Zadanie 33. (1 pkt)
Kwas pantotenowy wchodzi w skład witaminy B5. Jego wzór chemiczny przedstawiono poniżej:
Kwas pantotenowy może ulegać hydrolizie zasadowej.
Uzupełnij poniższy schemat, tak aby przedstawiał w formie jonowej skróconej równanie hydrolizy zasadowej kwasu pantotenowego. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Zadanie 34. (1 pkt)
Kwas pantotenowy wchodzi w skład witaminy B5. Jego wzór chemiczny przedstawiono poniżej:
Kwas pantotenowy może ulegać hydrolizie zasadowej.
Rozstrzygnij, czy cząsteczka kwasu pantotenowego jest chiralna. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 35. (2 pkt)
Nomex to polimer stosowany do produkcji materiałów o wysokiej odporności mechanicznej i termicznej. Fragment jego łańcucha przedstawiono poniżej:
35.1. (0–1)
Monomery, z których można otrzymać nomex, różnią się charakterem kwasowo-zasadowym.
Uzupełnij tabelę. Narysuj wzory półstrukturalne (grupowe) lub uproszczone dwóch monomerów, z których można otrzymać ten polimer.
| Wzór monomeru o charakterze zasadowym | Wzór monomeru o charakterze kwasowym |
|---|---|
35.2. (0–1)
Uzupełnij zdania. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie.
Nomex otrzymuje się w wyniku polimeryzacji (łańcuchowej / kondensacyjnej). W tej przemianie (wydziela się / nie wydziela się) produkt uboczny.
