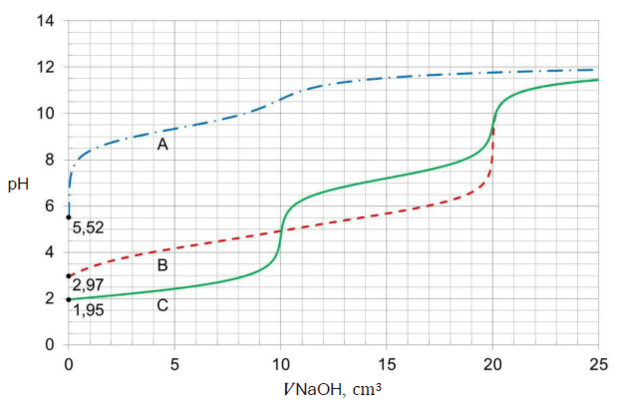
Matura Maj 2023, Poziom rozszerzony (Formuła 2023) - Zadanie 15. (2 pkt)
Chlorek wapnia tworzy rozpuszczalne hydraty o wzorze ogólnym CaCl2 ∙ 𝑛H2O. W zależności od temperatury w równowadze z roztworem nasyconym pozostają hydraty o różnych wartościach współczynnika 𝑛.
W temperaturze 40 °C jeden z hydratów chlorku wapnia rozpuszcza się w ilości 767,4 g na 100 g wody, a stężenie nasyconego roztworu chlorku wapnia wynosi 53,66% masowych.
Wykonaj obliczenia i napisz wzór opisanego hydratu chlorku wapnia.
Wzór hydratu: