Matura Maj 2020, Poziom rozszerzony (Formuła 2007) - Zadanie 5. (1 pkt)
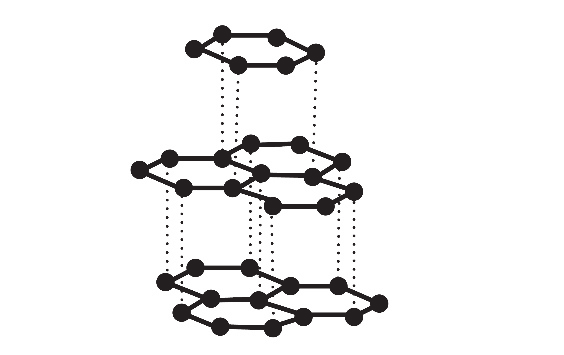
Atomy węgla w krysztale grafitu układają się w płaskie, równoległe warstwy. Każdy atom węgla w warstwie jest połączony z trzema sąsiednimi atomami węgla, w wyniku czego tworzy się płaska struktura przypominająca plaster miodu. Odległość między dwoma sąsiednimi atomami węgla w warstwie jest równa 0,142 nm, a więc tyle, ile wynosi długość wiązania węgiel – węgiel w pierścieniu aromatycznym, natomiast odległość między sąsiednimi warstwami grafitu jest równa 0,335 nm. Fragment struktury krystalicznej grafitu przedstawiono na poniższym rysunku.
oraz K.M. Pazdro, Podstawy chemii dla kandydatów na wyższe uczelnie, Warszawa 1993.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeżeli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1. | Orbitalom walencyjnym atomów węgla w krysztale grafitu przypisuje się hybrydyzację typu sp3. | P | F |
| 2. | W krysztale grafitu oddziaływania między warstwami są oddziaływaniami międzycząsteczkowymi – słabszymi od wiązań kowalencyjnych. | P | F |
| 3. | Grafit przewodzi prąd elektryczny, ponieważ w obrębie danej warstwy istnieją zdelokalizowane wiązania π, których elektrony mogą przemieszczać się w polu elektrycznym. | P | F |
