Chemia - Matura Maj 2020, Poziom rozszerzony (Formuła 2007)
Zadanie 1. (4 pkt)
O dwóch pierwiastkach umownie oznaczonych literami X i Z wiadomo, że:
- oba przyjmują w związkach chemicznych taki sam maksymalny stopień utlenienia
- konfiguracja elektronowa atomu pierwiastka X w stanie wzbudzonym, w którym nastąpiło przeniesienie jednego z elektronów sparowanych na wyższą energetycznie i nieobsadzoną podpowłokę, może zostać przedstawiona w postaci zapisu:
- w stanie podstawowym atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d pięć elektronów.
1.1. (2 pkt)
Wpisz do tabeli symbol pierwiastka X i symbol pierwiastka Z, numer grupy oraz symbol bloku konfiguracyjnego, do których należy każdy z pierwiastków.
| Symbol pierwiastka | Numer grupy | Symbol bloku konfiguracyjnego | |
|---|---|---|---|
| pierwiastek X | |||
| pierwiastek Z |
1.2. (1 pkt)
Napisz wzór sumaryczny wodorku pierwiastka X oraz maksymalny stopień utlenienia, jaki przyjmują pierwiastki X i Z w związkach chemicznych.
Wzór sumaryczny wodorku pierwiastka X:
Maksymalny stopień utlenienia, jaki przyjmują pierwiastki X i Z w związkach chemicznych:
1.3. (1 pkt)
Przedstaw pełną konfigurację elektronową jonu Z2+ w stanie podstawowym. Zastosuj zapis z uwzględnieniem podpowłok.
Zadanie 2. (1 pkt)
Wpisz do tabeli temperaturę wrzenia wymienionych substancji (H2, CaCl2, HCl) pod ciśnieniem atmosferycznym. Wartości temperatury wrzenia wybierz spośród następujących: –253ºC, –85ºC, 100ºC, 1935ºC.
| Substancja | wodór, H2 |
chlorek wapnia, CaCl2 |
chlorowodór, HCl |
| Temperatura wrzenia, °C |
Zadanie 3. (2 pkt)
Najtrwalszym izotopem neptunu jest izotop o liczbie masowej równej 237 i okresie półtrwania τ = 2,2⋅106 lat. Otrzymuje się go przez napromieniowanie izotopu uranu o liczbie masowej 238 neutronami o dużej energii kinetycznej. Ta przemiana zachodzi zgodnie z poniższym schematem.
23892U + 10n → 23792U + a10n
W jej wyniku powstaje nietrwały izotop uranu o liczbie masowej A = 237. Jądro 23792U ulega rozpadowi – powstaje jądro 23793Np.
3.1. (1 pkt)
Uzupełnij poniższe zdania, tak aby powstała informacja prawdziwa: wybierz i podkreśl wartość współczynnika a (liczbę neutronów) w równaniu przemiany izotopu uranu o liczbie masowej 238 oraz typ przemiany, której ulega izotop uranu o liczbie masowej 237.
Współczynnik a w równaniu przemiany izotopu uranu o liczbie masowej 238 jest równy (1 / 2 / 3). Izotop uranu o liczbie masowej 237 ulega przemianie (α / β− / γ).
3.2. (1 pkt)
Oblicz, po ilu latach z próbki izotopu neptunu 23793Np o masie równej m pozostanie próbka zawierająca 0,25m tego izotopu.
Zadanie 4. (1 pkt)
Uzupełnij tabelę – wpisz wartości liczb kwantowych: głównej n, pobocznej (orbitalnej) l oraz magnetycznej m, opisujących stan niesparowanego elektronu w atomie potasu w stanie podstawowym.
| Wartości liczby kwantowej | ||
|---|---|---|
| głównej n | pobocznej l | magnetycznej m |
Zadanie 5. (1 pkt)
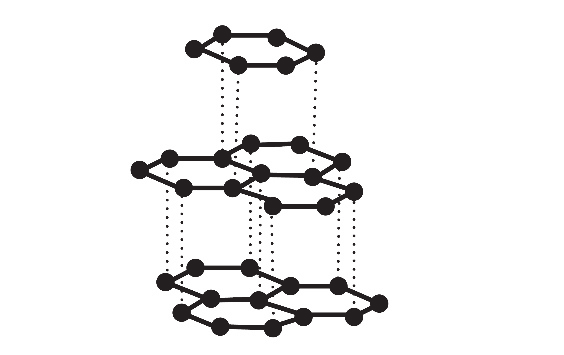
Atomy węgla w krysztale grafitu układają się w płaskie, równoległe warstwy. Każdy atom węgla w warstwie jest połączony z trzema sąsiednimi atomami węgla, w wyniku czego tworzy się płaska struktura przypominająca plaster miodu. Odległość między dwoma sąsiednimi atomami węgla w warstwie jest równa 0,142 nm, a więc tyle, ile wynosi długość wiązania węgiel – węgiel w pierścieniu aromatycznym, natomiast odległość między sąsiednimi warstwami grafitu jest równa 0,335 nm. Fragment struktury krystalicznej grafitu przedstawiono na poniższym rysunku.
oraz K.M. Pazdro, Podstawy chemii dla kandydatów na wyższe uczelnie, Warszawa 1993.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeżeli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1. | Orbitalom walencyjnym atomów węgla w krysztale grafitu przypisuje się hybrydyzację typu sp3. | P | F |
| 2. | W krysztale grafitu oddziaływania między warstwami są oddziaływaniami międzycząsteczkowymi – słabszymi od wiązań kowalencyjnych. | P | F |
| 3. | Grafit przewodzi prąd elektryczny, ponieważ w obrębie danej warstwy istnieją zdelokalizowane wiązania π, których elektrony mogą przemieszczać się w polu elektrycznym. | P | F |
Zadanie 6. (1 pkt)
Uzupełnij tabelę – wpisz liczbę wiązań σ, wiązań π oraz wolnych par elektronowych w cząsteczce cyjanowodoru o wzorze HCN.
| Liczba | ||
|---|---|---|
| wiązań σ | wiązań π | wolnych par elektronowych |
Zadanie 7. (2 pkt)
Synteza jodowodoru przebiega zgodnie z równaniem:
H2 (g) + I2 (g) ⇄ 2HI(g)
Równanie kinetyczne tej syntezy jest następujące: ν = k ⋅ cH2 ⋅ cI2 , gdzie cH2 i cI2 oznaczają stężenie substratów. W temperaturze 400ºC stała szybkości tej reakcji k=2,42⋅10−2 mol−1 ⋅ dm3 ⋅ s−1.
W temperaturze 400ºC do reaktora o stałej pojemności równej 2 dm3 wprowadzono mieszaninę dwóch moli gazowego wodoru i jednego mola gazowego jodu. Po zamknięciu reaktora zainicjowano reakcję, przy czym utrzymywano stałą temperaturę 400ºC.
Oblicz szybkość syntezy jodowodoru w momencie, gdy reakcji uległa połowa początkowej ilości jodu.
Zadanie 8. (1 pkt)
W środowisku alkalicznym jod utlenia ilościowo metanal do kwasu metanowego. Czynnikiem utleniającym jest anion jodanowy(I), który powstaje w reakcji jodu cząsteczkowego z anionami hydroksylowymi. Przebieg opisanych przemian można zilustrować następującymi równaniami:
reakcja 2.
HCHO + IO− + OH− →HCOO− + I− + H2O
Napisz w formie jonowej skróconej sumaryczne równanie opisanego utleniania metanalu jodem w środowisku alkalicznym i określ stosunek masowy, w jakim metanal reaguje z jodem.
Równanie reakcji:
Stosunek masowy metanalu i jodu mHCHO : mI2 =
Zadanie 9. (2 pkt)
Reakcja tlenku siarki(IV) z tlenem przebiega zgodnie z równaniem:
Reakcję prowadzi się w temperaturze 650 K–850 K w obecności katalizatora. W tej temperaturze wszystkie reagenty są gazami.
Uzupełnij poniższe zdania – wybierz i podkreśl jedną odpowiedź spośród podanych w nawiasie.
- W warunkach izotermicznych wydajność reakcji tlenku siarki(IV) z tlenem (nie zależy / zależy) od ciśnienia panującego w reaktorze.
- W warunkach izobarycznych podwyższenie temperatury, w której prowadzona jest reakcja tlenku siarki(IV) z tlenem, poskutkuje (spadkiem / wzrostem) wydajności reakcji tworzenia tlenku siarki(VI).
- W warunkach izobarycznych podwyższenie temperatury, w której prowadzona jest reakcja tlenku siarki(IV) z tlenem, poskutkuje (spadkiem / wzrostem) szybkości reakcji tworzenia tlenku siarki(VI).
Zadanie 10. (2 pkt)
W temperaturze 1000 K przeprowadzono reakcję opisaną równaniem:
CO(g) + H2O(g) ⇄ CO2 (g) + H2 (g)
Mieszaninę zawierającą 2,00 mole tlenku węgla(II) i 8,00 moli pary wodnej umieszczono w reaktorze o stałej pojemności równej 1 dm3 i zainicjowano reakcję, przy czym utrzymywano temperaturę 1000 K. Po ustaleniu się równowagi stwierdzono, że powstało 1,68 mola tlenku węgla(IV).
Oblicz stężeniową stałą równowagi opisanej reakcji w temperaturze 1000 K.
Zadanie 11. (1 pkt)
Siarczan(VI) wapnia–woda (2/1) jest stosowany w zaprawie budowlanej, ponieważ ma zdolność wiązania wody. W wyniku tego procesu powstaje siarczan(VI) wapnia–woda (1/2).
Uzupełnij poniższy schemat, tak aby otrzymać równanie opisanej reakcji, oraz wybierz spośród podanych i podkreśl nazwę procesu, którego podstawą jest ta reakcja.
Równanie reakcji:
(CaSO4)2 ⋅ H2O + H2O → (CaSO4 ⋅ 2H2O)
Nazwa procesu:
Zadanie 12. (2 pkt)
Siarczan(VI) wapnia jest substancją trudno rozpuszczalną w wodzie. Nasycony wodny roztwór siarczanu(VI) wapnia, nazywany wodą gipsową, stosuje się do przeprowadzania różnych prób w analizie chemicznej. Wykonano doświadczenie, którego przebieg zilustrowano na poniższym rysunku.
Po dodaniu roztworu siarczanu(VI) wapnia w dwóch probówkach zaobserwowano wytrącenie białego osadu.
Napisz w formie jonowej skróconej równania reakcji, które zaszły po dodaniu wody gipsowej do probówek I–III, albo zaznacz, że reakcja nie zaszła.
Probówka I:
Probówka II:
Probówka III:
Zadanie 13. (2 pkt)
Węglan sodu jest solą dość dobrze rozpuszczalną w wodzie. Podczas ochładzania jej gorącego roztworu nie powstaje sól bezwodna, ale wydzielają się hydraty, których skład zależy od temperatury. W temperaturze 20ºC w równowadze z roztworem nasyconym pozostaje dekahydrat o wzorze Na2CO3∙10H2O. Rozpuszczalność dekahydratu węglanu sodu w wodzie w tej temperaturze jest równa 21,5 g w 100 g wody.
Oblicz rozpuszczalność węglanu sodu (wyrażoną w gramach substancji na 100 gramów wody) w opisanych warunkach w przeliczeniu na sól bezwodną.
Odpowiedź: Rozpuszczalność = g soli bezwodnej w 100 g wody.
Zadanie 14. (1 pkt)
W przemyśle duże ilości wody są zużywane w celu chłodzenia aparatury. W wyniku użycia wody twardej w podwyższonej temperaturze powstają trudno rozpuszczalne osady tworzące kamień kotłowy, np.:
Ca2+ + 2HCO−3 → CaCO3 + CO2 + H2O
Mg2+ + 2HCO−3 → Mg(OH)2 + 2CO2
Aby zapobiec powstawaniu kamienia kotłowego w instalacjach przemysłowych, niekiedy stosuje się tzw. szczepienie kwasem, czyli rozkład rozpuszczonych w wodzie wodorowęglanów wapnia i magnezu mocnymi kwasami, np. kwasem siarkowym(VI).
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeżeli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1. | Składnikami kamienia kotłowego są m.in. węglan wapnia i wodorotlenek magnezu. | P | F |
| 2. | Po dodaniu kwasu siarkowego(VI) do wody zawierającej wodorowęglany zachodzi reakcja opisana równaniem: HCO−3 + H+ ⟶ CO2 + H2O |
P | F |
| 3. | Użycie kwasu siarkowego(VI) skutkuje całkowitym usunięciem obecnych w wodzie jonów Ca2+ i Mg2+. | P | F |
Zadanie 15. (1 pkt)
Większość kationów metali występuje w roztworze wodnym w postaci jonów kompleksowych, tzw. akwakompleksów, w których cząsteczki wody otaczają jon metalu, czyli są ligandami. Dodanie do takiego roztworu reagenta, który z kationami danego metalu tworzy trwalsze kompleksy niż woda, powoduje wymianę ligandów. Kompleksy mogą mieć różne barwy, zależnie od rodzaju ligandów, np. jon Fe3+ tworzy z jonami fluorkowymi F− kompleks bezbarwny, a z jonami tiocyjanianowymi (rodankowymi) SCN− – krwistoczerwony.
W dwóch probówkach znajdował się wodny roztwór chlorku żelaza(III). Do pierwszej probówki wsypano niewielką ilość stałego fluorku potasu, co poskutkowało odbarwieniem żółtego roztworu, a następnie do obu probówek dodano wodny roztwór rodanku potasu (KSCN). Stwierdzono, że tylko w probówce drugiej pojawiło się krwistoczerwone zabarwienie.
W badanych roztworach występowały jony kompleksowe żelaza(III):
Uszereguj wymienione jony kompleksowe zgodnie ze wzrostem ich trwałości. Napisz w odpowiedniej kolejności numery, którymi je oznaczono.
Zadanie 16. (3 pkt)
Srebro występuje w przyrodzie jako srebro rodzime, a także jako składnik minerałów, takich jak argentyt Ag2S czy chlorargiryt AgCl. Proces wydobywania srebra z urobku górniczego polega na przeprowadzeniu srebra w dobrze rozpuszczalny w wodzie kompleksowy związek cyjankowy, w którym srebro wchodzi w skład anionu o wzorze [Ag(CN)2]–. W tym celu rozdrobniony urobek górniczy poddaje się działaniu cyjanku sodu NaCN w obecności powietrza. Poniższe schematy są ilustracją reakcji zachodzących podczas opisanego procesu:
reakcja II:
reakcja III:
Ag2S + NaCN (aq) Na[Ag(CN)2]
AgCl + NaCN (aq) Na[Ag(CN)2]
Reakcja I jest reakcją utleniania i redukcji, która zachodzi zgodnie ze schematem:
Ag + CN− + H2O + O2 → [Ag(CN)2]− + OH−
16.1. (2 pkt)
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej reakcji. Uwzględnij środowisko obojętne, w którym reakcja przebiega.
Równanie procesu redukcji:
Równanie procesu utleniania:
16.2. (1 pkt)
Uzupełnij współczynniki stechiometryczne w poniższym schemacie opisanej reakcji. Ag + CN− + H2O + O2 → [Ag(CN)2]− OH−
Zadanie 17. (1 pkt)
Srebro występuje w przyrodzie jako srebro rodzime, a także jako składnik minerałów, takich jak argentyt Ag2S czy chlorargiryt AgCl. Proces wydobywania srebra z urobku górniczego polega na przeprowadzeniu srebra w dobrze rozpuszczalny w wodzie kompleksowy związek cyjankowy, w którym srebro wchodzi w skład anionu o wzorze [Ag(CN)2]–. W tym celu rozdrobniony urobek górniczy poddaje się działaniu cyjanku sodu NaCN w obecności powietrza. Poniższe schematy są ilustracją reakcji zachodzących podczas opisanego procesu:
reakcja II:
reakcja III:
Ag2S + NaCN (aq) Na[Ag(CN)2]
AgCl + NaCN (aq) Na[Ag(CN)2]
Rozstrzygnij, czy reakcje II i III są reakcjami utleniania i redukcji. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 18. (1 pkt)
Srebro występuje w przyrodzie jako srebro rodzime, a także jako składnik minerałów, takich jak argentyt Ag2S czy chlorargiryt AgCl. Proces wydobywania srebra z urobku górniczego polega na przeprowadzeniu srebra w dobrze rozpuszczalny w wodzie kompleksowy związek cyjankowy, w którym srebro wchodzi w skład anionu o wzorze [Ag(CN)2]–. W tym celu rozdrobniony urobek górniczy poddaje się działaniu cyjanku sodu NaCN w obecności powietrza. Poniższe schematy są ilustracją reakcji zachodzących podczas opisanego procesu:
reakcja II:
reakcja III:
Ag2S + NaCN (aq) Na[Ag(CN)2]
AgCl + NaCN (aq) Na[Ag(CN)2]
Z otrzymanego roztworu Na[Ag(CN)2] wydziela się srebro za pomocą metalicznego cynku. W tej reakcji tworzy się kompleks cyjankowy o wzorze Na2[Zn(CN)4].
Napisz w formie cząsteczkowej równanie opisanej reakcji.
Zadanie 19. (2 pkt)
Przeprowadzono elektrolizę wodnego roztworu siarczanu(VI) sodu. W wyniku reakcji opisanej równaniem:
2H2O prąd elektryczny 2H2 + O2
otrzymano 0,96 dm3 wodoru w temperaturze 20ºC i pod ciśnieniem 1013 hPa.
Oblicz, jaki ładunek elektryczny przepłynął przez wodny roztwór siarczanu(VI) sodu, wskutek czego powstało 0,96 dm3 wodoru. Przyjmij, że opisany proces przebiegł z wydajnością równą 100%. Stała Faradaya F = 96500 C ∙ mol–1, a uniwersalna stała gazowa R = 83,1 dm3 ∙ hPa ∙ mol–1 ∙ K–1. Wynik podaj w kulombach.
Zadanie 20. (1 pkt)
Przeprowadzono elektrolizę wodnego roztworu siarczanu(VI) sodu. W wyniku reakcji opisanej równaniem:
2H2O prąd elektryczny 2H2 + O2
otrzymano 0,96 dm3 wodoru w temperaturze 20ºC i pod ciśnieniem 1013 hPa.
Napisz równania reakcji elektrodowych zachodzących podczas elektrolizy wodnego roztworu siarczanu(VI) sodu.
Równanie reakcji katodowej:
Równanie reakcji anodowej:
Zadanie 21. (1 pkt)
Przeprowadzono doświadczenie z udziałem azotanu(III) potasu (KNO2). Przebieg doświadczenia zilustrowano na poniższym schemacie.
Objawy reakcji zaobserwowano w obu probówkach. Na dnie probówki I powstała substancja o fioletowobrunatnej barwie, charakterystycznej dla wolnego jodu, a fioletowy roztwór dodawany do probówki II uległ odbarwieniu.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
W probówce I jony azotanowe(III) (redukują / utleniają) jony jodkowe do wolnego jodu. Podczas reakcji zachodzącej w probówce II jon azotanowy(III) pełni funkcję (reduktora / utleniacza). W tej reakcji powstaje sól manganu na stopniu utlenienia (II / IV / VI).
Zadanie 22. (2 pkt)
Halogenopochodne alkanów, w cząsteczkach których dwa atomy halogenu znajdują się w pozycji 1 i 2, czyli 1,2-dihalogenki alkanów, można otrzymać w reakcji halogenu (bromu lub chloru) i odpowiedniego alkenu. Jeżeli 1,2-dihalogenek alkanu podda się – w środowisku bezwodnym – działaniu nadmiaru mocnej zasady, następuje dwukrotna eliminacja halogenowodoru, co prowadzi do utworzenia alkinu.
Napisz równania reakcji prowadzących do otrzymania pent-1-ynu z odpowiedniego alkenu opisaną powyżej metodą. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Otrzymywanie dibromopochodnej:
Otrzymywanie pent-1-ynu (z udziałem KOH):
Zadanie 23. (1 pkt)
Halogenopochodne alkanów, w cząsteczkach których dwa atomy halogenu znajdują się w pozycji 1 i 2, czyli 1,2-dihalogenki alkanów, można otrzymać w reakcji halogenu (bromu lub chloru) i odpowiedniego alkenu. Jeżeli 1,2-dihalogenek alkanu podda się – w środowisku bezwodnym – działaniu nadmiaru mocnej zasady, następuje dwukrotna eliminacja halogenowodoru, co prowadzi do utworzenia alkinu.
Określ typ (addycja, substytucja, eliminacja) i mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji otrzymywania 1,2-dibromopentanu opisaną metodą.
Zadanie 24. (2 pkt)
Pewien nienasycony alkohol monowodorotlenowy o wzorze ogólnym CnH2n–1OH jest pochodną alkenu o prostym (nierozgałęzionym) łańcuchu węglowym. Masa atomów węgla stanowi 62,07% masy cząsteczki tego alkoholu. W odróżnieniu od nietrwałych enoli, w których cząsteczkach grupa –OH jest przyłączona do atomu węgla uczestniczącego w wiązaniu podwójnym, opisany alkohol jest trwały.
Ustal wzór sumaryczny nienasyconego alkoholu monohydroksylowego opisanego w informacji. Napisz wzór półstrukturalny (grupowy) tego alkoholu.
Wzór sumaryczny:
Wzór półstrukturalny:
Zadanie 25. (1 pkt)
Detergenty to związki, których cząsteczki zawierają fragment hydrofilowy (grupę polarną) i część hydrofobową (łańcuch niepolarny). Poniżej przedstawiono wzór karnityny.
Rozstrzygnij, czy karnityna może być stosowana jako detergent. Odpowiedź uzasadnij – uwzględnij budowę cząsteczki karnityny.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 26. (1 pkt)
Serotonina, nazywana hormonem szczęścia, powstaje z aminokwasu białkowego – tryptofanu. W pierwszym etapie przedstawionego poniżej ciągu przemian tryptofan ulega reakcji substytucji, w wyniku czego powstaje hydroksylowa pochodna, która następnie przekształca się w serotoninę. W kolejnych przemianach z serotoniny powstaje melatonina.
Uzupełnij tabelę. Wpisz formalny stopień utlenienia atomu węgla oznaczonego literą a we wzorze cząsteczki tryptofanu oraz atomu węgla oznaczonego literą b we wzorze jego hydroksylowej pochodnej. Napisz, jaką funkcję (utleniacza albo reduktora) pełni tryptofan w pierwszym etapie przedstawionego ciągu przemian.
| Stopień utlenienia węgla a w tryptofanie | Stopień utlenienia węgla b w 5-hydroksytryptofanie | Funkcja tryptofanu |
|---|---|---|
Zadanie 27. (1 pkt)
Serotonina, nazywana hormonem szczęścia, powstaje z aminokwasu białkowego – tryptofanu. W pierwszym etapie przedstawionego poniżej ciągu przemian tryptofan ulega reakcji substytucji, w wyniku czego powstaje hydroksylowa pochodna, która następnie przekształca się w serotoninę. W kolejnych przemianach z serotoniny powstaje melatonina.
W dwóch nieoznakowanych probówkach znajdują się serotonina i melatonina.
Uzupełnij poniższe zdanie dotyczące możliwości rozróżnienia tych związków. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Zawartość obu probówek (może / nie może) być rozróżniona za pomocą wodnego roztworu chlorku żelaza(III), ponieważ (tylko w cząsteczkach melatoniny / tylko w cząsteczkach serotoniny / w cząsteczkach obu związków) występuje (ugrupowanie fenolowe / wiązanie amidowe / wiązanie estrowe).
Zadanie 28. (1 pkt)
Serotonina, nazywana hormonem szczęścia, powstaje z aminokwasu białkowego – tryptofanu. W pierwszym etapie przedstawionego poniżej ciągu przemian tryptofan ulega reakcji substytucji, w wyniku czego powstaje hydroksylowa pochodna, która następnie przekształca się w serotoninę. W kolejnych przemianach z serotoniny powstaje melatonina.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1. | W wyniku reakcji dekarboksylacji z serotoniny można otrzymać 5-hydroksytryptofan. | P | F |
| 2. | Serotonina, podobnie jak tryptofan, jest aminokwasem białkowym. | P | F |
| 3. | Cząsteczka związku A zawiera wiązanie amidowe (peptydowe). | P | F |
Zadanie 29. (3 pkt)
Akroleina, czyli propenal, o wzorze CH2=CH–CHO jest najprostszym nienasyconym aldehydem. Powstaje w wyniku termicznego rozkładu glicerolu. Produktem ubocznym tej reakcji jest woda. Akroleina podczas przechowywania ulega samorzutnie polimeryzacji.
29.1. (1 pkt)
Napisz równanie reakcji powstawania akroleiny w wyniku termicznego rozkładu glicerolu. Zastosuj półstrukturalne (grupowe) wzory związków organicznych.
29.2. (1 pkt)
Rozstrzygnij, czy akroleina występuje w postaci izomerów cis–trans. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
29.3. (1 pkt)
Dokończ poniższy zapis, tak aby przedstawiał on równanie reakcji polimeryzacji akroleiny. Zastosuj wzory półstrukturalne (grupowe).
n CH2=CH–CHO →
Zadanie 30. (1 pkt)
Jednym z termoplastycznych polimerów stosowanych do produkcji włókien syntetycznych i opakowań jest PET, czyli poli(tereftalan) etylenu o wzorze
Uzupełnij tabelę. Narysuj wzory półstrukturalne (grupowe) kwasu i alkoholu, z których można otrzymać ten polimer.
| Wzór kwasu | Wzór alkoholu |
|---|---|
Zadanie 31. (4 pkt)
Fermentacja jabłkowo-mlekowa to naturalny proces zachodzący podczas produkcji wina i wywołany przez bakterie kwasu mlekowego. W tym procesie kwas jabłkowy przekształca się w kwas mlekowy zgodnie z poniższym schematem:
31.1. (2 pkt)
Dla cząsteczek kwasu jabłkowego i mlekowego określ: formalny stopień utlenienia 3. atomu węgla oraz liczbę atomów węgla o danym typie hybrydyzacji orbitali walencyjnych. Uzupełnij tabelę.
| kwas jabłkowy | kwas mlekowy | |
|---|---|---|
| stopień utlenienia 3. atomu węgla | ||
| liczba atomów węgla o hybrydyzacji orbitali walencyjnych typu: |
||
| sp2 | ||
| sp3 | ||
31.2. (1 pkt)
Rozstrzygnij, czy cząsteczki kwasu jabłkowego są chiralne. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
31.3. (1 pkt)
Napisz wzory półstrukturalne (grupowe): produktu estryfikacji kwasu jabłkowego kwasem octowym i produktu całkowitej estryfikacji kwasu jabłkowego etanolem.
Produkt estryfikacji kwasem octowym:
Produkt estryfikacji etanolem:
Zadanie 32. (2 pkt)
Ester A o wzorze sumarycznym C9H10O2 hydrolizuje w środowisku o odczynie kwasowym do kwasu octowego i alkoholu B. Produktem utleniania alkoholu B jest kwas benzoesowy.
Napisz wzór półstrukturalny (grupowy) lub uproszczony estru A i alkoholu B.
| Wzór estru A | Wzór alkoholu B |
|---|---|
Zadanie 33. (1 pkt)
Kolejność występowania aminokwasów w peptydach zapisuje się za pomocą trzyliterowych kodów. Zapis ten zaczyna się od tak zwanego N-końca, czyli od tego aminokwasu, którego grupa aminowa połączona z atomem węgla α nie jest zaangażowana w tworzenie wiązań peptydowych.
W wyniku częściowej hydrolizy pewnego pentapeptydu, oprócz aminokwasów, otrzymano cztery dipeptydy o następujących sekwencjach: Gly-Tyr, Leu-Ser, Leu-Leu oraz Tyr-Leu. Ustalono ponadto, że w badanym pentapeptydzie aminokwasem stanowiącym N-koniec była glicyna.
Ustal sekwencję aminokwasów w analizowanym pentapeptydzie i napisz jego wzór. Zastosuj trzyliterowe kody aminokwasów.
Zadanie 34. (1 pkt)
Kolejność występowania aminokwasów w peptydach zapisuje się za pomocą trzyliterowych kodów. Zapis ten zaczyna się od tak zwanego N-końca, czyli od tego aminokwasu, którego grupa aminowa połączona z atomem węgla α nie jest zaangażowana w tworzenie wiązań peptydowych.
W wyniku częściowej hydrolizy pewnego pentapeptydu, oprócz aminokwasów, otrzymano cztery dipeptydy o następujących sekwencjach: Gly-Tyr, Leu-Ser, Leu-Leu oraz Tyr-Leu. Ustalono ponadto, że w badanym pentapeptydzie aminokwasem stanowiącym N-koniec była glicyna.
Przeprowadzono doświadczenie, w którym na stałą próbkę opisanego pentapeptydu podziałano stężonym kwasem azotowym(V).
Napisz, jaki efekt zaobserwowano podczas tego doświadczenia, i podaj nazwę zachodzącej reakcji.
Obserwacja:
Nazwa reakcji:
Zadanie 35. (4 pkt)
Przygotowano wodny roztwór peptydu o wzorze
Otrzymany roztwór podzielono na dwie porcje, które umieszczono w dwóch probówkach. Do probówki I wprowadzono zalkalizowaną zawiesinę świeżo strąconego wodorotlenku miedzi(II), po czym zawartość probówki wymieszano. Drugą porcję roztworu peptydu – w probówce II – poddano hydrolizie w środowisku kwasu solnego. Stwierdzono, że hydroliza peptydu zaszła całkowicie. Następnie, po zobojętnieniu, do otrzymanej mieszaniny poreakcyjnej dodano zalkalizowaną zawiesinę świeżo strąconego wodorotlenku miedzi(II) i wymieszano zawartość probówki.
35.1. (1 pkt)
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeżeli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1. | Aminokwasy, z których powstał opisany peptyd, są aminokwasami białkowymi. | P | F |
| 2. | Pomiędzy cząsteczkami tego peptydu mogą tworzyć się mostki disulfidowe (disiarczkowe). | P | F |
| 3. | Opisany peptyd jest dipeptydem. | P | F |
35.2. (2 pkt)
Napisz, co zaobserwowano po dodaniu zawiesiny świeżo strąconego wodorotlenku miedzi(II) do probówki I. Następnie rozstrzygnij, czy taki sam przebieg doświadczenia zaobserwowano po dodaniu zawiesiny świeżo strąconego wodorotlenku miedzi(II) do probówki II – po przeprowadzeniu całkowitej hydrolizy peptydu. Odpowiedź uzasadnij.
Probówka I:
Probówka II:
Rozstrzygnięcie:
Uzasadnienie:
35.3. (1 pkt)
Poniżej przedstawiono wzory ogólne czterech form aminokwasów (–R oznacza łańcuch boczny).
Spośród przedstawionych wzorów wybierz ten, który ilustruje formę, w jakiej występują aminokwasy w mieszaninie poreakcyjnej otrzymanej w wyniku hydrolizy peptydu w środowisku kwasu solnego. Napisz numer tego wzoru.
Zadanie 36. (2 pkt)
Disacharyd o wzorze
poddano hydrolizie.
36.1. (1 pkt)
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeżeli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1. | Opisany disacharyd daje pozytywny wynik próby Trommera. | P | F |
| 2. | Jednostki monosacharydowe są połączone w cząsteczce tego sacharydu wiązaniem 1,1-glikozydowym. | P | F |
| 3. | Produktem hydrolizy opisanego sacharydu jest D-glukoza. | P | F |
36.2. (1 pkt)
Do roztworu otrzymanego w wyniku hydrolizy opisanego disacharydu wprowadzono zawiesinę świeżo strąconego wodorotlenku miedzi(II) w alkalicznym środowisku. Po ogrzaniu zaobserwowano powstanie ceglastego osadu.
Spośród przedstawionych poniżej wzorów wybierz ten, który ilustruje budowę organicznego produktu opisanej reakcji obecnego w mieszaninie poreakcyjnej. Podkreśl wybrany wzór.
