Matura Maj 2021, Poziom rozszerzony (Formuła 2015) - Zadanie 5. (1 pkt)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
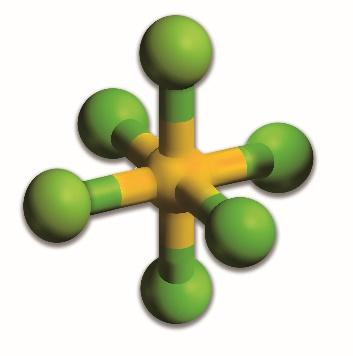
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
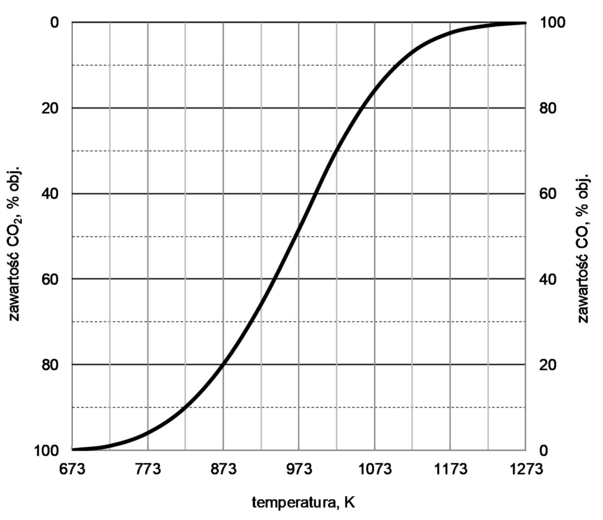
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Rozstrzygnij, czy reakcja pomiędzy tlenkiem węgla(IV) i węglem jest procesem egzoenergetycznym. Uzasadnij swoją odpowiedź.
Rozstrzygnięcie:
Uzasadnienie: