Chemia - Matura Marzec 2021, Poziom rozszerzony (Formuła 2015)
Zadanie 1. (2 pkt)
Konfigurację elektronową dwudodatniego kationu pierwiastka X przedstawia zapis: [Ar]3d10.
1.1. (0–1)
Uzupełnij poniższą tabelę. Wpisz symbol chemiczny pierwiastka X, numer grupy oraz symbol bloku konfiguracyjnego, do którego należy ten pierwiastek.
| Symbol pierwiastka | Numer grupy | Symbol bloku |
|---|---|---|
1.2. (0–1)
Uzupełnij poniższy schemat. Przedstaw pełną konfigurację elektronową atomu (w stanie podstawowym) pierwiastka X. Zastosuj schemat klatkowy. W zapisie uwzględnij numery powłok i symbole podpowłok.
Zadanie 2. (1 pkt)
Pierwsza energia jonizacji (Ej1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej2, Ej3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej.
W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.
| Nazwa pierwiastka | Energia jonizacji, 106 · J · mol−1 | ||||
| pierwsza | druga | trzecia | czwarta | piąta | |
| wodór | 1,31 | – | – | – | – |
| lit | 0,52 | 7,30 | 11,81 | – | – |
| sód | 0,49 | 4,56 | 6,91 | 9,54 | 13,35 |
| potas | 0,42 | 3,05 | 4,41 | 5,88 | 7,98 |
| rubid | 0,40 | 2,63 | 3,90 | 5,08 | 6,85 |
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Wyjaśnij, dlaczego wartość pierwszej energii jonizacji atomu wodoru jest dużo większa niż wartość pierwszej energii jonizacji atomów kolejnych pierwiastków pierwszej grupy.
Zadanie 3. (1 pkt)
Pierwsza energia jonizacji (Ej1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej2, Ej3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej.
W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.
| Nazwa pierwiastka | Energia jonizacji, 106 · J · mol−1 | ||||
| pierwsza | druga | trzecia | czwarta | piąta | |
| wodór | 1,31 | – | – | – | – |
| lit | 0,52 | 7,30 | 11,81 | – | – |
| sód | 0,49 | 4,56 | 6,91 | 9,54 | 13,35 |
| potas | 0,42 | 3,05 | 4,41 | 5,88 | 7,98 |
| rubid | 0,40 | 2,63 | 3,90 | 5,08 | 6,85 |
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Pierwsza energia jonizacji litowca jest (mniejsza / większa) niż druga energia jonizacji, ponieważ:
- (łatwiej / trudniej) oderwać elektron od jonu naładowanego dodatnio niż od obojętnego atomu
oraz
- przyciąganie przez jądro elektronu z przedostatniej powłoki jest (silniejsze / słabsze) niż przyciąganie elektronu z powłoki ostatniej.
Zadanie 4. (1 pkt)
Pierwsza energia jonizacji (Ej1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej2, Ej3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej.
W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.
| Nazwa pierwiastka | Energia jonizacji, 106 · J · mol−1 | ||||
| pierwsza | druga | trzecia | czwarta | piąta | |
| wodór | 1,31 | – | – | – | – |
| lit | 0,52 | 7,30 | 11,81 | – | – |
| sód | 0,49 | 4,56 | 6,91 | 9,54 | 13,35 |
| potas | 0,42 | 3,05 | 4,41 | 5,88 | 7,98 |
| rubid | 0,40 | 2,63 | 3,90 | 5,08 | 6,85 |
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1. | W grupie pierwiastków: lit, sód i rubid, obserwujemy, że im mniejsza elektroujemność, tym większa jest wartość pierwszej energii jonizacji. | P | F |
| 2. | W grupie pierwiastków: sód, potas i rubid, obserwujemy, że im większy promień atomu, tym mniejsza jest wartość pierwszej energii jonizacji. | P | F |
| 3. | Wartości czwartej i piątej energii jonizacji potasu dotyczą elektronów należących do różnych powłok. | P | F |
Zadanie 5. (2 pkt)
Sacharoza dobrze rozpuszcza się w wodzie, a jej rozpuszczalność w dużym stopniu zależy od
temperatury.
Przygotowano nasycony wodny roztwór sacharozy w temperaturze 80°C. Następnie
ochłodzono go do temperatury 20°C i stwierdzono, że wykrystalizowało 1590 g sacharozy,
a roztwór, który pozostał po krystalizacji, miał masę 3040 g.
Oblicz rozpuszczalność sacharozy (w gramach na 100 gramów wody) w temperaturze 80°C, jeśli w temperaturze 20°C jest ona równa 204 g na 100 g wody.
Zadanie 6. (1 pkt)
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Działanie katalizatora prowadzi do (obniżenia / podwyższenia) energii aktywacji katalizowanej reakcji. Obecność katalizatora (wpływa / nie wpływa) na wydajność procesu. Katalizatory (zmieniają szybkość / nie zmieniają szybkości), z jaką układ osiąga stan równowagi.
Zadanie 7. (1 pkt)
Poniżej przedstawiono równanie reakcji syntezy amoniaku.
N2 + 3H2 ⇄ 2NH3 ΔH = – 91,8 kJ
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Wzrost temperatury w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku. Dodanie do reaktora większej ilości wodoru przyczyni się do (spadku / wzrostu) ilości amoniaku w mieszaninie poreakcyjnej. Obniżenie ciśnienia w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku.
Zadanie 8. (2 pkt)
Siarczan(VI) sodu tworzy hydraty o różnym składzie. Próbkę jednego z hydratów tej soli, o masie 8,050 g, rozpuszczono w wodzie i otrzymano 100,0 cm3 roztworu, po czym dodano do niego 50,0 cm3 roztworu azotanu(V) baru o stężeniu 0,600 mol·dm–3. Wytrącony osad siarczanu(VI) baru po odsączeniu i wysuszeniu miał masę 5,825 g.
Ustal wzór hydratu siarczanu(VI) sodu użytego w opisanym doświadczeniu. Przyjmij, że opisane przemiany przebiegły z wydajnością równą 100%, a masy molowe są równe:
MNa2SO4 =142 g ⋅ mol−1 , MBaSO4 = 233 g ⋅ mol−1.
Wzór hydratu:
Zadanie 9. (1 pkt)
Do dwóch zlewek zawierających jednakowe objętości wody o temperaturze t = 20°C dodano:
- do zlewki I – próbkę metalicznego magnezu
- do zlewki II – próbkę metalicznego wapnia.
Tylko w jednej zlewce zaobserwowano objawy reakcji chemicznej.
Napisz w formie jonowej równanie reakcji zachodzącej podczas opisanego doświadczenia. Wyjaśnij przyczynę różnej aktywności chemicznej badanych metali.
Równanie reakcji:
Wyjaśnienie:
Zadanie 10. (1 pkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
Napisz wzory sumaryczne tych soli w kolejności wzrastającego pH ich wodnych roztworów.
Zadanie 11. (2 pkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
11.1. (0–1)
Napisz w formie jonowej skróconej równanie reakcji zachodzącej w roztworze chlorku amonu.
11.2. (0–1)
Określ, jaką funkcję (kwasu czy zasady Brønsteda) pełni woda w reakcji zachodzącej w roztworze fluorku sodu.
Zadanie 12. (2 pkt)
Odmierzono 10,0 cm3 kwasu solnego o stężeniu c = 10,0% masowych i gęstości d = 1,05 g · cm–3, a następnie rozcieńczono ten kwas wodą destylowaną do objętości 750 cm3.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2015.
Oblicz pH otrzymanego roztworu. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Zadanie 13. (2 pkt)
Poniższy wykres przedstawia zależność rozpuszczalności molowej – czyli stężenia molowego substancji w jej roztworze nasyconym – wodorotlenku glinu od pH roztworu wodnego w temperaturze 25°C. W tym ujęciu rozpuszczalność związku uwzględniła powstawanie rozpuszczalnych produktów reakcji, jakim ten związek ulega w zależności od pH roztworu.
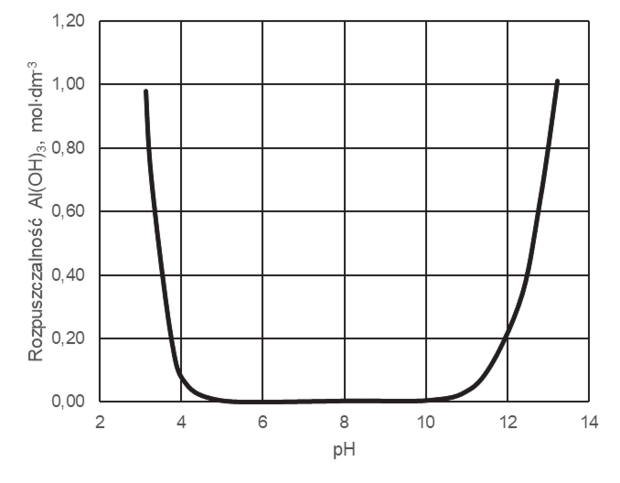
Na podstawie: G. Charlot, Analiza nieorganiczna jakościowa, Warszawa 1976.
Napisz, jaka właściwość chemiczna wodorotlenku glinu decyduje o zmianach rozpuszczalności tego związku przedstawionych na wykresie. Napisz w formie jonowej skróconej równania reakcji potwierdzające charakter chemiczny wodorotlenku glinu.
Charakter chemiczny:
Równania reakcji:
Zadanie 14. (1 pkt)
W trzech ponumerowanych probówkach znajdowały się bezbarwne wodne roztwory: azotanu(V) srebra(I), chlorku glinu i wodorotlenku potasu. Roztwory mieszano ze sobą, a obserwacje z przeprowadzonych doświadczeń przedstawiono w poniższej tabeli.
| Numer probówki | ||||
| 1 | 2 | 3 | ||
| Numer probówki | 1 | ─ | biały galaretowaty osad | biały ciemniejący osad |
| 2 | biały galaretowaty osad | ─ | brunatny osad | |
| 3 | biały ciemniejący osad | brunatny osad | ─ | |
Wpisz do tabeli wzory substancji, których roztwory znajdowały się w probówkach 1–3.
| Numer probówki | ||
| 1 | 2 | 3 |
Zadanie 15. (2 pkt)
Węglan sodu to jeden z najważniejszych produktów nieorganicznego przemysłu chemicznego. Jest otrzymywany metodą amoniakalną, w której surowcami są amoniak, chlorek sodu oraz węglan wapnia. Proces składa się z wielu etapów. Jednym z produktów ubocznych okazuje się chlorek amonu, z którego, w wyniku działania wodorotlenkiem wapnia, odzyskiwany jest amoniak. Ostateczny produkt (węglan sodu) powstaje w wyniku ogrzewania wodorowęglanu sodu w procesie zwanym kalcynacją.
Napisz w formie cząsteczkowej równanie reakcji odzyskiwania amoniaku z chlorku amonu (równanie 1.) oraz równanie reakcji kalcynacji wodorowęglanu sodu (równanie 2.).
Równanie 1.:
Równanie 2.:
Zadanie 16. (5 pkt)
Masz do dyspozycji: srebrzystoszarą płytkę ze srebra i czerwonoróżową płytkę miedzianą oraz wodne roztwory azotanu(V) srebra(I) i azotanu(V) miedzi(II).
16.1. (0–2)
Zaprojektuj doświadczenie, podczas którego można zaobserwować zmiany świadczące o przebiegu reakcji chemicznej. Uzupełnij schemat doświadczenia – wybierz i podkreśl po jednym odczynniku w zestawach I i II oraz opisz zmiany zaobserwowane podczas przeprowadzonego doświadczenia.
| Zmiana wyglądu płytki | Zmiana wyglądu roztworu |
|---|---|
16.2. (0–1)
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Przebieg doświadczenia potwierdził, że miedź jest (silniejszym / słabszym) reduktorem niż srebro oraz że silniejsze właściwości utleniające mają kationy (Cu2+ / Ag+). Potencjał E° półogniwa Cu|Cu2+ jest (niższy / wyższy) od potencjału półogniwa Ag|Ag+.
16.3. (0–2)
Rozstrzygnij, czy podczas przeprowadzonego doświadczenia sumaryczne stężenie molowe kationów oraz sumaryczne stężenie molowe anionów się zmieniły (wzrosły albo zmalały), czy też nie uległy zmianie. Uzupełnij poniższe zdania i uzasadnij odpowiedź.
Stężenie molowe kationów w roztworze (wzrosło / zmalało / nie uległo zmianie).
Uzasadnienie:
Stężenie molowe anionów w roztworze (wzrosło / zmalało / nie uległo zmianie).
Uzasadnienie:
Zadanie 17. (2 pkt)
Tlenek manganu(IV) w reakcjach utleniania-redukcji może pełnić funkcję reduktora lub utleniacza.
W reakcjach tlenku manganu(IV) z kwasami powstają sole manganu(II).
Podaj wzory wszystkich produktów reakcji tlenku manganu(IV):
- z kwasem solnym
- z kwasem siarkowym(VI).
Zadanie 18. (2 pkt)
Tlenek manganu(IV) w reakcjach utleniania-redukcji może pełnić funkcję reduktora lub utleniacza.
Tlenek manganu(IV) reaguje z tlenem w środowisku zasadowym. W reakcji powstają sole manganu(VI).
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas reakcji tlenku manganu(IV) z tlenem w środowisku zasadowym (NaOH). Napisz w formie cząsteczkowej sumaryczne równanie zachodzącej reakcji.
Równanie procesu redukcji:
Równanie procesu utlenienia:
Sumaryczne równanie reakcji:
Zadanie 19. (3 pkt)
Zawartość jonów dichromianowych(VI) w wodnym roztworze można określić dzięki zastosowaniu metody pośredniej. W pierwszym etapie dodaje się roztwór jodku potasu i kwas siarkowy(VI). Zachodzi wtedy reakcja opisana równaniem:
Cr2O2–7 + 6I− +14H+ → 2Cr3+ + 3I2 + 7H2O
W drugim etapie do otrzymanej mieszaniny dodaje się roztwór tiosiarczanu sodu i wtedy jony S2O2−3 reagują z jodem:
I2 + 2S2O2−3 → 2 I− + S4O2–6
19.1. (0–1)
Rozstrzygnij, czy jony dichromianowe(VI) w etapie pierwszym oraz jod w etapie drugim pełnią taką samą funkcję (utleniacza albo reduktora). Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
19.2. (0–2)
Aby określić zawartość jonów dichromianowych(VI) w próbce, przeprowadzono opisane reakcje. W reakcji z jodem wzięło udział 20,4 cm3 wodnego roztworu tiosiarczanu sodu o stężeniu 0,10 mol∙dm3 .
Oblicz, ile gramów dichromianu(VI) potasu zawierała badana próbka. Przyjmij, że opisane przemiany przebiegły z wydajnością równą 100% oraz że masa molowa dichromianu(VI) potasu MK2Cr2O7 = 294 g⋅ mol−1.
Zadanie 20. (2 pkt)
Poniżej przedstawiono wartości energii wiązań chemicznych pomiędzy atomami węgla oraz długości tych wiązań w cząsteczkach etanu, etenu i etynu.
| Cząsteczka | Energia wiązania, kJ · mol –1 | Długość wiązania, pm |
|---|---|---|
| etan | 376 | 154 |
| eten | 611 | 133 |
| etyn | 835 | 120 |
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
- W cząsteczce etenu orbitalom walencyjnym atomów węgla przypisuje się hybrydyzację (sp3 / sp2). Podwójne wiązanie węgiel – węgiel w cząsteczce etenu powstaje w wyniku uwspólnienia (dwóch / czterech) elektronów.
- Cząsteczki etynu są (liniowe / trygonalne).
- Wraz ze wzrostem długości wiązania (rośnie / maleje) wartość energii niezbędnej do rozerwania wiązania.
Zadanie 21. (1 pkt)
Jednym z produktów reakcji etanu z chlorem oraz produktem reakcji etenu z chlorowodorem jest ten sam związek organiczny.
Narysuj wzór elektronowy opisanego związku. Zaznacz kreskami wszystkie wspólne i wolne pary elektronowe.
Zadanie 22. (2 pkt)
Do całkowitego spalenia próbki zawierającej 8,43·1022 cząsteczek pewnego węglowodoru zużyto 15,68 dm3 tlenu odmierzonego w warunkach normalnych. W reakcji wydzieliło się 18,48 g tlenku węgla(IV).
Ustal na podstawie obliczeń wzór sumaryczny tego węglowodoru.
Wzór sumaryczny:
Zadanie 23. (1 pkt)
W cząsteczce benzenu wszystkie atomy węgla są równocenne, natomiast w cząsteczkach pochodnych benzenu, w których jeden atom wodoru został zastąpiony innym podstawnikiem, następuje zróżnicowanie właściwości chemicznych atomów węgla tworzących pierścień. To zróżnicowanie uwidacznia się m.in. w przebiegu reakcji nitrowania. W poniższej tabeli przedstawiono, z jaką wydajnością powstają izomeryczne produkty nitrowania dwóch monopochodnych benzenu: nitrobenzenu i fenolu.
Rodzaj podstawnika już przyłączonego do pierścienia wpływa także na reaktywność tego pierścienia. Poniższe zestawienie ilustruje wpływ podstawnika na względną szybkość reakcji nitrowania.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2000.
Napisz równanie reakcji nitrowania mononitrobenzenu prowadzącej do powstania głównego produktu organicznego oraz określ mechanizm (elektrofilowy, nukleofilowy, rodnikowy) tej reakcji. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Równanie reakcji:
Mechanizm:
Zadanie 24. (1 pkt)
W cząsteczce benzenu wszystkie atomy węgla są równocenne, natomiast w cząsteczkach pochodnych benzenu, w których jeden atom wodoru został zastąpiony innym podstawnikiem, następuje zróżnicowanie właściwości chemicznych atomów węgla tworzących pierścień. To zróżnicowanie uwidacznia się m.in. w przebiegu reakcji nitrowania. W poniższej tabeli przedstawiono, z jaką wydajnością powstają izomeryczne produkty nitrowania dwóch monopochodnych benzenu: nitrobenzenu i fenolu.
Rodzaj podstawnika już przyłączonego do pierścienia wpływa także na reaktywność tego pierścienia. Poniższe zestawienie ilustruje wpływ podstawnika na względną szybkość reakcji nitrowania.
Napisz wzory półstrukturalne (grupowe) lub uproszczone izomerycznych produktów mononitrowania fenolu.
Wzory produktów mononitrowania fenolu:
Zadanie 25. (1 pkt)
W cząsteczce benzenu wszystkie atomy węgla są równocenne, natomiast w cząsteczkach pochodnych benzenu, w których jeden atom wodoru został zastąpiony innym podstawnikiem, następuje zróżnicowanie właściwości chemicznych atomów węgla tworzących pierścień. To zróżnicowanie uwidacznia się m.in. w przebiegu reakcji nitrowania. W poniższej tabeli przedstawiono, z jaką wydajnością powstają izomeryczne produkty nitrowania dwóch monopochodnych benzenu: nitrobenzenu i fenolu.
Rodzaj podstawnika już przyłączonego do pierścienia wpływa także na reaktywność tego pierścienia. Poniższe zestawienie ilustruje wpływ podstawnika na względną szybkość reakcji nitrowania.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2000.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeżeli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1. | Atom chloru jest podstawnikiem aktywującym pierścień aromatyczny w reakcji nitrowania. | P | F |
| 2. | Szybkość reakcji nitrowania fenolu jest tysiąc razy większa od szybkości reakcji nitrowania benzenu. | P | F |
| 3. | W reakcji nitrowania najbardziej reaktywny spośród wymienionych związków jest nitrobenzen. | P | F |
Zadanie 26. (2 pkt)
Poniżej przedstawiono ciąg przemian chemicznych, w których biorą udział związki organiczne, umownie oznaczone literami A, B, C i D, a produktem ostatecznym jest 2-bromopropan. Związek B jest izomerem, w którym atom chloru jest przyłączony do atomu węgla o niższej rzędowości.
A Cl2, światło1. B NaOH2. C Al2O3, T3. D HBr4. 2-bromopropan
Napisz równania reakcji oznaczonych numerami 1 i 3. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Reakcja 1.:
Reakcja 3.:
Zadanie 27. (1 pkt)
Poniżej przedstawiono ciąg przemian chemicznych, w których biorą udział związki organiczne, umownie oznaczone literami A, B, C i D, a produktem ostatecznym jest 2-bromopropan. Związek B jest izomerem, w którym atom chloru jest przyłączony do atomu węgla o niższej rzędowości.
A Cl2, światło1. B NaOH2. C Al2O3, T3. D HBr4. 2-bromopropan
Uzupełnij poniższą tabelę. Określ typ reakcji 2. (addycja, eliminacja, substytucja) oraz jej mechanizm (rodnikowy, elektrofilowy, nukleofilowy).
| Typ reakcji | Mechanizm reakcji | |
| reakcja 2. |
Zadanie 28. (1 pkt)
Mieszaninę 1 zawierającą trzy izomeryczne alkohole A, B i C o wzorze sumarycznym C4H10O poddano łagodnemu utlenianiu za pomocą tlenku miedzi(II). Następnie otrzymaną mieszaninę 2 utleniono tlenem z powietrza. W wyniku opisanych przemian otrzymano mieszaninę 3, która zawierała trzy różne związki organiczne:
- alkohol B;
- produkt dwóch kolejnych przemian, którym uległ alkohol C;
- produkt jednej przemiany alkoholu A.
Określ rzędowość każdego z alkoholi i wpisz do tabeli litery, którymi je oznaczono.
| Alkohol | Rzędowość |
|---|---|
| I | |
| II | |
| III |
Zadanie 29. (2 pkt)
Mieszaninę 1 zawierającą trzy izomeryczne alkohole A, B i C o wzorze sumarycznym C4H10O poddano łagodnemu utlenianiu za pomocą tlenku miedzi(II). Następnie otrzymaną mieszaninę 2 utleniono tlenem z powietrza. W wyniku opisanych przemian otrzymano mieszaninę 3, która zawierała trzy różne związki organiczne:
- alkohol B;
- produkt dwóch kolejnych przemian, którym uległ alkohol C;
- produkt jednej przemiany alkoholu A.
Produkt przemian alkoholu C nie zawiera w swojej cząsteczce III-rzędowych atomów węgla.
Napisz wzory półstrukturalne (grupowe) trzech związków organicznych wchodzących w skład mieszaniny 3.
| Składnik w mieszaninie 3 | ||
| alkohol B | produkt dwóch kolejnych przemian, którym uległ alkohol C |
produkt jednej przemiany alkoholu A |
Zadanie 30. (1 pkt)
Aldehydy i ketony o małych masach cząsteczkowych, np. metanal i propanon, są rozpuszczalne w wodzie. W miarę wzrostu masy cząsteczkowej rozpuszczalność aldehydów i ketonów w wodzie maleje.
Napisz, co jest przyczyną dobrej rozpuszczalności metanalu i propanonu w wodzie, oraz opisz przyczynę zmniejszania się rozpuszczalności aldehydów i ketonów w wodzie wraz ze wzrostem masy cząsteczkowej tych związków. Odnieś się do budowy cząsteczek związków karbonylowych.
Dobra rozpuszczalność metanalu i propanonu w wodzie wynika z
Wraz ze wzrostem masy cząsteczkowej aldehydów i ketonów rozpuszczalność tych związków
w wodzie zmniejsza się, ponieważ
Zadanie 31. (2 pkt)
Reakcja aldolowa, przebiegająca w środowisku rozcieńczonej zasady, prowadzi do połączenia dwóch cząsteczek aldehydu lub ketonu i utworzenia wiązania między atomem węgla α jednej cząsteczki i karbonylowym atomem węgla drugiej cząsteczki. Produktem jest β-hydroksyaldehyd (aldol) lub β-hydroksyketon. Reakcji ulegają wszystkie aldehydy i ketony zawierające atomy wodoru α, czyli atom wodoru zlokalizowany przy atomie węgla połączonym z grupą aldehydową lub ketonową.
Jeśli etanal zostanie poddany działaniu zasady, takiej jak etanolan sodu lub wodorotlenek sodu, wówczas zachodzi szybka, odwracalna reakcja:
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2003.
31.1. (0–1)
Napisz nazwę systematyczną produktu reakcji aldolowej etanalu.
31.2. (0–1)
Napisz równanie reakcji aldolowej propanalu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 32. (2 pkt)
Celem doświadczenia przedstawionego na poniższym schemacie było potwierdzenie właściwości redukujących kwasu metanowego.
32.1. (0–1)
Spośród poniższych obserwacji wybierz i podkreśl wszystkie te zmiany, które można zaobserwować podczas wykonanego doświadczenia.
- wytrąca się zielony osad
- roztwór zmienia barwę z pomarańczowej na ciemnozieloną
- fioletowy roztwór się odbarwia
- roztwór zmienia barwę z pomarańczowej na żółtą
- wydziela się gaz
32.2. (0–1)
Wyjaśnij na podstawie budowy cząsteczki, dlaczego kwas metanowy wykazuje właściwości redukujące.
Zadanie 33. (1 pkt)
Poniżej przedstawiono wzór związku zawierającego azot.
Zaznacz poprawne dokończenie zdania.
Związek o podanym wzorze jest
- solą kwasu azotowego(III).
- solą kwasu azotowego(V).
- estrem kwasu azotowego(V).
- związkiem nitrowym.
Zadanie 34. (2 pkt)
W temperaturze 25°C do 1 mola kwasu etanowego dodano 1 mol etanolu i uzyskano mieszaninę o objętości V. Do otrzymanej mieszaniny dodano niewielką ilość stężonego kwasu siarkowego(VI). Przebiegła reakcja i w temperaturze 25°C ustalił się stan równowagi, co zilustrowano równaniem:
CH3COOH + CH3CH2OH H+ CH3COOCH2CH3 + H2O
Stężeniowa stała równowagi tej reakcji w temperaturze 25°C jest równa Kc = 4.
Oblicz wydajność opisanej reakcji estryfikacji w temperaturze 25°C.
Zadanie 35. (1 pkt)
Poniżej przedstawiono, za pomocą trzyliterowych symboli aminokwasów, wzór pewnego tetrapeptydu.
Ser-Gly-Cys-Ala
W notacji tej z lewej strony umieszcza się kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α.
Rozstrzygnij, czy wolna grupa karboksylowa, która znajduje się w cząsteczce tetrapeptydu i nie wzięła udziału w tworzeniu wiązań peptydowych w tym związku, pochodzi od cząsteczki seryny (Ser). Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 36. (1 pkt)
Poniżej przedstawiono, za pomocą trzyliterowych symboli aminokwasów, wzór pewnego tetrapeptydu.
Ser-Gly-Cys-Ala
W notacji tej z lewej strony umieszcza się kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α.
W skład opisanego tetrapeptydu wchodzi aminokwas niewykazujący czynności optycznej.
Uzupełnij poniższy schemat tak, aby ilustrował reakcje chemiczne, którym ulega opisany aminokwas. Uwzględnij dominującą formę, w jakiej występuje on w roztworze wodnym o odczynie odpowiadającym punktowi izoelektrycznemu. Zastosuj wzory półstrukturalne (grupowe) reagentów organicznych.
Zadanie 38. (1 pkt)
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1. | Proces fermentacji octowej zachodzi w warunkach beztlenowych. | P | F |
| 2. | Podczas wyrobu ciasta drożdżowego zachodzi proces fermentacji alkoholowej. | P | F |
| 3. | Podczas kiszenia kapusty powstaje kwas mlekowy. | P | F |
