Matura Maj 2022, Poziom rozszerzony (Formuła 2015) - Zadanie 8. (4 pkt)
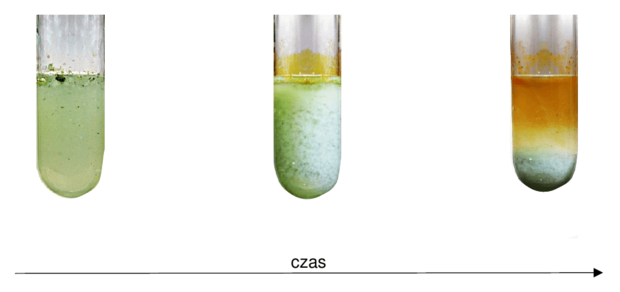
Poniższy schemat przedstawia przemiany, jakim ulegają miedź i jej związki.
Cu (s) A1. CuCl2 (aq) B2. Cu(OH)2 (s) NH3 (aq)3. [Cu(NH3)4](OH)2 (aq)
8.1. (0–1)
Rozstrzygnij, czy substancją A może być kwas solny o stężeniu 10 % masowych. Uzasadnij swoją odpowiedź. W uzasadnieniu odwołaj się do właściwości miedzi i kwasu solnego.
Rozstrzygnięcie:
Uzasadnienie:
8.2. (0–2)
Napisz wzór sumaryczny substancji B, jeśli wiadomo, że po zajściu reakcji i odsączeniu osadu w roztworze obecne były kationy sodu i aniony chlorkowe. Napisz w formie jonowej równanie reakcji 3., której produktem jest m.in. jon kompleksowy o wzorze [Cu(NH3)4]2+.
Wzór substancji B:
Równanie reakcji 3.:
8.3. (0–1)
Spośród podanych poniżej wzorów wybierz wzory wszystkich substancji, w których wodnych roztworach na zimno roztwarza się wodorotlenek miedzi(II). Napisz numery wybranych wzorów.
Wybrane wzory: